蛋白质组学揭示阿尔茨海默病大脑中淀粉样纤维聚集和毒性的修饰因子
2024-04-22

背景
阿尔茨海默病(AD)的主要致病原因是淀粉样β蛋白(Aβ)的积累。作者使用了蛋白质组学等技术来研究淀粉样β蛋白原纤维如何在阿尔茨海默病大脑中形成并引起神经毒性。对淀粉样原纤维中Aβ肽亚型的分析显示,纯化的原纤维主要含有Aβ42和Aβ38,而Aβ40是含量最少。体外多肽研究表明,Aβ38可以加速Aβ42纤维的形成。作者确定了金属硫蛋白- 3(MT3)在体外影响Aβ42的聚集。总之,该研究为AD淀粉样原纤维提供了新的描述,并阐明了一组Aβ相互作用蛋白对原纤维形成和体内毒性的功能影响。
参考文献:Amyloid fibril proteomics of AD brains reveals modifiers of aggregation and toxicity. Mol Neurodegener. 2023:18(1):61.
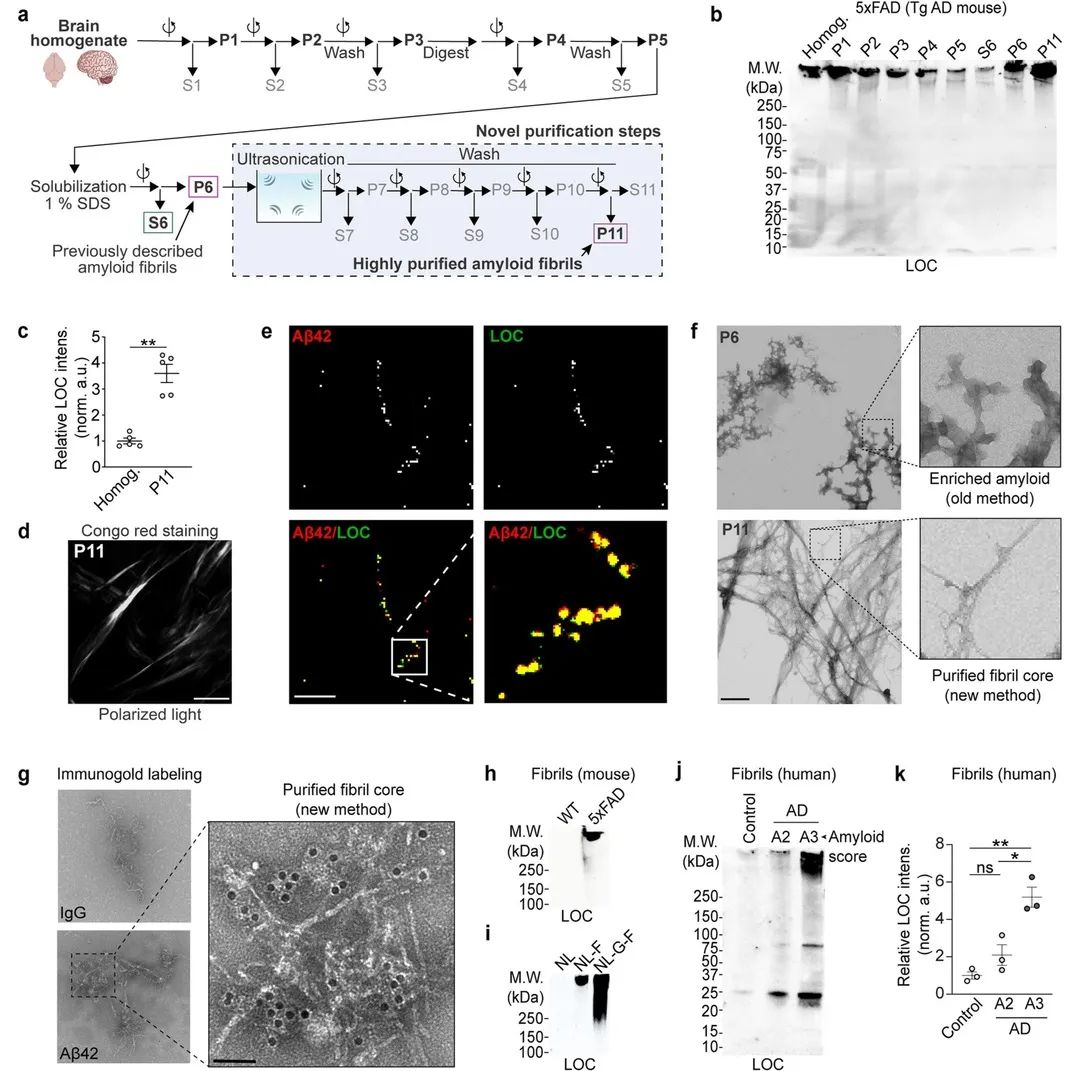
图1
作者开发了一种基于蔗糖密度梯度离心和超声的纯化方法,以从淀粉样小鼠模型和死亡AD患者大脑中分离淀粉样纤维(图1a)。作者发现材料P11高度富集含有Aβ42的纤维物质(图1b和1c)。刚果红染色证实纯化的蛋白质聚合体含有淀粉样蛋白(图1d)。同时,纯化的淀粉样蛋白原纤维被证实含有Aβ42肽(图1e)。为了评估纯化材料的结构多样性,作者使用了负染色电子显微镜(EM)发现了抗SDS的个体淀粉样纤维和纤维束的存在(图1f)。免疫金标记证实这些纤维束含有Aβ1-42(图1g)。作者发现5xFAD、AppNL−F/NL−F和AppNL−G−F/NL−G−F小鼠脑内有纤维,但野生型或AppNL/NL脑内无纤维(图1h-i)。WB和ELISA显示,与对照样本相比,从人类AD脑提取物纯化的不溶性淀粉样蛋白中,高分子量聚集物的丰度显著增加(图1j-k)。基于多次检测的结果,作者开发了一种分离淀粉样纤维的新方法。
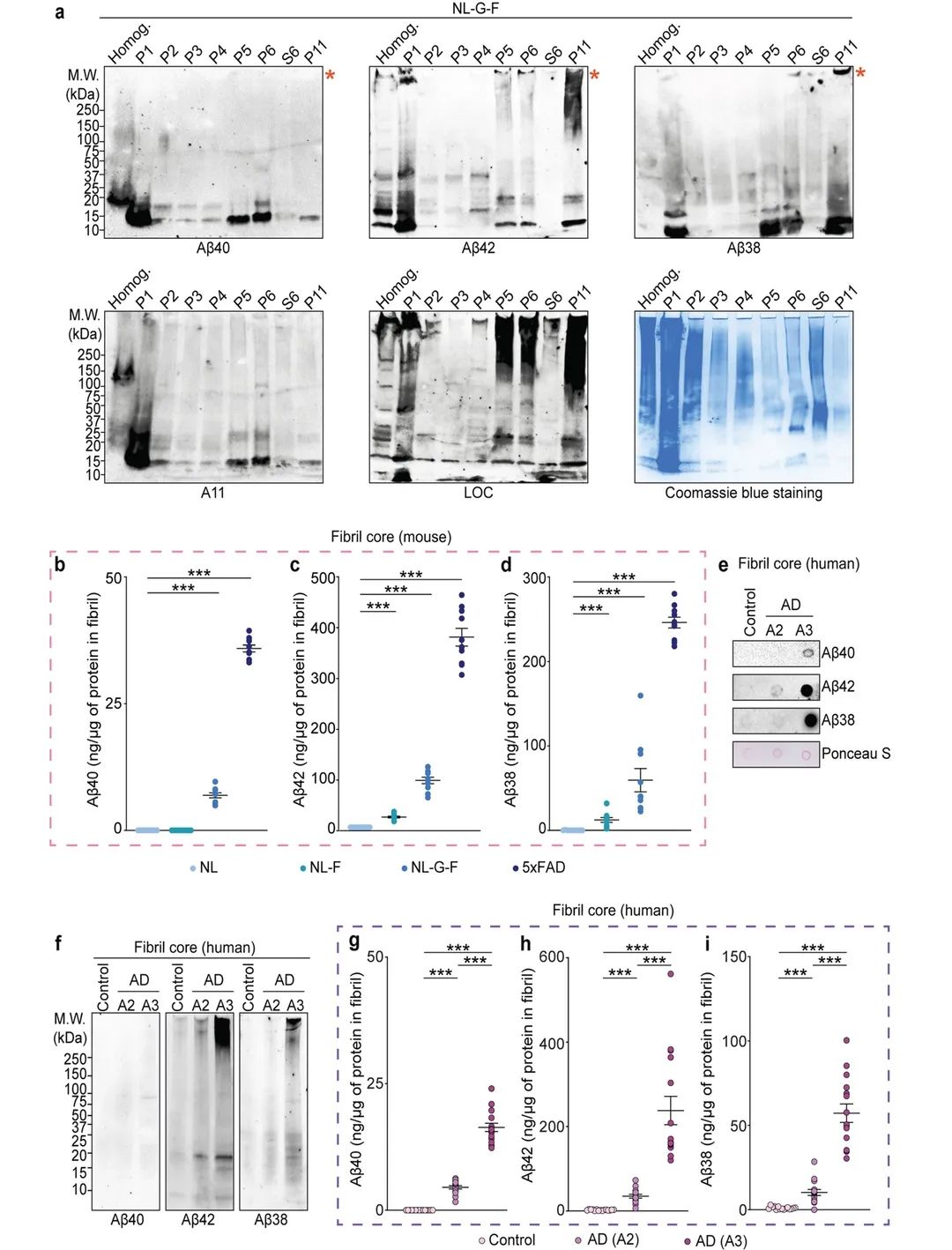
图2
纯化的纤维主要含有Aβ38和Aβ42,而Aβ40含量最低(图2a)。5xFAD、AppNL−F/ NL−F和AppNL−G−F/NL−G−F小鼠大脑分离的纯化物中,这三种Aβ肽均显著富集(图2b-d)。此外,从人类AD大脑分离的淀粉样原纤维也包含这三种Aβ肽(图2e-f)。最后,Aβ的ELISA分析证实,三种Aβ肽均在纯化的AD人脑原纤维中富集(图2g-i)。
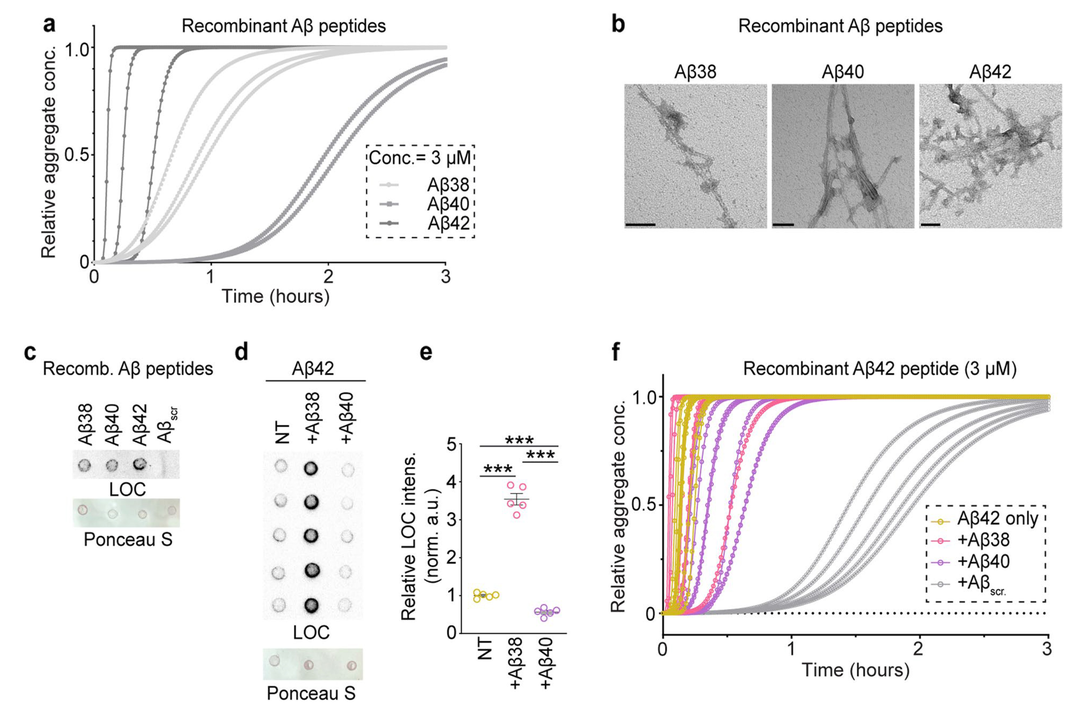
图3
作者使用基于THT的动力学分析、斑点杂交和EM分析等技术确定抗SDS的淀粉样纤维主要由Aβ42和一些Aβ38组成,Aβ38可促进Aβ42纤维的形成(图3)。
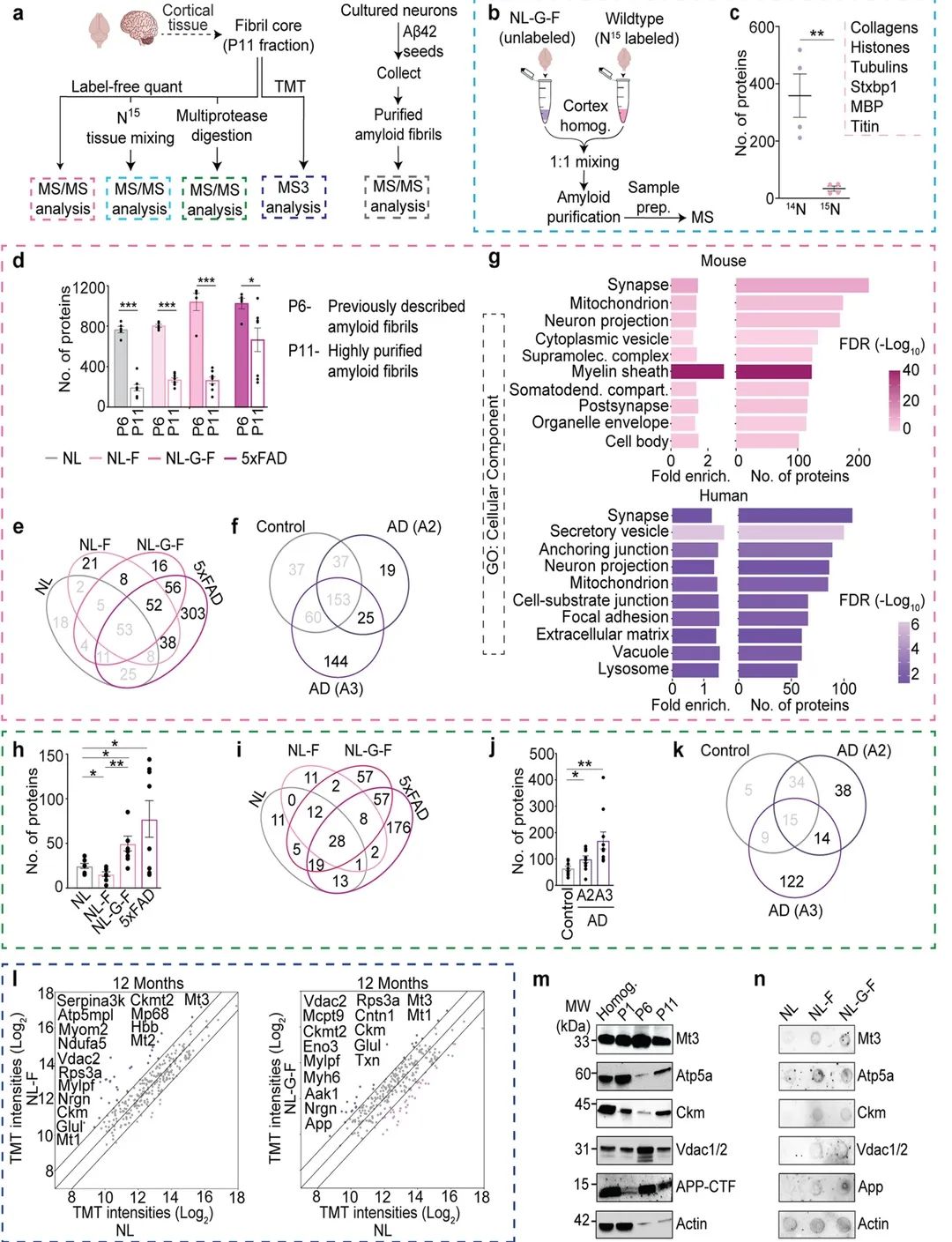
图4
为了鉴定与淀粉样纤维形成或稳定相关的蛋白质,作者使用基于MS的蛋白质组学分析 (图4a)。为了确保被MS鉴定的蛋白与原纤维相关,作者将AppNL−G−F/NL−G−F脑匀浆与用15N Spirulina chow代谢标记的WT脑匀浆混合(图4b)。MS分析显示90%以上被鉴定的蛋白为14N标记(图4c)。作者证实改进的纯化策略显著减少了非特异性共纯化蛋白的数量,并提高了蛋白纯度(图4d)。通过韦恩图,作者勾画了与淀粉样蛋白病理形式相关的蛋白质 (图4e)。在从人脑组织分离的纤维中,淀粉样蛋白评分为3的原纤维样本中鉴定出的蛋白数量最多,其次是评分为2的脑组织样本(图4f)。GO富集分析显示,许多原纤维相关蛋白与突触、神经元投射、髓鞘、超分子复合物和细胞外基质相关(图4g)。与AppNL/NL相比,作者在AppNL−F/NL−F、AppNL−G−F/NL−G−F和5xFAD纤维中发现了更多的蛋白(图4h-i)。人类样本中,淀粉样蛋白评分为3的AD大脑中鉴定出最多的蛋白质 (图4j-k)。与从12月龄小鼠分离的AppNL/NL原纤维相比,在AppNL−F/NL−F和AppNL−G−F/NL−G−F中,Mt1、Mt3、Ckm和Vdac2的水平至少高出2倍(图4l)。接下来,作者证实这些蛋白质中的大多数在P11部分中大量存在(图4m-n)。综上所述,作者的多尺度蛋白质组学分析提供了与淀粉样原纤维物理相关的蛋白质的一个短排序列表。
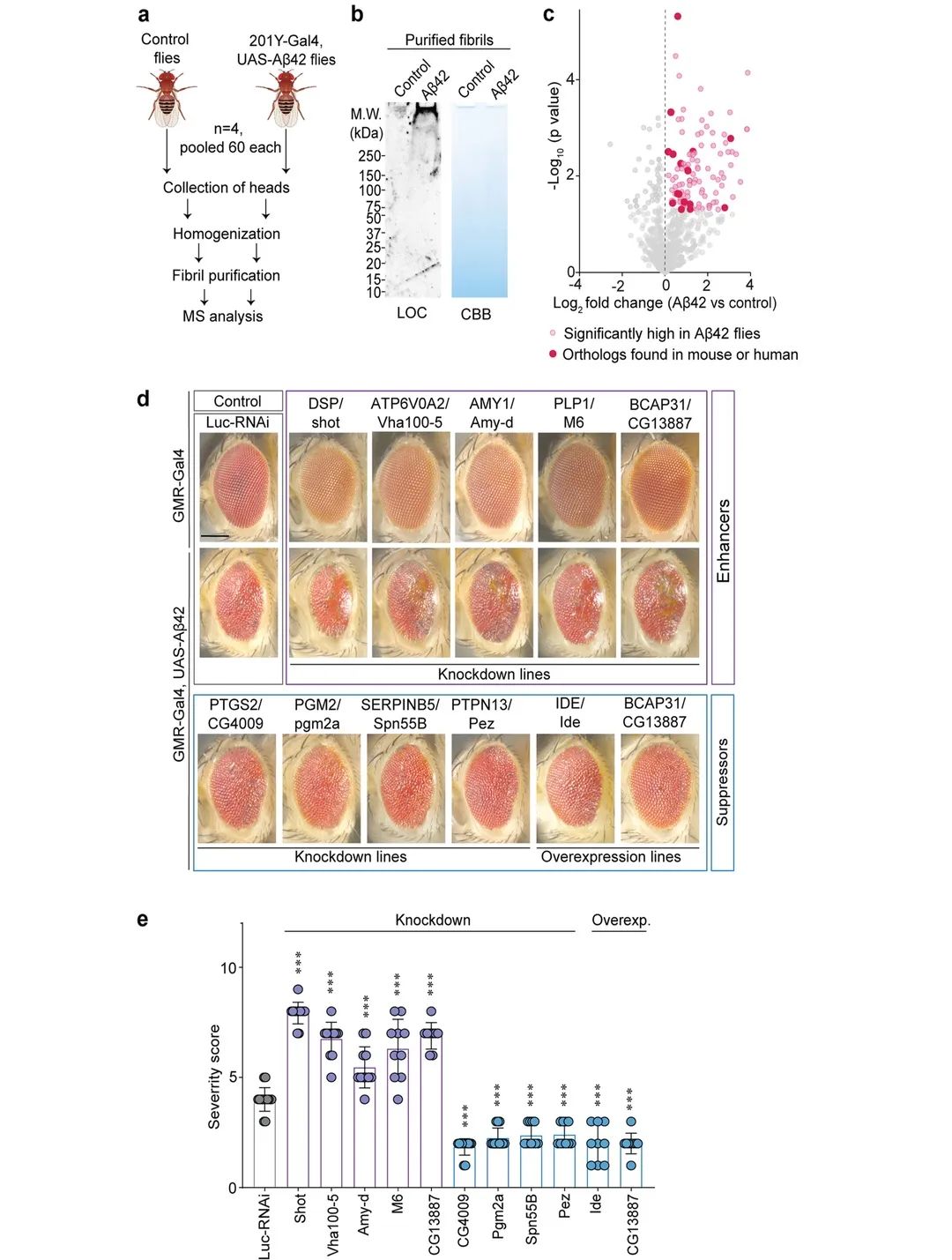
图5
作者使用他们新构建的方法纯化果蝇头部的原纤维(图5a)。使用LOC抗体进行的WB分析证实,在表达Aβ42的果蝇头部中存在高分子量淀粉样纤维(图5b)。对分离的纤维进行的基于MS的蛋白质组学分析显示,169个蛋白质的表达水平显著高于野生型对照(图5c)。此外,在果蝇淀粉样原纤维中发现的110种蛋白质与哺乳动物(25种人类和85种小鼠)原纤维相关蛋白是同源的。为了确定与小鼠淀粉样蛋白原纤维中编码蛋白的基因同源的果蝇基因的表达是否可以改变Aβ42在果蝇眼中诱导的毒性,作者利用了眼部特异性GMR-Gal4驱动基因表达诱导的稳健Aβ42眼部表型果蝇。结果显示7个RNAi细胞株抑制Aβ42的毒性,9个RNAi细胞株增强Aβ42的毒性(图5d-e)。
 技术咨询:
技术咨询: