免疫肿瘤微环境是由癌细胞、免疫细胞、成纤维细胞、内皮细胞和其他基质成分之间的交互作用而形成。虽然免疫肿瘤微环境是肿瘤免疫治疗靶点的来源,但免疫肿瘤微环境同时也可以促进或者抑制肿瘤免疫治疗的效果。在这篇推文中,我们介绍了乳腺癌中免疫肿瘤微环境的各种组成部分、靶向或影响免疫肿瘤微环境的治疗方法,以及宿主生理的复杂性。
关键词:免疫肿瘤微环境,乳腺癌,靶向治疗,肿瘤相关巨噬细胞
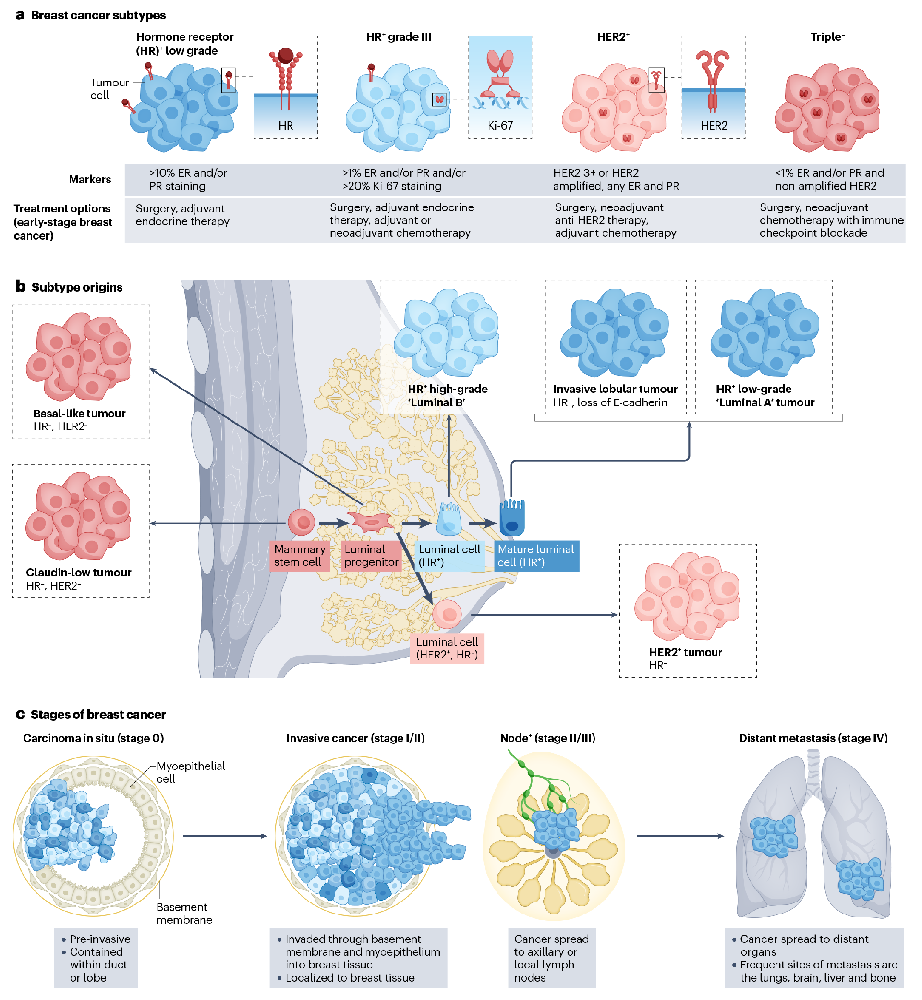
乳腺癌治疗方式和预后取决于其亚型
乳腺癌的治疗主要分为三个大方向:细胞毒性化疗、激素治疗和肿瘤细胞特异性靶向治疗。在临床上,乳腺癌的治疗和预后取决于其亚型,不同的亚型由人表皮受体2(HER2)和激素受体表达和疾病分期确定。虽然乳腺癌的存活率一直在提高,但晚期三阴性乳腺癌(TNBC)患者的存活率特别差,中位生存期不到24个月。但新的治疗方法,如免疫检查点阻断,明确针对肿瘤微环境而不是肿瘤细胞本身,提供了一种新的靶向治疗方法。
图1 乳腺癌亚型、起源和分期(见上图)
乳腺癌免疫肿瘤微环境的组成
2.1、肿瘤浸润性T细胞
不同乳腺癌亚型的T细胞数量不同,其中TNBC的浸润性T细胞数量最多。CD8+与CD4+ T细胞的比值随着肿瘤浸润性淋巴细胞密度的增加而增加,表明在具有高肿瘤浸润性淋巴细胞密度的样本中,较高数量的效应T细胞介导了临床症状的改善。除T细胞外,肿瘤浸润性B淋巴细胞也是TNBC和HER2阳性乳腺癌的预后标志物,并且在TNBC的免疫微环境中占比达到11%。虽然其特征不如T细胞那么明确,但在未经治疗的TNBC和HER2阳性肿瘤中具有不同的浆细胞群。尽管在所有亚型的乳腺癌免疫肿瘤微环境中,自然杀伤细胞(NKs)占比较小,但在TNBC中已发现一种细胞毒性潜能低于终末分化NKs的未成熟自然NKs亚群,并且它们的存在与较差的生存期相关,可能是促进肿瘤生长。肿瘤相关巨噬细胞(TAMs)在未经治疗的TNBC免疫肿瘤微环境中在所有免疫细胞中的占比超过25%。在健康的乳腺中,至少有基质淋巴管内皮透明质酸受体1 阳性(LYVE-1+)巨噬细胞和一种乳腺上皮中观察到的独特导管巨噬细胞群两种常驻巨噬细胞。TAMs可以同时表达M1和M2基因标签,表明单个TAMs有能力执行免疫刺激和抑制功能。尽管表明TAMs高丰度的基因标签与较差的生存相关,但表达叶酸受体2、CD206和LYVE-1等乳腺组织驻留巨噬细胞标志物的巨噬细胞与初治luminal型乳腺癌患者的预后改善相关。树突状细胞(DCs)在免疫肿瘤微环境中的占比少于TAMs,但特定亚群对抗肿瘤免疫具有重要影响。研究表明表达CD103的DCs丰富度与临床预后的改善呈正相关,尤其是在乳腺癌中。肥大细胞(Mast cells)在乳腺癌中的作用越来越明显,特别是HER2阳性的患者。研究表明肥大细胞可能在抑制T细胞功能或促进免疫抑制TAMs活性方面发挥作用,但仅在肥大细胞与较差预后相关的亚型中发挥作用。因此,肥大细胞可能促进或抑制肿瘤进展,这种作用取决于肿瘤类型。 癌症相关成纤维细胞(CAFs)肿瘤间质的重要组成部分,这些间充质细胞通过促进基质重塑、促进血管生成、支持癌细胞增殖、迁移和侵袭,对免疫肿瘤微环境产生重要影响。CAFs在乳腺癌中具有4个亚群,富含CAF-S4的肿瘤有更多的CD8+ T细胞和更少的调节性T(Treg)细胞,而CAF-S1密度与CD45+细胞和TAMs增加、T细胞减少有关。
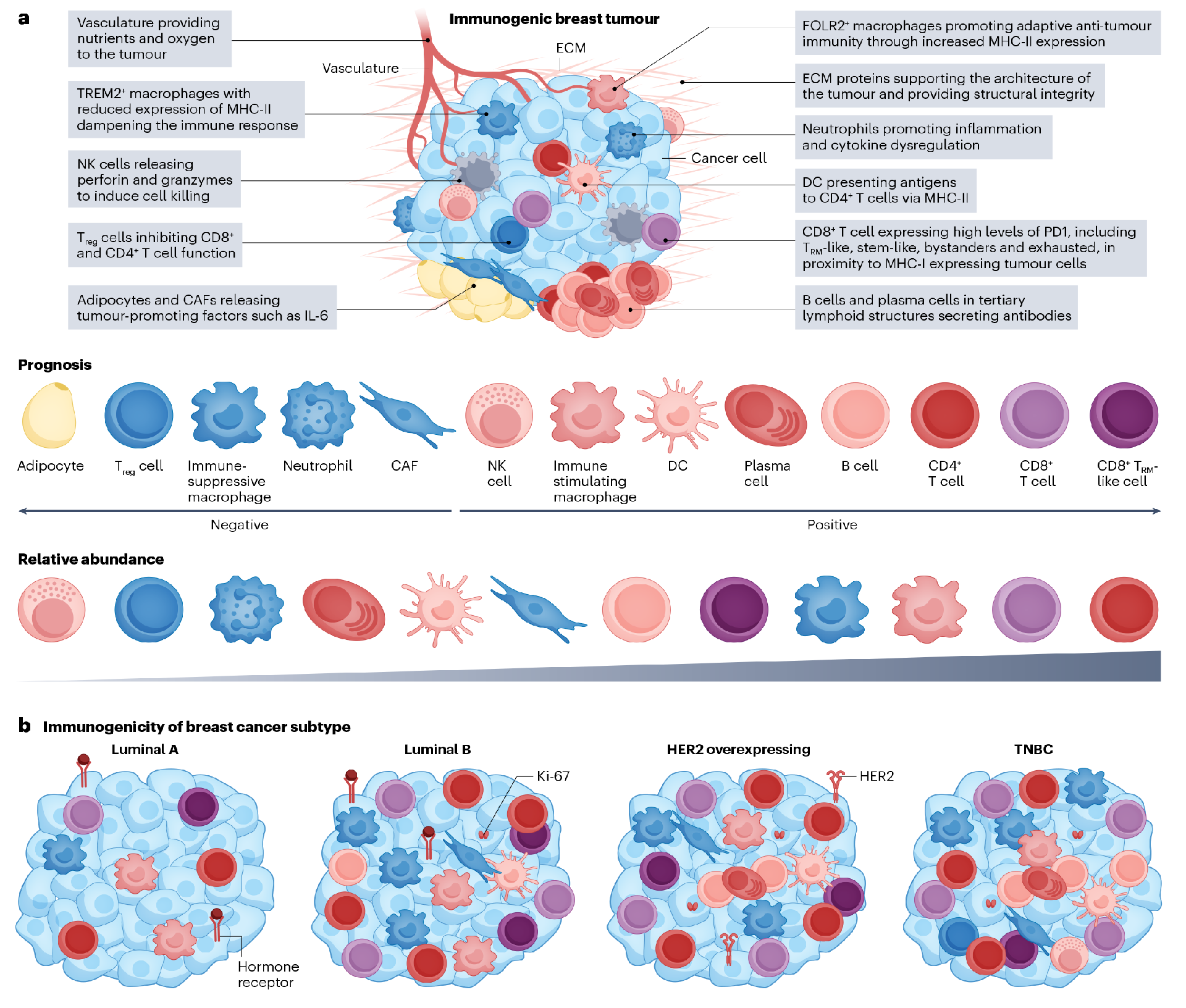
图2 免疫原性乳腺癌的肿瘤微环境及乳腺癌亚型
乳腺癌癌前病变和转移灶的免疫肿瘤微环境
免疫肿瘤微环境的异质性不仅存在于肿瘤之间,而且存在于病变本身,随着癌前组织向浸润性癌的进展而变化,并且在原发部位和转移部位之间也存在差异。正常组织向导管原位癌(DCIS)和随后的浸润性癌的进展以免疫肿瘤微环境的巨大变化为特征。DCIS间质组织主要由正常静息肌成纤维细胞和CAFs组成,但浸润性癌中免疫抑制性CAFs的比例显著增加。
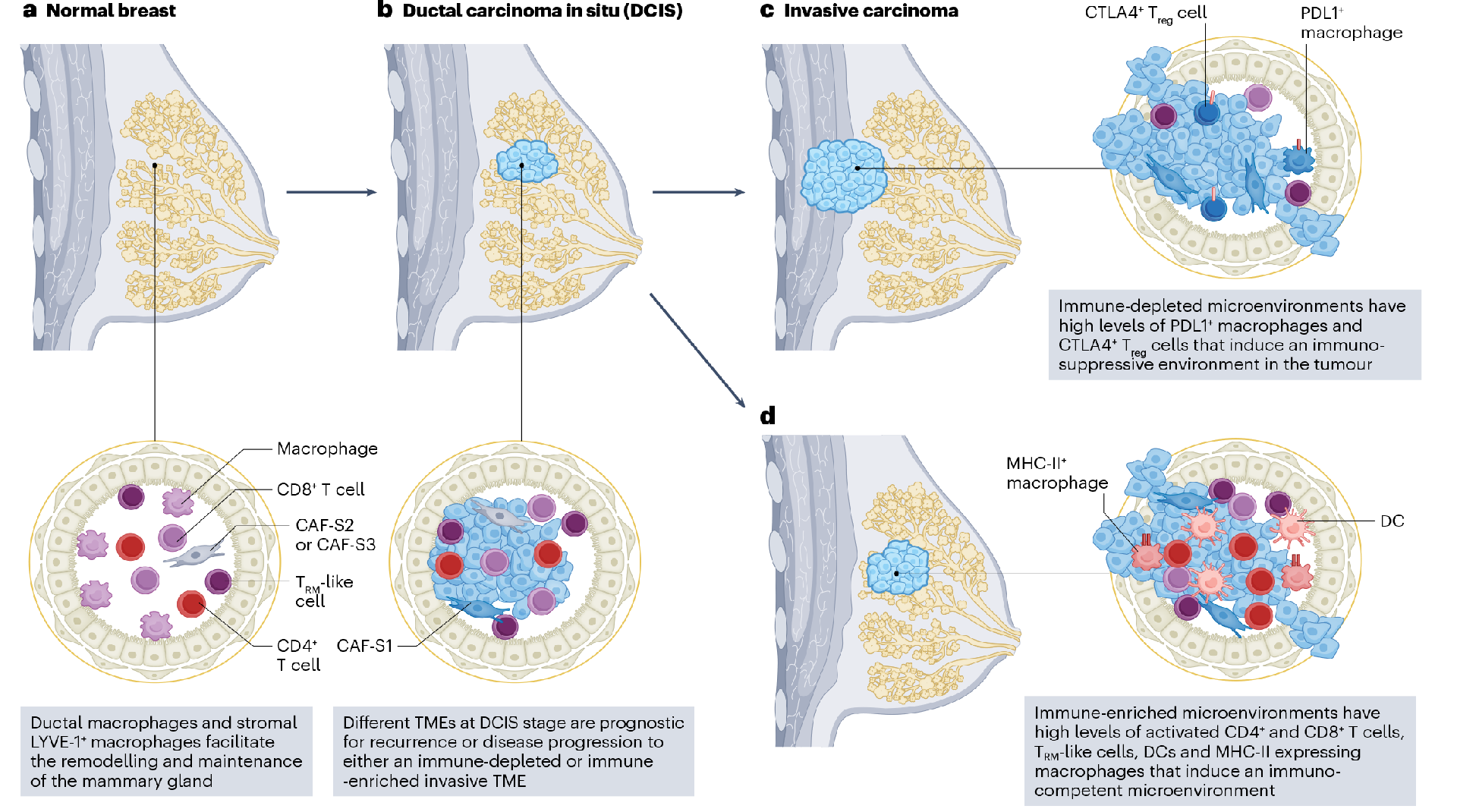
图3 乳腺癌肿瘤微环境从癌前病变到浸润癌的演变
影响乳腺癌免疫肿瘤微环境的宿主因素
4.1、激素信号对免疫肿瘤微环境的影响
尽管卵巢分泌的雌激素随着年龄的增长而下降,芳香化酶在绝经女性乳腺组织中的表达是增加的,这会导致免疫肿瘤微环境中局部雌激素增加。雌激素信号可通过增加FOXP3+细胞中FOXP3和PD1的表达来促进Treg细胞的免疫抑制。此外,雌激素信号的增加可导致髓源性抑制细胞(MDSCs)的浸润增加,MDSCs能够通过增强STAT3信号来抑制T细胞功能。免疫系统的老化与全身性炎症的增加和免疫衰老导致的T细胞功能障碍相关。随着年龄的增加,免疫肿瘤微环境中肿瘤浸润性淋巴细胞的密度减小。在腔内乳腺癌中,随着年龄的增长,CD8+肿瘤浸润性淋巴细胞的比例显著降低,CD4+ T细胞和Treg细胞丰富度保持不变。随着年龄的增加,免疫相关基因的表达相对减少,M2巨噬细胞的比例确增加,这可以解释为什么50岁以下乳腺癌患者的辅助化疗效果要优于50岁以上的患者。4.3、乳腺癌易感基因(BRCA)生殖细胞系突变对免疫肿瘤微环境的影响 越来越多的证据表明,BRCA1或BRCA2的生殖细胞系突变也可能独立于增加肿瘤突变负担之外影响免疫肿瘤微环境。研究表明小鼠T细胞中BRCA1纯合缺失可阻止其发育,T细胞发育后的BRCA1缺失导致更多的CD8+ T细胞耗竭,细胞增殖和细胞因子产生受损。同样,小鼠BRCA2杂合子和纯合子缺陷导致循环T细胞数量减少和免疫功能障碍。来自BRCA1携带者的TNBC样本中的肿瘤浸润淋巴细胞也表现出更加衰竭的表型,并伴有免疫检查点蛋白表达的增加。提示生殖细胞系BRCA1突变不仅影响TNBC中肿瘤浸润淋巴细胞的数量,而且影响其表型。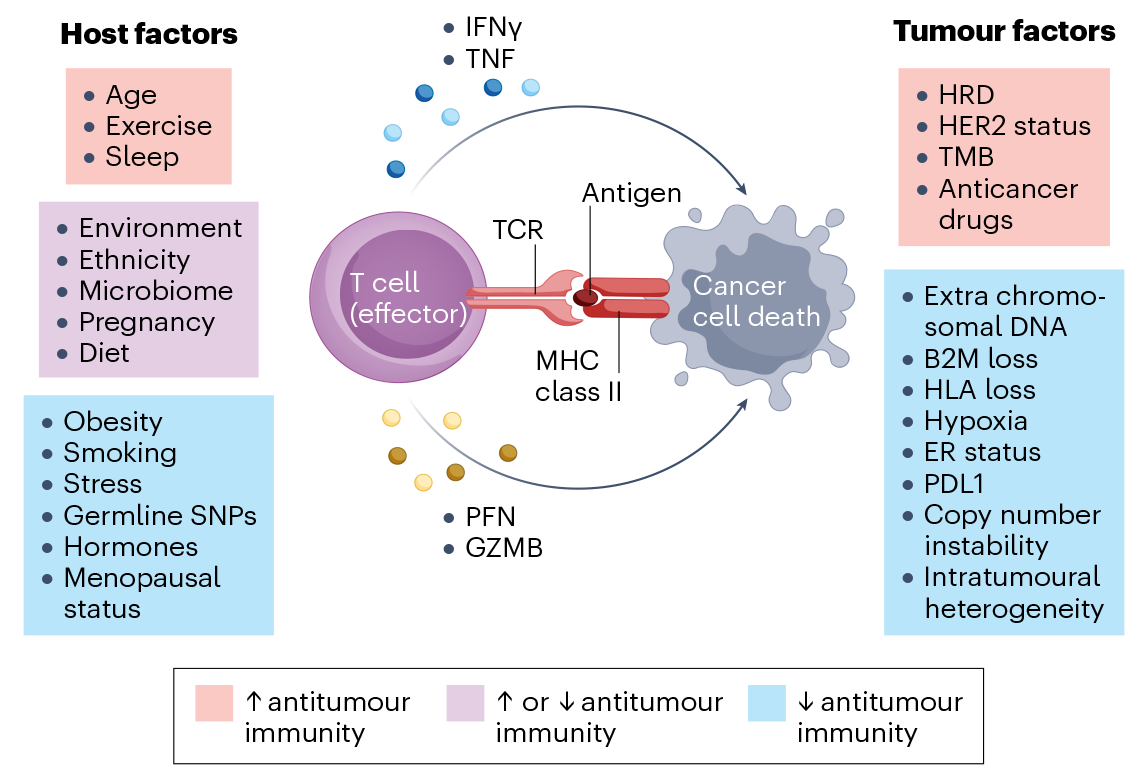 目前临床批准的乳腺癌免疫疗法仅针对PD1和PDL1轴。免疫富集性肿瘤患者(肿瘤浸润性淋巴细胞和免疫检查点高表达)对免疫检查点阻断的应答可能更高。高肿瘤浸润性淋巴细胞丰度的原发肿瘤通常与免疫检查点阻断靶基因PD1、CTLA4和LAG3表达增加的T细胞有关。虽然乳腺癌ICB的核心是靶向PD1或PDL1,但有证据表明双重抑制免疫检查点可能也是一种可行的治疗策略。在不可切除或转移性化生性乳腺癌患者中,使用纳武利尤单抗和伊匹单抗联合阻断PD1和CTLA4可使总生存率达到12个月,部分患者达到长期、持久缓解。 最著名的过继细胞疗法是嵌合抗原受体(CAR) T细胞过继疗法。但是与血液系统恶性肿瘤相比,实体肿瘤上的治疗效果甚微。缺乏效率的原因是多方面的,一个主要方面是免疫肿瘤微环境不允许CAR T细胞持续穿透和存活。最近的一项进展提出了对CAR T细胞进行表观遗传调控,从而产生一种更能常驻组织的类型。通过在体外生产过程中将CAR T细胞暴露于转化生长因子-β (TGF-β),这些细胞受到表观遗传调控,从而产生CAR TRM表型,这种表型即使在慢性抗原暴露的情况下也能维持。除CAR T细胞外,也有研究评估了肿瘤浸润性淋巴细胞过继转移的疗效,但是这种方法操作复杂,将会限制其运用。靶向血管生成对乳腺癌的治疗效果一般,但由于肿瘤血管的正常化可改善免疫肿瘤微环境中的免疫应答和治疗的疗效,因此将抗血管生成治疗与免疫治疗联合应用重新引起了人们的关注。如法米替尼(血管内皮生长因子受体2 [VEGFR2]、血小板源性生长因子受体[PDGFR]和KIT的小分子抑制剂)联合抗PD1抗体卡瑞利珠单抗和基于紫杉类药物的化疗治疗未经治的转移性TNBC。因为TAMs和肿瘤细胞负责免疫肿瘤微环境中大部分PDL1的表达,因此在考虑免疫治疗时,这些细胞是一个关键因素。在80%的乳腺肿瘤中,至少10%的髓系细胞为PDL1阳性,并且ER-肿瘤中PDL1+TAMs的出现频率高于ER+肿瘤。巨噬细胞在乳腺癌中的重要性在Trem2敲除小鼠中得到了体现,Trem2敲除小鼠的LAM样巨噬细胞和单核细胞的频率降低,与野生型小鼠相比,减弱了植入的TNBC细胞的生长。因此,考虑到TAMs在促进肿瘤方面的重要性,尤其是在因致癌性突变而发生乳腺肿瘤的小鼠模型中,靶向PDL1和PDL2以外的TAMs可能被证明是一种可行的治疗策略。肿瘤微环境对乳腺癌的发生、发展和治疗具有重要意义,这对癌症生物学认识提出了挑战。过去研究者一直过度关注作为自主实体的癌细胞,而忽视了肿瘤微环境。免疫肿瘤微环境是一个机会的海洋,可以增强现有疗法的效果,并设计治疗和预防乳腺癌的全新方法。因此,靶向免疫肿瘤微环境将成为未来10年乳腺癌治疗不可或缺的组成部分。[1] Harris MA, Savas P, Virassamy B, et al. Towards targeting the breast cancer immune microenvironment. Nat Rev Cancer. 2024;24(8):554-577.
目前临床批准的乳腺癌免疫疗法仅针对PD1和PDL1轴。免疫富集性肿瘤患者(肿瘤浸润性淋巴细胞和免疫检查点高表达)对免疫检查点阻断的应答可能更高。高肿瘤浸润性淋巴细胞丰度的原发肿瘤通常与免疫检查点阻断靶基因PD1、CTLA4和LAG3表达增加的T细胞有关。虽然乳腺癌ICB的核心是靶向PD1或PDL1,但有证据表明双重抑制免疫检查点可能也是一种可行的治疗策略。在不可切除或转移性化生性乳腺癌患者中,使用纳武利尤单抗和伊匹单抗联合阻断PD1和CTLA4可使总生存率达到12个月,部分患者达到长期、持久缓解。 最著名的过继细胞疗法是嵌合抗原受体(CAR) T细胞过继疗法。但是与血液系统恶性肿瘤相比,实体肿瘤上的治疗效果甚微。缺乏效率的原因是多方面的,一个主要方面是免疫肿瘤微环境不允许CAR T细胞持续穿透和存活。最近的一项进展提出了对CAR T细胞进行表观遗传调控,从而产生一种更能常驻组织的类型。通过在体外生产过程中将CAR T细胞暴露于转化生长因子-β (TGF-β),这些细胞受到表观遗传调控,从而产生CAR TRM表型,这种表型即使在慢性抗原暴露的情况下也能维持。除CAR T细胞外,也有研究评估了肿瘤浸润性淋巴细胞过继转移的疗效,但是这种方法操作复杂,将会限制其运用。靶向血管生成对乳腺癌的治疗效果一般,但由于肿瘤血管的正常化可改善免疫肿瘤微环境中的免疫应答和治疗的疗效,因此将抗血管生成治疗与免疫治疗联合应用重新引起了人们的关注。如法米替尼(血管内皮生长因子受体2 [VEGFR2]、血小板源性生长因子受体[PDGFR]和KIT的小分子抑制剂)联合抗PD1抗体卡瑞利珠单抗和基于紫杉类药物的化疗治疗未经治的转移性TNBC。因为TAMs和肿瘤细胞负责免疫肿瘤微环境中大部分PDL1的表达,因此在考虑免疫治疗时,这些细胞是一个关键因素。在80%的乳腺肿瘤中,至少10%的髓系细胞为PDL1阳性,并且ER-肿瘤中PDL1+TAMs的出现频率高于ER+肿瘤。巨噬细胞在乳腺癌中的重要性在Trem2敲除小鼠中得到了体现,Trem2敲除小鼠的LAM样巨噬细胞和单核细胞的频率降低,与野生型小鼠相比,减弱了植入的TNBC细胞的生长。因此,考虑到TAMs在促进肿瘤方面的重要性,尤其是在因致癌性突变而发生乳腺肿瘤的小鼠模型中,靶向PDL1和PDL2以外的TAMs可能被证明是一种可行的治疗策略。肿瘤微环境对乳腺癌的发生、发展和治疗具有重要意义,这对癌症生物学认识提出了挑战。过去研究者一直过度关注作为自主实体的癌细胞,而忽视了肿瘤微环境。免疫肿瘤微环境是一个机会的海洋,可以增强现有疗法的效果,并设计治疗和预防乳腺癌的全新方法。因此,靶向免疫肿瘤微环境将成为未来10年乳腺癌治疗不可或缺的组成部分。[1] Harris MA, Savas P, Virassamy B, et al. Towards targeting the breast cancer immune microenvironment. Nat Rev Cancer. 2024;24(8):554-577.
doi:10.1038/s41568-024-00714-6.[2] Siegel RL, Giaquinto AN, Jemal A. Cancer statistics, 2024. CA Cancer J Clin. 2024;74(1):12-49.doi:10.3322/caac.21820.[3] Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74(3):229-263.doi:10.3322/caac.21834.[4] So JY, Ohm J, Lipkowitz S, Yang L. Triple negative breast cancer (TNBC): Non-genetic tumor heterogeneity and immune microenvironment: Emerging treatment options. Pharmacol Ther. 2022;237:108253.doi:10.1016/j.pharmthera.2022.108253.




 技术咨询:
技术咨询: