联合分析专题(十二)单细胞和空间转录组分析揭示结直肠癌肝转移的细胞异质性
2023-12-18
单细胞转录组学+空间转录组学联合分析
单细胞转录组测序( Single -cell RNA -sequencing)是指在单个细胞水平上对 RNA 进行高通量测序和分析的新技术。不同于常规组织或细胞群测序得到的结果(只是大量细胞平均表达水平),单细胞测序能够深入挖掘细胞异质性的信息。目前,单细胞测序已广泛应用于肿瘤异质性、免疫微环境、神经科异质性、免疫微环境神经科 、胚胎发育细胞分化等领域的研究。同种细胞会由于所处的生理状态出现差异表达,常规的bulk RNA(bulk就是我们测的是所有细胞的总RNA(mRNA)取平均值代表每个基因的表达量。)并不能捕获这种差异表达,而这种差异又代表着表型背后的机理。为了捕获这种差异,单细胞测序技术应运而生。空间转录组是一种用于从空间层面上解析RNA-seq数据的技术,从而解析单个组织切片中的所有mRNA。
空间转录组技术是结合成像、生物标记、测序及生物信息学等工具对组织切片的基因表达进行空间定位的一项技术,可揭示各细胞类型在组织中的空间分布、各细胞群体间的相互作用以及绘制不同组织区域的基因表达图谱,对于理解疾病和癌症的发生机制具有深远的应用价值。
推荐文章:Single-cell and spatial transcriptome analysis reveals the cellular heterogeneity of liver metastatic colorectal cancer. DOI:10.1126/sciadv.adf5464,Journal:Science Advances. Year: 2023.
联合分析思路
结果展示1:CRC原发肿瘤和CRC衍生肝转移瘤的全单细胞转录组图谱
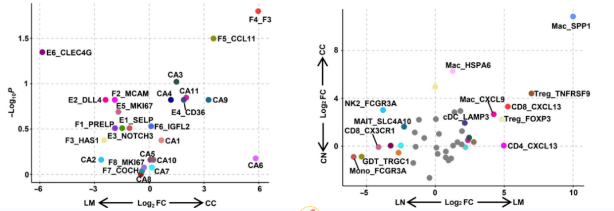
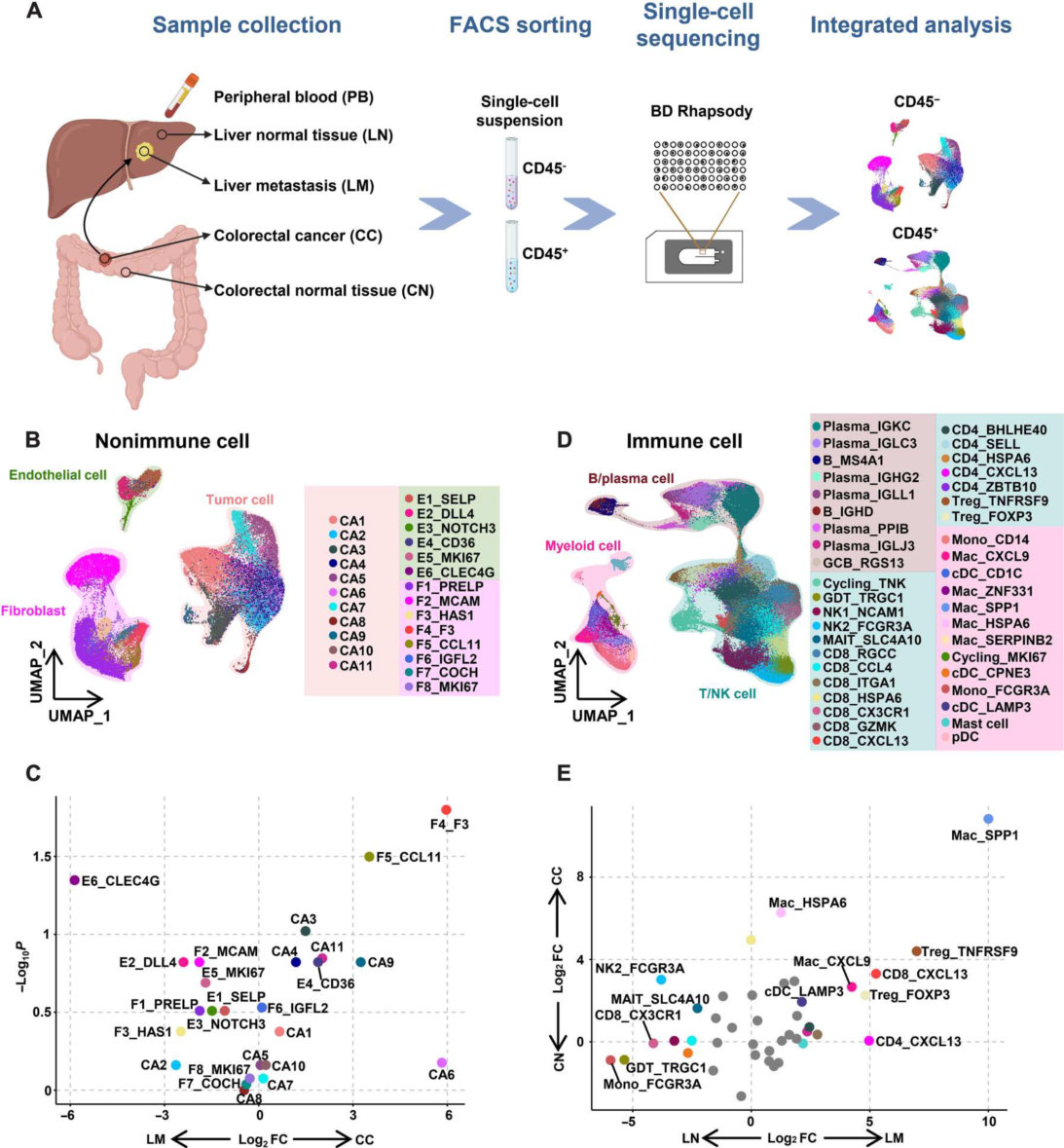
为了阐明CRC原发肿瘤和CRC源性肝转移肿瘤的细胞异质性,作者从6例CRC患者的原发结直肠癌(CC)、癌旁正常结直肠黏膜(CN)、肝转移(LM)、癌旁正常肝组织(LN)和外周血(PB)中收集了CD45−非免疫细胞和CD45+免疫细胞用于单细胞转录组分析(图1A)。在主要的非免疫细胞群中,鉴定产生了11个肿瘤细胞簇、8个成纤维细胞簇和6个内皮细胞簇(图1B)。根据已知标志物的表达,将免疫细胞分为41个群体(图1D)。
(A)实验设计示意图及分析工作流程。
(B)非免疫细胞簇的UMAP可视化。
(C)火山图比较CC与LM的非免疫细胞簇的细胞类型相对丰度(n = 5例患者)。根据Mann-Whitney U检验,x轴表示log2倍变化,y轴表示- log10倍P值。每个点代表一个细胞类型。
(D)免疫细胞簇的UMAP可视化。
(E)火山图比较肿瘤和副肿瘤中免疫细胞簇的细胞类型相对丰度(n = 6例患者)。根据Mann-Whitney U检验,x和y轴表示log2倍的变化。每个点代表一个细胞类型。
结果展示2:CRC原发肿瘤及CRC衍生肝转移瘤的空间分布谱
为了综合分析结直肠癌原发灶和肝转移灶的空间分布特征,作者收集了6例患者的6个组织标本,包括4例结直肠癌原发灶(C1 ~ C4)和2例肝转移灶(L1和L2)。通过苏木精-伊红(HE)染色和每个样本的基因表达特征确定肿瘤区域(T)和癌旁区域(PT)(图2A)。与癌旁组织相比,肿瘤组织富集了细胞周期相关通路,如G2-M检查点、E2F靶点和有丝分裂纺锤体(图2B)。根据基因表达谱将肿瘤组织和癌旁组织划分为不同区域(图2A)。与C1、C3、C4的瘤旁组织相比,肿瘤组织中的浆细胞比例降低(图2、C和D)。
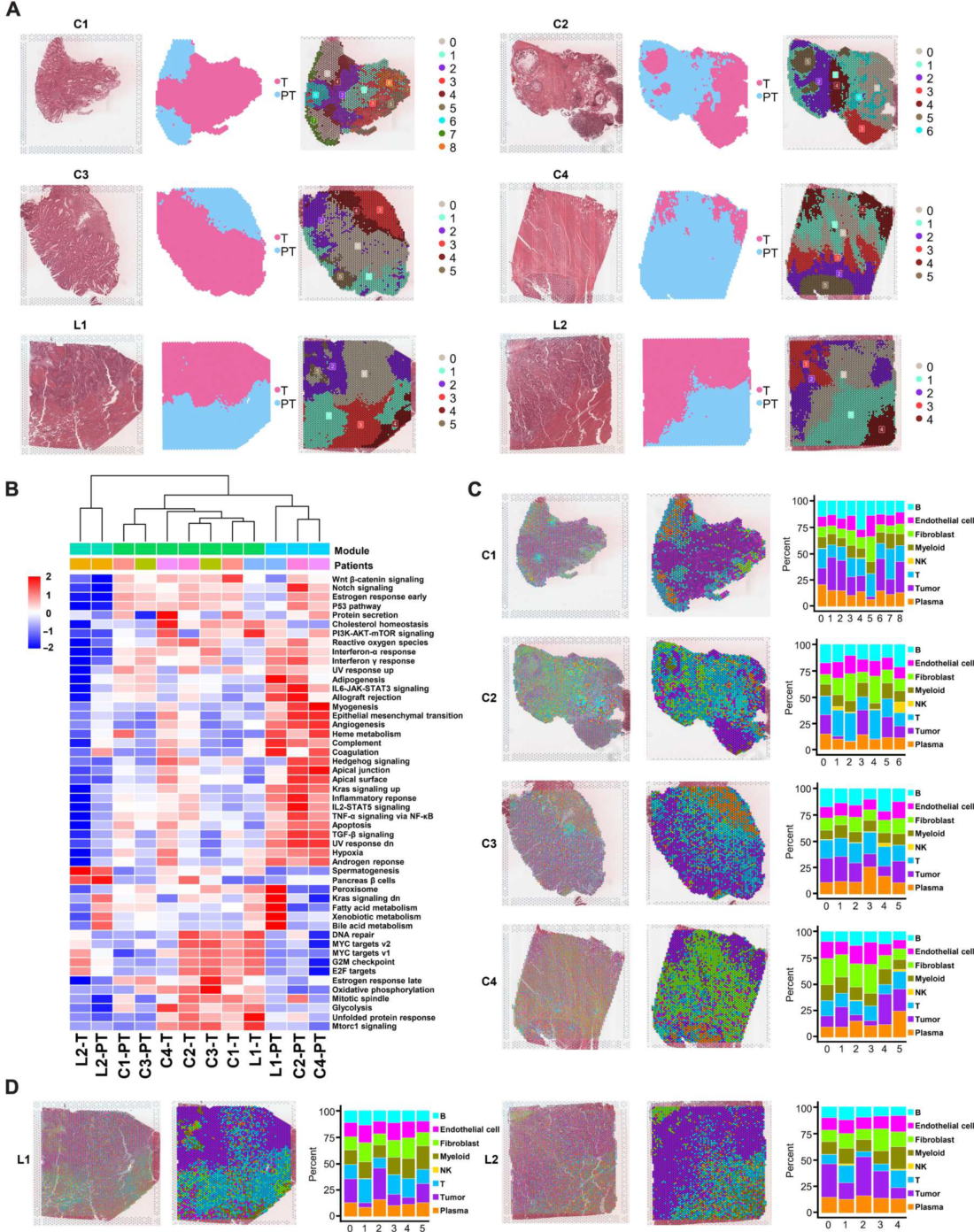
(A)空间转录组组织切片概述。空间转录组切片的H&E染色(左)。各切片的肿瘤组织和瘤旁组织识别(中)。各切片的空间聚类分布(右)。
(B)热图显示了肿瘤组织和癌旁组织在每个切片中的标志基因集的富集分数。
(C)结合单细胞RNA表达谱对原发性结直肠癌切片中细胞簇进行鉴定。左图:聚束反卷积结果,显示每个点的细胞团比例。中间:每个点的集群定义,被确定为那里最占优势的细胞集群。右:不同区域内已识别的细胞团的比例,表示每个区域内所有点上细胞团的平均比例。
(D)结合单细胞RNA表达谱对肝转移切片进行聚类鉴定。
结果展示3:肿瘤微环境( TME )重塑骨髓细胞的组成
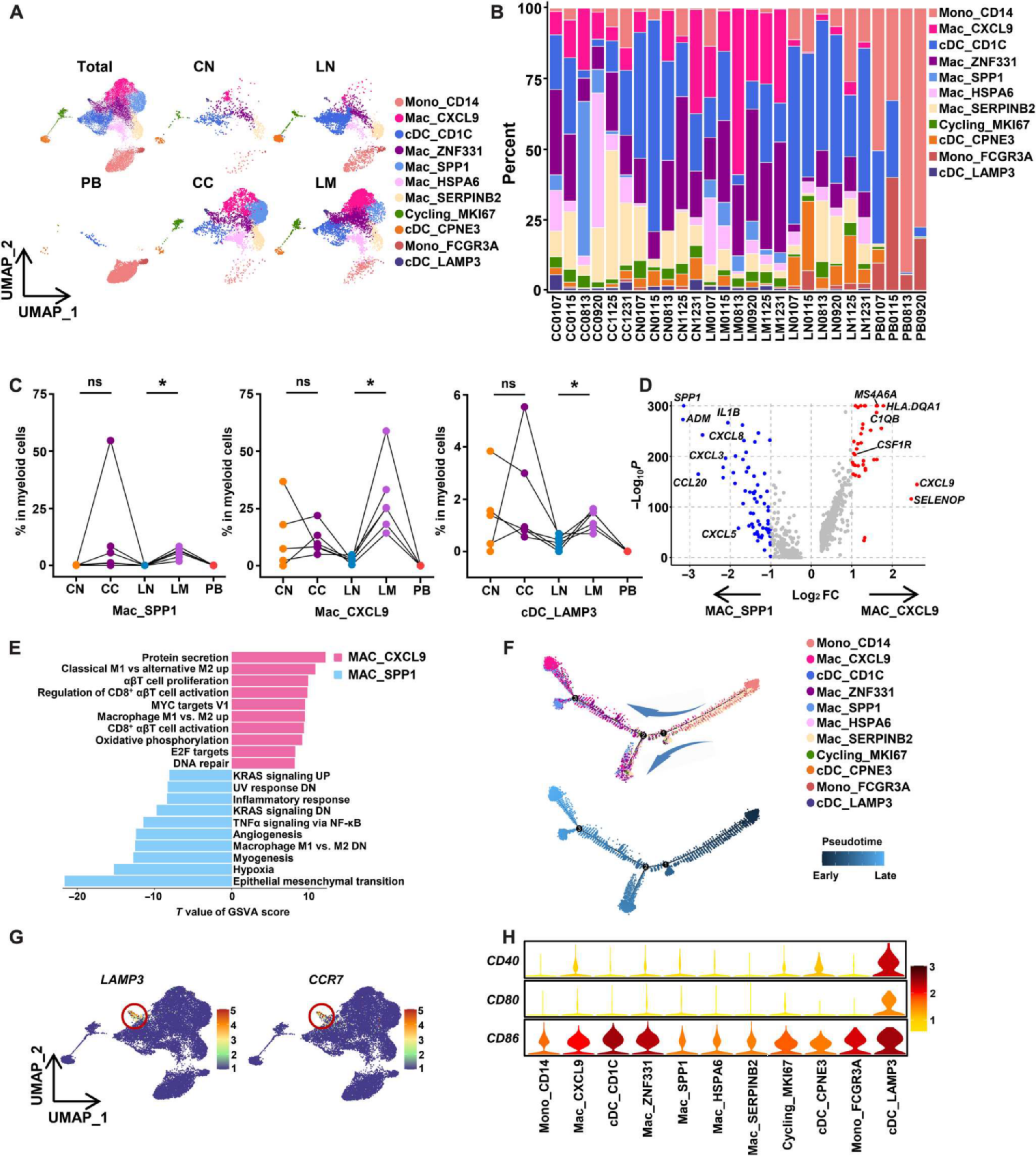
(A)髓系细胞簇的UMAP可视化。
(B) CN、CC、LN、LM和PB中髓系细胞群的比例。
(C)髓系细胞中MAC_SPP1、MAC_CXCL9和cDC_LAMP3亚群的比例。采用配对非参数检验确定P值。
(D)显示MAC_CXCL9和MAC_SPP1亚群之间差异表达基因的火山图。
(E) GSVA分析显示MAC_CXCL9和MAC_SPP1子集富集的通路。
(F)显示髓系细胞发育轨迹的单片分析。
(G) LAMP3和CCR7在髓系细胞中的表达特征图。
(H)显示髓系细胞CD40、CD80和CD86表达的小提琴图。
结果展示4: CXCL13+ T细胞在肝转移瘤中富集
在T细胞中,确定了7簇CD8+ T细胞,5簇传统的CD4+ T (cCD4)细胞, 2簇Tregs细胞。CD8+ T细胞和CD4+ T细胞均有一个表达CXCL13的细胞簇,CXCL13是CXCR5的趋化因子(图4A和B)。 LM组CD8_CXCL13细胞比例明显高于LN组;然而,这种亚型在CN、LN和PB中很少检测到(图4C和D)。在 CC中, CD4_CXCL13百分率表达减少,但与LN相比,LM组CD4_CXCL13百分率表达增加(图4E)。 GSVA分析显示CD8_CXCL13亚群富集T细胞增殖通路,CD4_CXCL13亚群富集G2-M检查点通路,显示了这两个亚群的增殖特性(图4F和G)。 CN和LN不同CD8+ T细胞亚群的增殖特性几乎相同(图4H)。
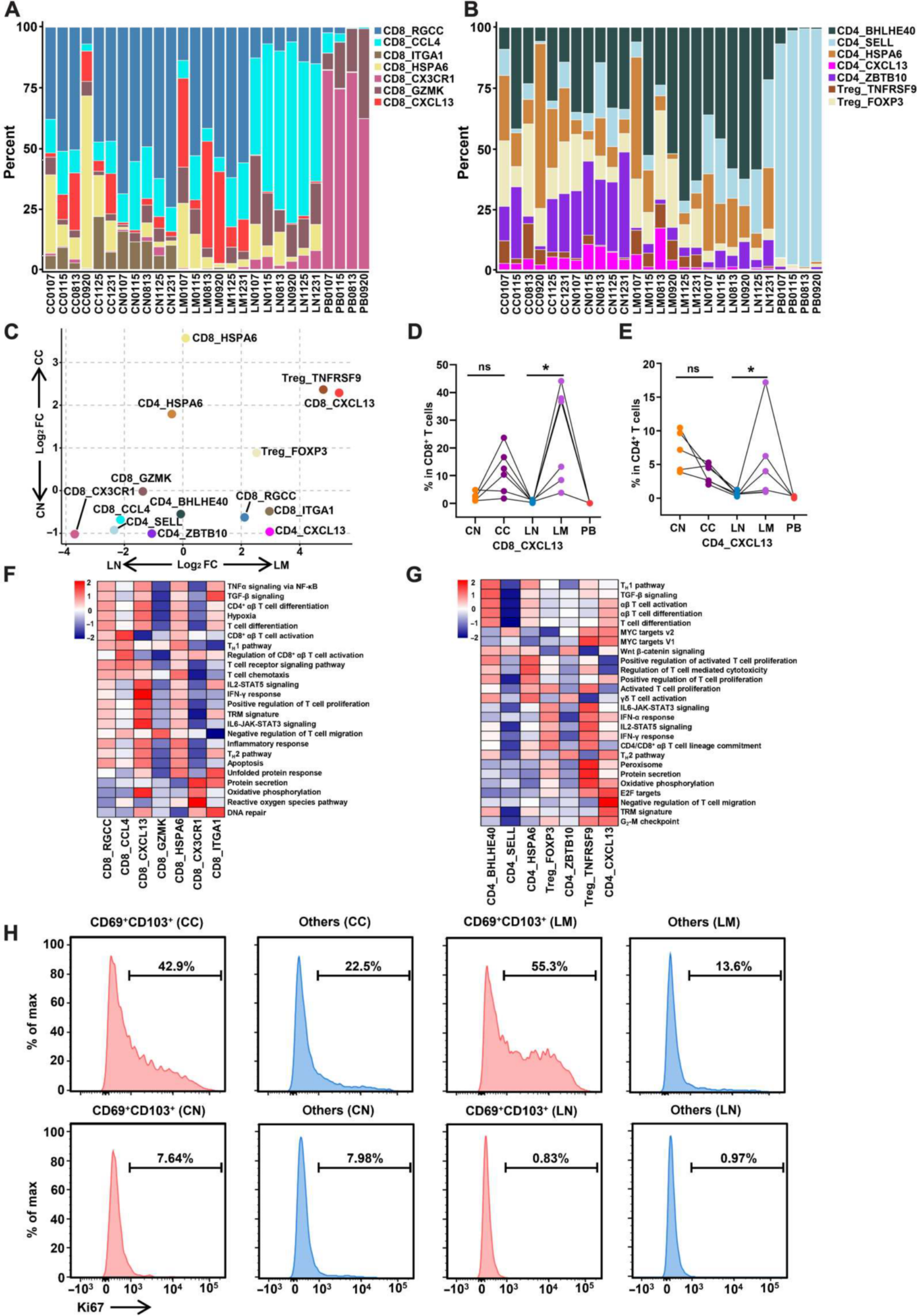
(A) CN、CC、LN、LM和PB中CD8+ T细胞群的比例。(B) CN、CC、LN、LM和PB中CD4+ T细胞群的比例。
(C)比较肿瘤与癌旁T细胞群细胞类型相对丰度的火山图(n = 6例)。根据Mann-Whitney U检验,X、y轴分别表示log2倍变化。每个点代表一种细胞类型。
(D) CD8_CXCL13亚群在CD8+ T细胞中的比例。
(E) CD4+ T细胞中CD4_CXCL13亚群的比例。
(F) CD8+ T细胞簇的GSVA通路分析。
(G) CD4+ T细胞簇的GSVA通路分析。
(H)流式细胞术检测CN、CC、LN、LM不同细胞亚群Ki67表达水平。
结果展示5:CXCL13+ T细胞与结直肠癌患者的良好预后相关
在上述结果中,与CD4_CXCL13亚群相比,CD8_CXCL13在CC和LM中富集(图4、D和E),表明CD8_CXCL13细胞可能是一个肿瘤激活亚群。与其他亚组相比,作者在CD8_CXCL13亚组中观察到高水平的枯竭标志物,如PDCD1、HAVCR2、LAG3、CTLA4和TIGIT(图5A和B)。既往研究表明,肿瘤反应性T细胞在持续的肿瘤抗原刺激下表现出耗竭表型,耗竭表型表明其具有肿瘤反应性。轨迹分析显示CD8_CXCL13细胞为终末分化(图5C)。CD8_CXCL13亚群也表达高水平的效应分子,如GZMB(图5,A和B),这表明该亚群可能保留部分抗肿瘤功能。由于CXCL13在组织中难以检测到,作者尝试使用CD69和CD103来标记CXCL13+细胞,IHC结果显示,在肿瘤组织中,CD69+CD103+CD8+ T细胞比其他CD8+ T细胞更靠近CK19+肿瘤细胞(图5D和E),有利于其杀伤肿瘤的功能。为了探索CXCL13+ T细胞在CRC中的预后价值,作者将基因表达综合(Gene Expression Omnibus, GEO)队列中的CRC患者分为CXCL13high和CXCL13low组,发现CC中CXCL13的高表达预示着较好的总生存期(图5H)。综上所述,在TME中富集的CXCL13+ T细胞是一个肿瘤反应性的亚群,有助于改善CRC患者的预后。
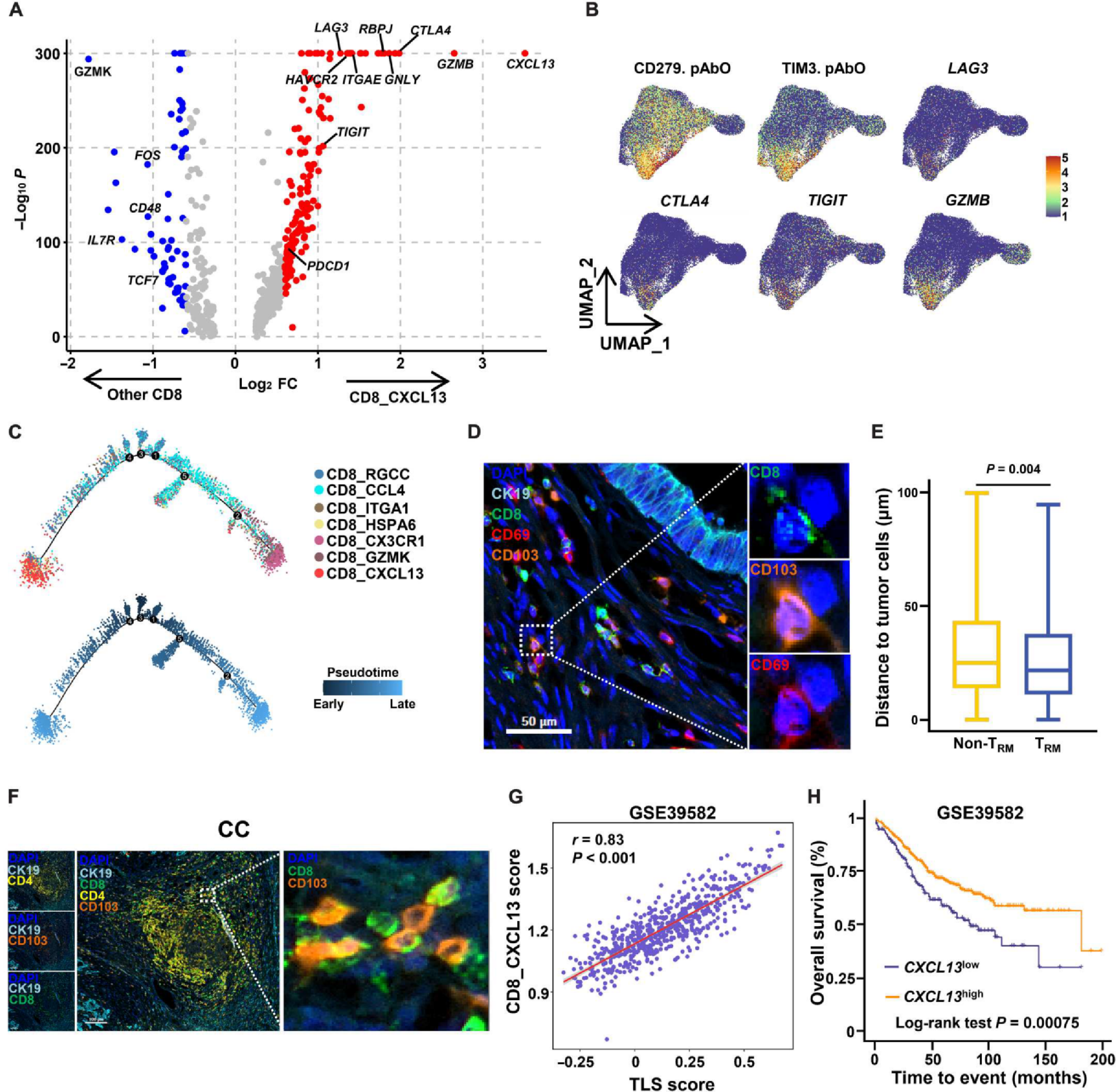
(A)显示CD8_CXCL13与其他CD8+ T细胞差异表达基因的火山图。
(B)显示CD8+ T细胞中检查点和效应分子的特征图。
(C)单片分析显示CD8+ T细胞的发育轨迹。
(D)一个代表性的CRC肿瘤中CD69+CD103+CD8+ T细胞的多色免疫组化染色。
(E) CD69+CD103+CD8+ T细胞和其他CD8+ T细胞与癌细胞的距离。
(F) CRC三级淋巴结构中CD103+CD8+ T细胞的多色免疫组化染色。
(G) GSE39582数据集中三级淋巴结构评分与CD8_CXCL13浸润评分的关系。
(H) GSE39582数据集cxcl13高、低表达患者的总生存期。
结果展示6:结直肠癌的原发灶和肝转移灶中存在不同的成纤维细胞亚群
在结直肠癌的TME中,作者发现了8个具有不同基因表达模式的成纤维细胞簇,分别为F1_PRELP、F2_MCAM、F3_HAS1、F4_F3、F5_CCL11、F6_IGFL2、F7_COCH和F8_MKI67(图6A)。F4_F3和F5_CCL11簇主要包含来自CC的细胞(图6B)。根据批量rna测序数据,F4_F3在CC中的浸润较CN中增加。然而,CC中F5_CCL11簇的百分比下降,根据轨迹分析可能会转变为F4_F3簇(图6C)。轨迹分析也预测F2_MCAM和F4_F3是两个不同的终末分化簇(图6C)。IHC分析证实F2_MCAM存在于CC和LM中(图6D)。与单细胞分析一致,F4_F3亚群仅存在于CC中,而不存在于LM中,这种现象可能是由于LN中F4_F3缺失而CN中F4_F3存在所致(图6E和F)。ST分析也证实了F4_F3亚群在CC中的浸润比在LM中的更多(图6,G和H)。F4_F3亚群紧密地围绕在CN和CC的上皮细胞周围,促进其与上皮细胞的相互作用(图6I)。此外,F4_F3在CC中的浸润增加可能导致更差的预后(图6J)。综上所述,在结直肠癌的原发肿瘤和肝转移肿瘤中,作者观察到不同的表型特征和高度可变的成纤维细胞频率,这表明在不同的癌症环境中TME内的细胞异质性。
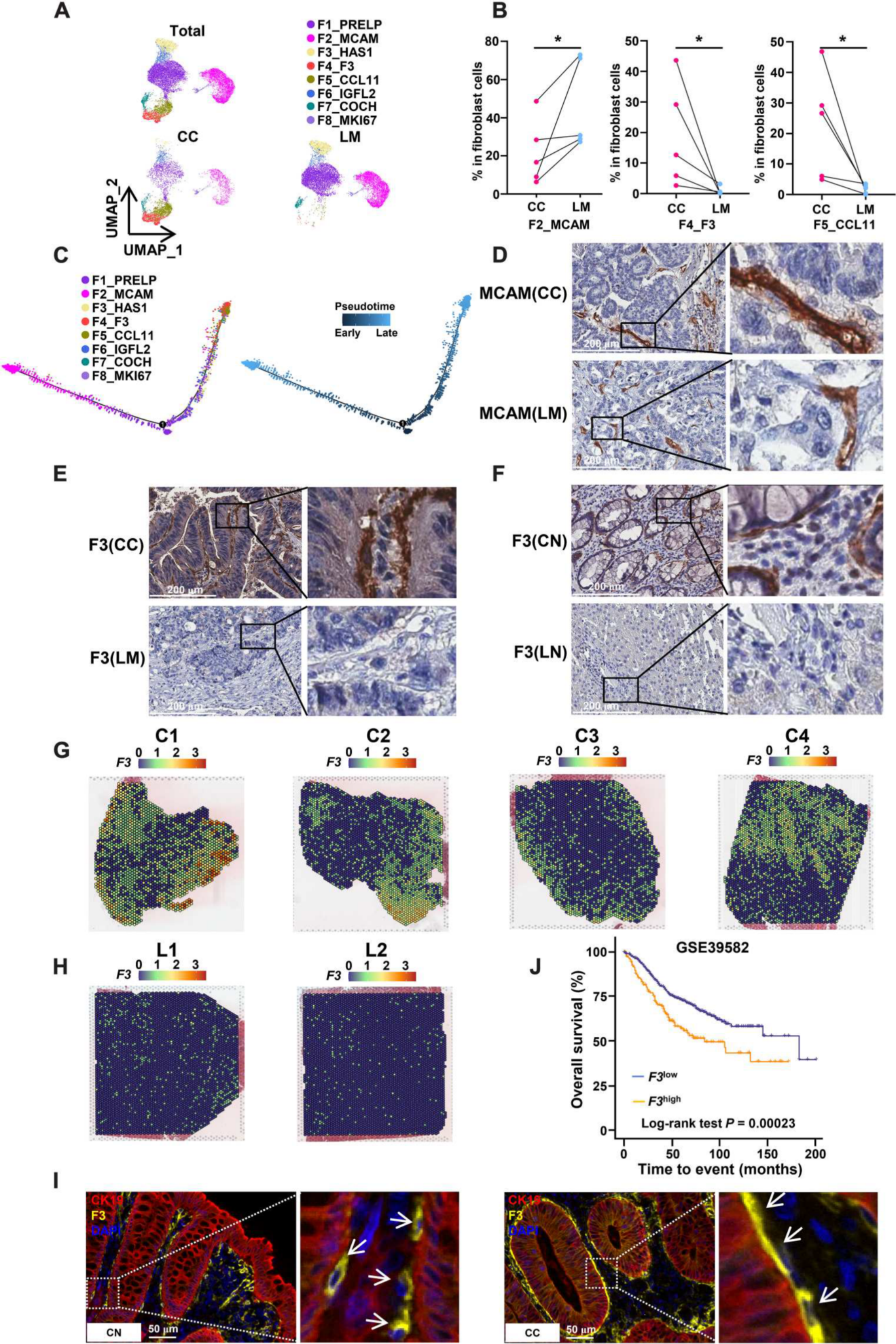
(A)成纤维细胞簇的UMAP可视化。
(B) CC和LM中F2_MCAM、F4_F3和F5_CCL11簇的比例(P值通过配对非参数检验确定)。
(C)显示成纤维细胞发育轨迹的单片分析。
(D) CC和LM中F2_MCAM的免疫组织化学染色。
(E) CC和LM中F4_F3的免疫组织化学染色。
(F) CN和LN中F4_F3的免疫组织化学染色。
(G) F4_F3成纤维细胞在CC (C1到C4)中的分布。
(H) F4_F3成纤维细胞在LM (L1和L2)中的分布。
(I) F4_F3成纤维细胞和肿瘤细胞(CK19)的多色免疫组织化学染色。
(J) GSE39582数据集中F3high和F3low患者的总体生存情况。
结果展示7:表达F3的成纤维细胞亚群在结直肠癌原发肿瘤中富集并分泌肿瘤因子,与结直肠癌患者的不良预后相关
F2_MCAM富集JAG1和NOTCH3,参与NOTCH信号通路。F4_F3富集C3和CXCL1,表明该亚群参与补体和炎症反应通路(图7A和B)。此外,参与血管生成和肿瘤侵袭的肿瘤因子,如VEGFA、NRG1、HGF、GDF15、AREG和BMP2,在F4_F3中富集(图7C)。 F4_F3与肿瘤细胞的相互作用分析进一步揭示了它们通过NRG1和Erb-B2受体酪氨酸激酶3 (ERBB3)通路进行交叉对话,ERBB3几乎在肿瘤细胞中富集,并能与ERBB2形成异源二聚体,促进肿瘤细胞增殖和CRC患者对西妥昔单抗的耐药(图7D)。 ST分析也表明F3与NRG1共定位,包围ERBB3+肿瘤细胞(图6G和7E至I) 。 Transwell迁移实验显示,重组人NRG1 (rNRG1)可以促进RKO和SW620细胞的迁移(图7J)。F3和NRG1高表达的CRC患者总生存期较差(图7K)。这些结果表明,富含cc的成纤维细胞F4_F3可能通过分泌肿瘤因子导致CRC患者的不良预后。
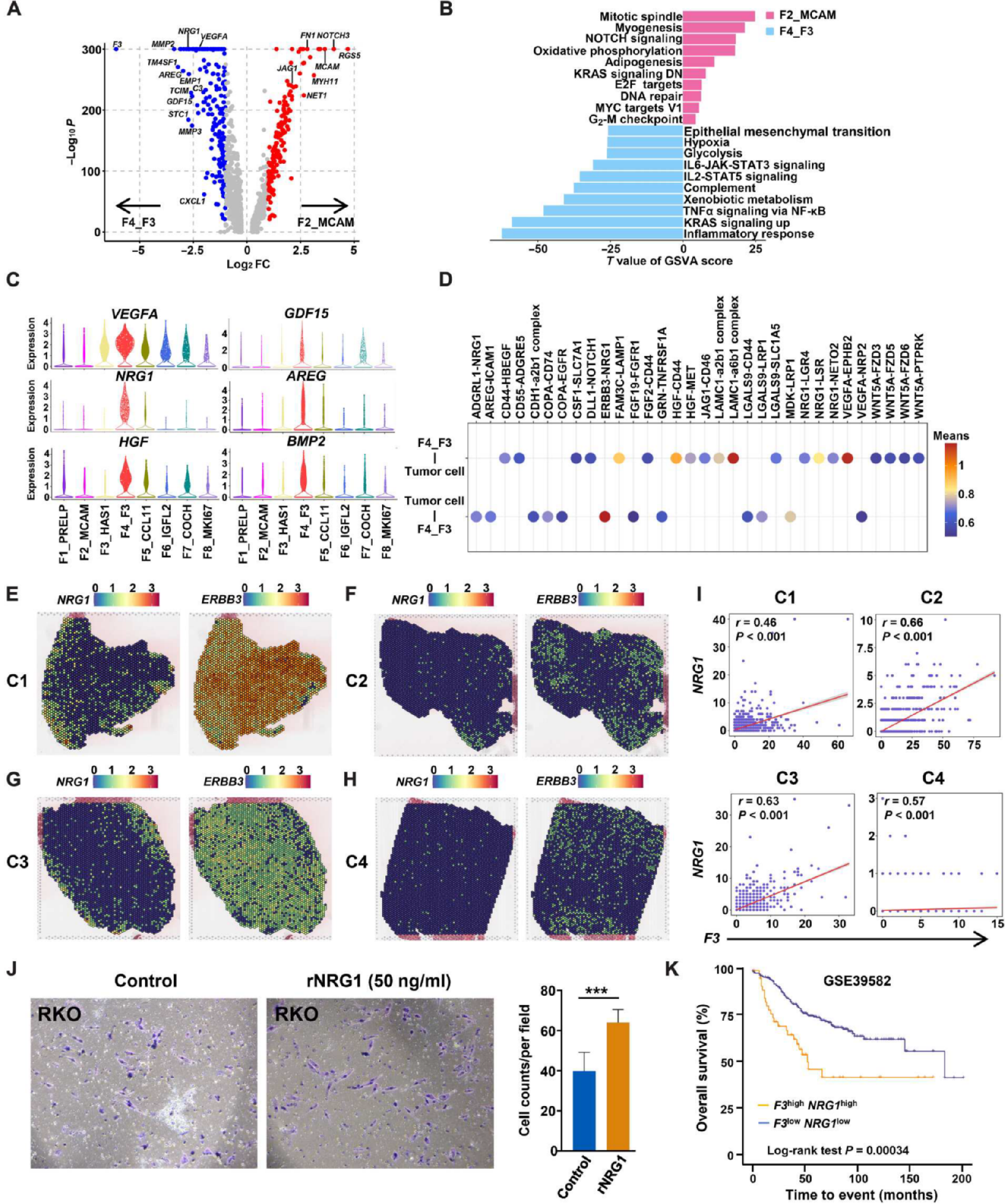
(A) F2_MCAM和F4_F3之间差异表达基因的火山图。
(B) GSVA分析显示F2_MCAM和F4_F3亚群富集的通路。
(C)小提琴图显示成纤维细胞中VEGFA, NRG1, HGF, GDF15, AREG和BMP2的表达。
(D)通过CellPhone DB建立肿瘤细胞与F4_F3成纤维细胞之间的通信网络。
(E) NRG1和ERBB3在C1样本中的分布。
(F) NRG1和ERBB3在C2样本中的分布。
(G) NRG1和ERBB3在C3样本中的分布。
(H) NRG1和ERBB3在C4样本中的分布。(一)F3 (x轴)与NRG1 (y轴)的Pearson相关性。
(J) rNRG1对RKO细胞迁移的影响。实验中统计6个不同视野的迁移细胞数并取平均值。进行了3个独立的实验。条形代表平均值±标准差(***P <0.001)。
(K)来自GSE39582数据集的F3high、NRG1high和F3low、NRG1low CRC患者的总生存期。
结果展示8:LM 肿瘤微环境( TME )中表达MCAM的成纤维细胞通过Notch信号通路调控CD8_CXCL13细胞的生成
RBPJ在LM中的表达与CXCL13和ITGAE呈正相关,而在CC中未观察到(图8A)。CD8_CXCL13和CD4_CXCL13亚群主要表达NOTCH1受体(图8B)。F2_MCAM子集富集了JAG1, F5_COCH子集富集了DLL1,而E2_DLL4子集富集了DLL4、JAG1和JAG2(图8C)。使用CellPhone DB对Notch及其配体的相互作用分析显示,在内皮细胞中,E2_DLL4亚群与CXCL13+ T细胞的相互作用最强,而在成纤维细胞中,F2_MCAM簇通过JAG1-NOTCH1与CD8_CXCL13和CD4_CXCL13亚群的相互作用最强(图8D)。接下来,作者根据LM中F2_MCAM的比例将患者分为两组,发现F2_MCAM-high组患者的LM中CD8_CXCL13亚群比例更高(图8E)。GEO数据集分析表明,F2_MCAM浸润评分较高的患者在LM中有较高的CD8_CXCL13亚群浸润评分,但在CC中没有这一情况(图8F)。与单细胞结果一致,在ST样本中,F2_MCAM浸润评分较高的区域CD8_CXCL13浸润评分较高(图8G和H)。
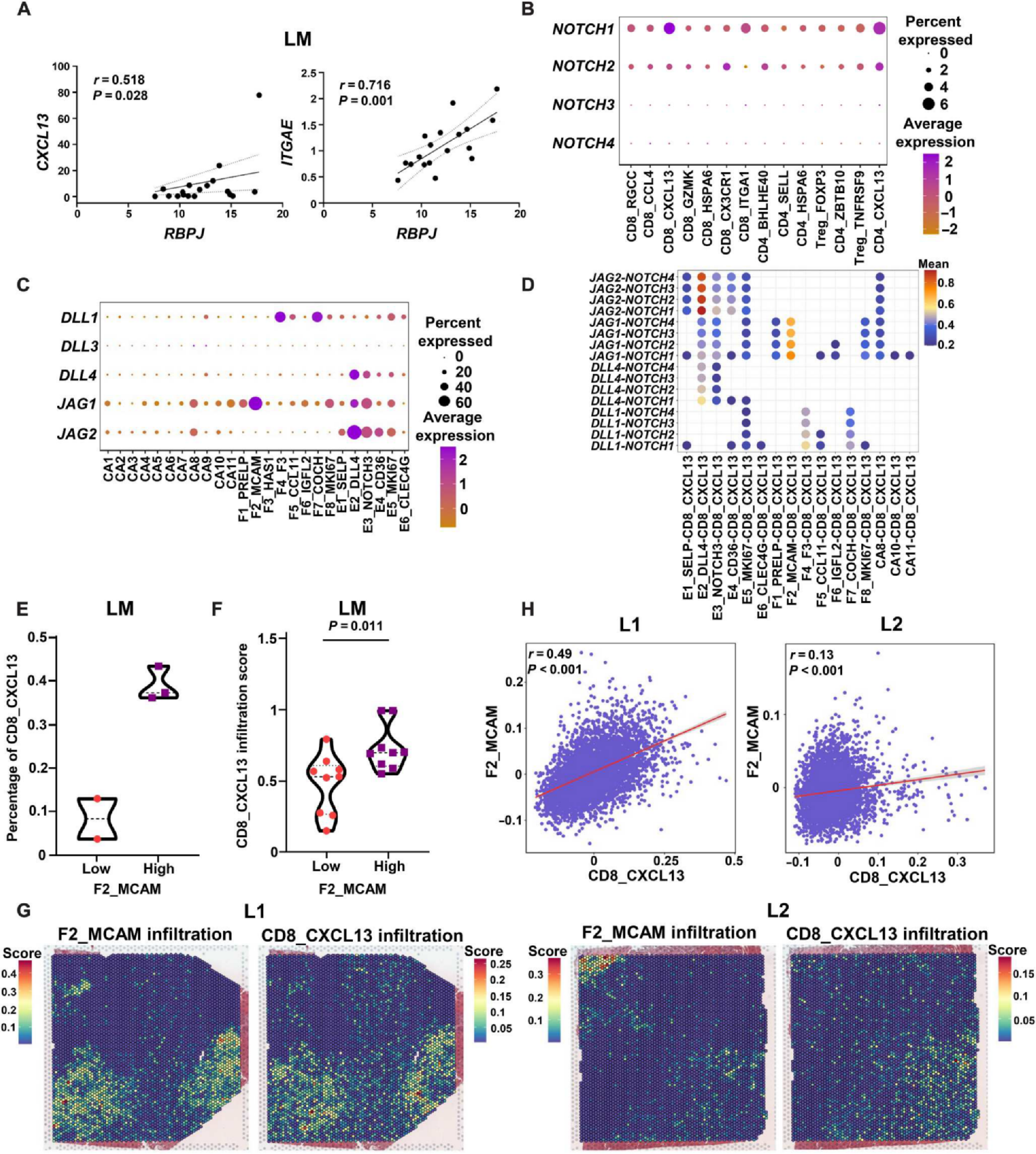
(A)使用GSE50760数据集显示LM中CXCL13, ITGAE和RBPJ的相关性的散点图。
(B) T细胞簇中NOTCH1、NOTCH2、NOTCH3、NOTCH4的表达情况。
(C)非免疫细胞团中DLL1、DLL3、DLL4、JAG1、JAG2的点图。
(D)通过CellPhone DB研究Notch信号通路在CD8_CXCL13簇和非免疫细胞之间的通信网络。
(E) scRNA-seq数据的LM中F2_MCAM浸润高组和低组中CD8_CXCL13的百分比。
(F) GSE50760数据集LM中F2_MCAM浸润高、低组CD8_CXCL13浸润评分。
(G)通过ST分析L1和L2中F2_MCAM和CD8_CXCL13亚群的浸润情况。
(H) L1和L2中CD8_CXCL13 (x轴)和F2_MCAM (y轴)签名评分的Pearson相关性。
 技术咨询:
技术咨询: