联合分析专题(十三)单细胞测序联合多组学分析揭示原发性和转移性食管鳞状细胞癌的空间异质性
2023-12-25
原发性和转移性食管鳞状细胞癌的空间异质性
单细胞转录组测序( Single -cell RNA -sequencing)是指在单个细胞水平上对 RNA 进行高通量测序和分析的新技术。不同于常规组织或细胞群测序得到的结果(只是大量细胞平均表达水平),单细胞测序能够深入挖掘细胞异质性的信息。目前,单细胞测序已广泛应用于肿瘤异质性、免疫微环境、神经科异质性、免疫微环境神经科 、胚胎发育细胞分化等领域的研究。同种细胞会由于所处的生理状态出现差异表达,常规的bulk RNA(bulk就是我们测的是所有细胞的总RNA(mRNA)取平均值代表每个基因的表达量。)并不能捕获这种差异表达,而这种差异又代表着表型背后的机理。为了捕获这种差异,单细胞测序技术应运而生。
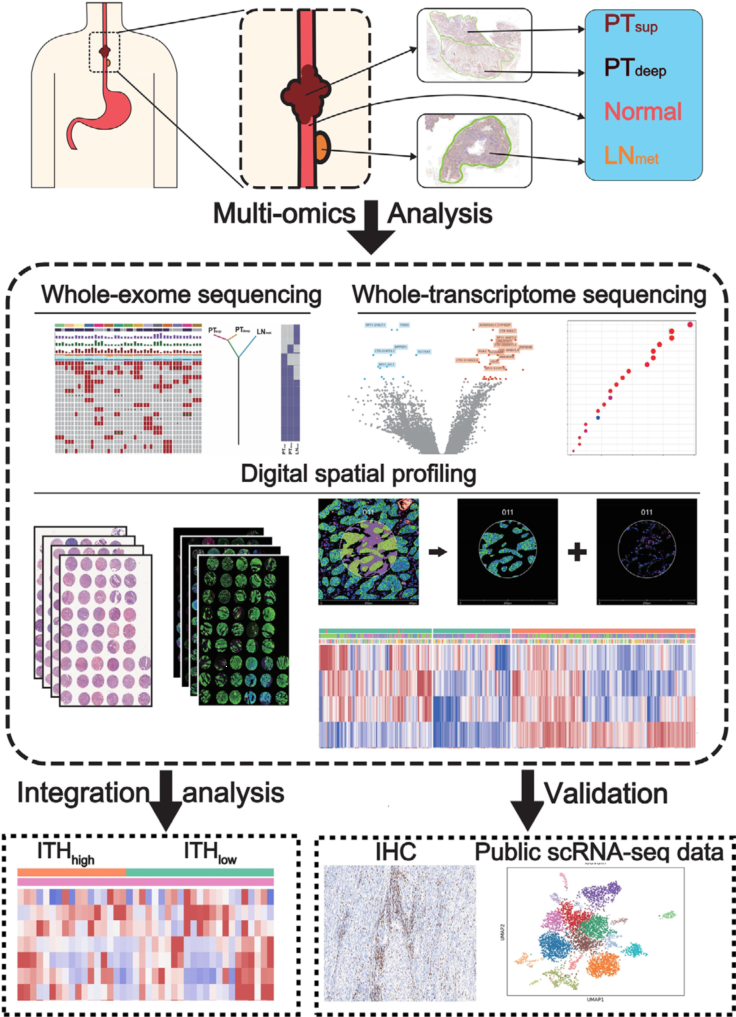
利用多组学技术,如全外显子测序、全转录组测序和空间分辨的数字化空间分析,结合单细胞测序技术探究食管鳞状细胞癌肿瘤深层、表层和淋巴转移区域的空间基因组肿瘤内异质性可以加深对肿瘤的了解,指导更加精确的诊断,制定更好的临床治疗策略。
推荐文章:Multi-omics analyses reveal spatial heterogeneity in primary and metastatic oesophageal squamous cell carcinoma, Clin. Transl. Med. 2023, DOI: 10.1002/ctm2.1493.
联合分析思路
技术路线
结果1:ESCC患者和样本的概述
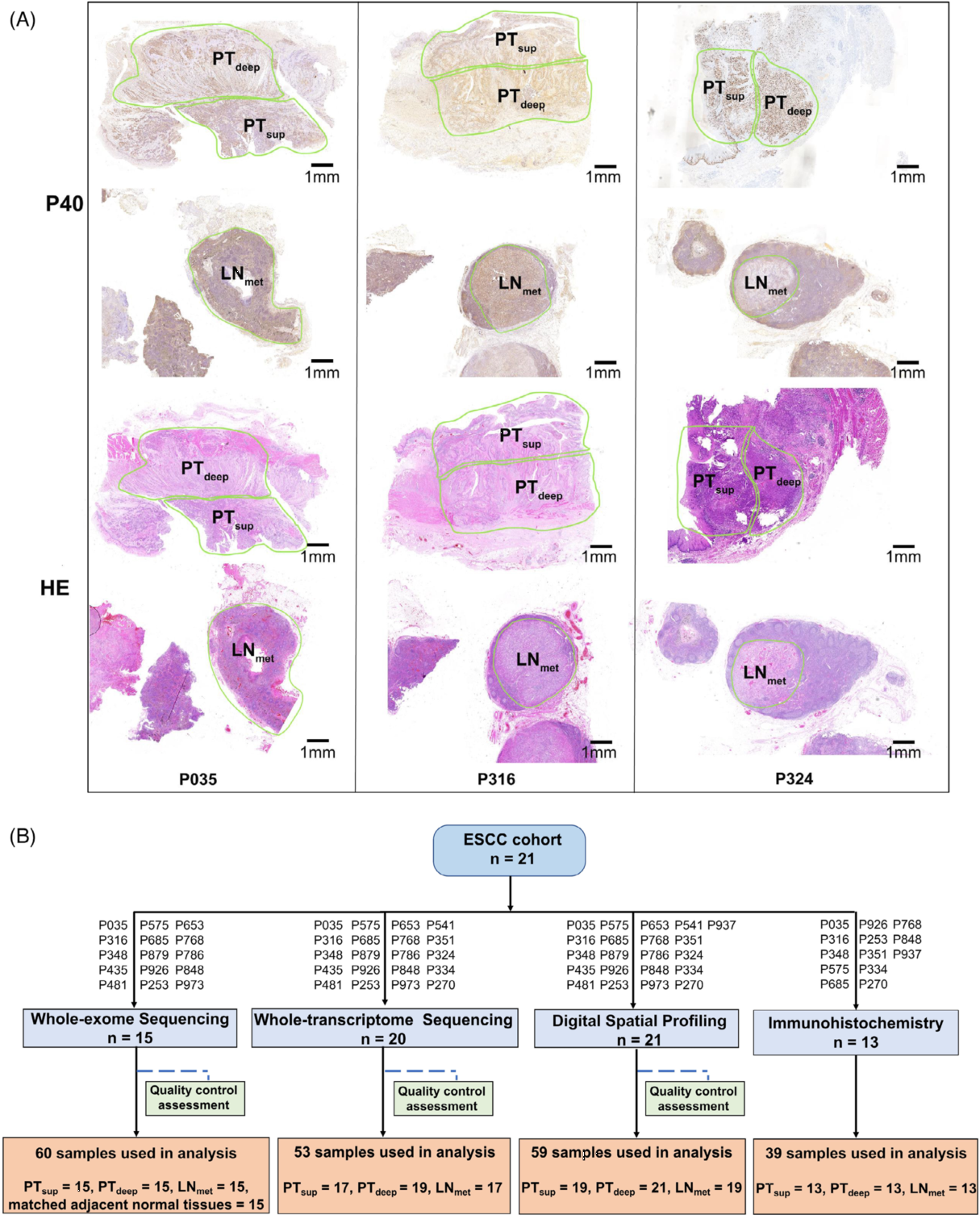
(A)从切除标本中选择面积内含有肿瘤区域最多的组织块进行P40免疫组织化学(IHC)和HE染色。根据IHC和HE结果将肿瘤划分成三个不同的区域。
(B)概述所使用的方法以及患者和样本的流程图。
结果2:ESCC中的空间基因组异质性
作者共收集了15例ESCC患者的45个肿瘤样本(每个样本三个区域:PTsup, PTdeep和LNmet)和15个匹配的癌旁组织进行WES分析。每个患者的三个区域突变数量和突变类型各不相同(图2A)。PTup、PTdeep和LNmet的独特突变率分别为15.72%、5.02%和32.00%(图2B)。图2C显示了45份ESCC样本中突变频率在16%以上的每个基因的各种变异类型。在发现的突变基因中,TP53是三个亚区中最常见的突变基因(93%),其次是TTN(47%)和ZNF429(33%)。接下来,作者研究了三个区域内基因拷贝数变异(CNA)的空间肿瘤内异质性(ITH)(图2D)。在大多数情况下,来自同一患者的PTup和PTdeep共享了大多数CNAs,但它们之间的一些拷贝数事件中表现出可区分的差异。为了探索PTup、PTdeep和LNmet之间的基因组进化,作者利用在单个肿瘤区域检测到的体细胞突变(沉默和非沉默)构建了系统发育树。
(A)在每个ESCC个体中使用WES检测到的三个肿瘤区域(PTup, PTdeep和LNmet)的突变数量(n = 15)。
(B)韦恩显示ESCC三个亚区之间重叠和独特的突变基因。
(C)每个ESCC患者的三个肿瘤区域内基因突变图。
(D)基因拷贝数变异(CNA)图。
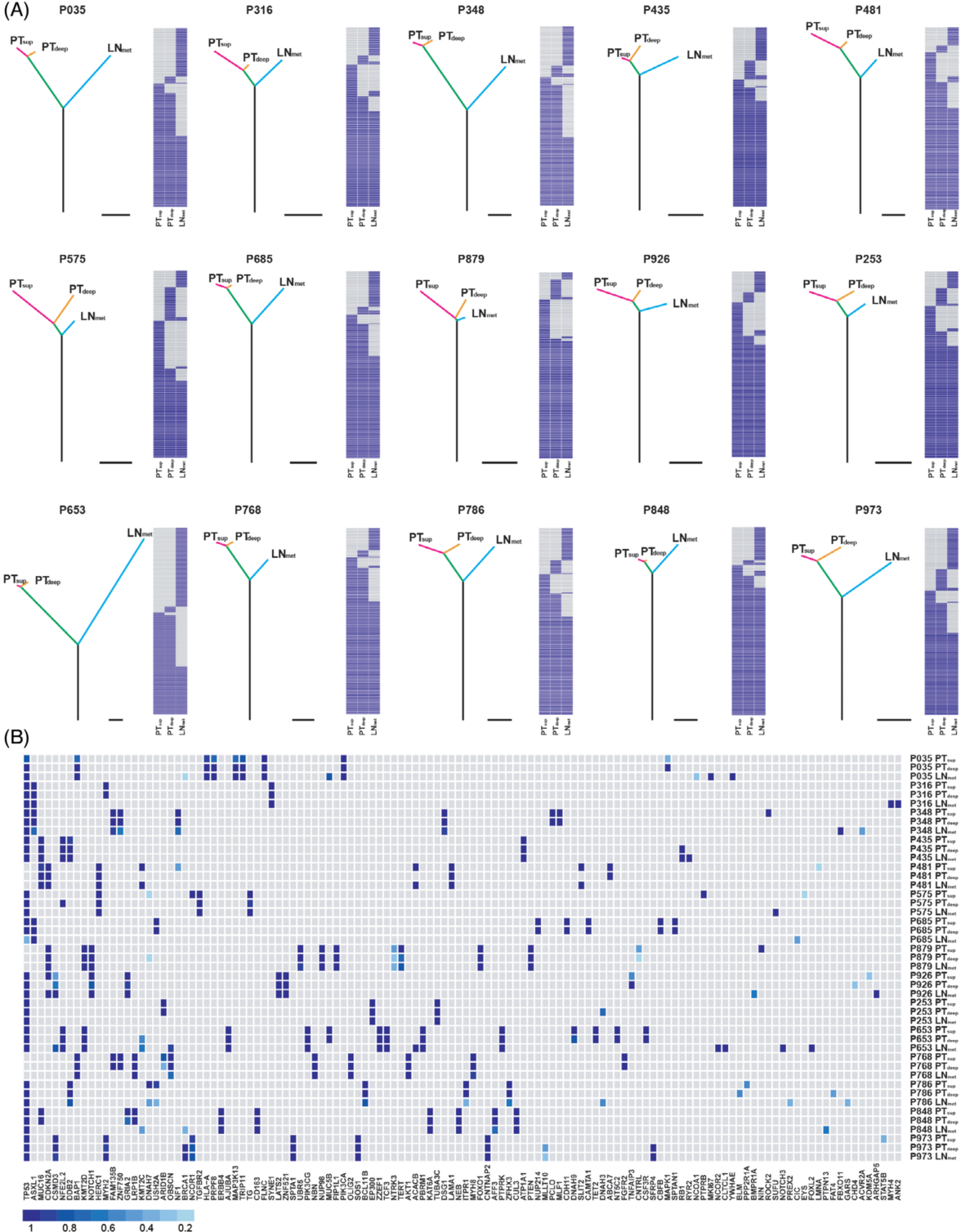
(A)采用wagner简约法,利用PHYLIP对所有体细胞突变构建系统发育树。树干和树枝的长度与获得的突变数量成正比。热图显示每个肿瘤区域存在(蓝色)或不存在(灰色)体细胞突变。比例尺:25个突变。
(B)热图展示了食管鳞状细胞癌(ESCC)肿瘤每个区域中潜在驱动突变的克隆状态。
结果3: ESCC中RNA谱和肿瘤微环境( TME )的空间异质性
作者通过全外显子测序和全转录组测序获得来自PTtsup(17,85%)、PTdeep(19,95%)和LNmet(17,85%)的转录组数据(图1B)。图4A和图4B显示不同肿瘤区域的差异表达基因和差异基因表达韦恩图。在PTsup组和PTdeep组之间,相关免疫调节剂的表达没有显著差异,但是与Lnmet组相比具有较多差异免疫调节剂表达(图4C)。接下来,作者分别使用xCell和quanTIseq评估四个区域中特定细胞亚群的相对丰度和比例(图4D)。为了进一步证实TME在ESCC中的异质性,作者研究了Jia等人从ESCC的PT和LNmet中获得的scRNA-seq数据集。该数据集包括来自四份PT组织(27,979个细胞)和三份LNmet样本(24,751个细胞)的单细胞转录组数据。对比分析PT和LNmet之间6种主要细胞类型的比例,发现细胞成分的丰度和比例都有显著差异(图4F和G)。作者得出在LNmet中,DC、B细胞和相关亚型的丰度和比例都是富集的。
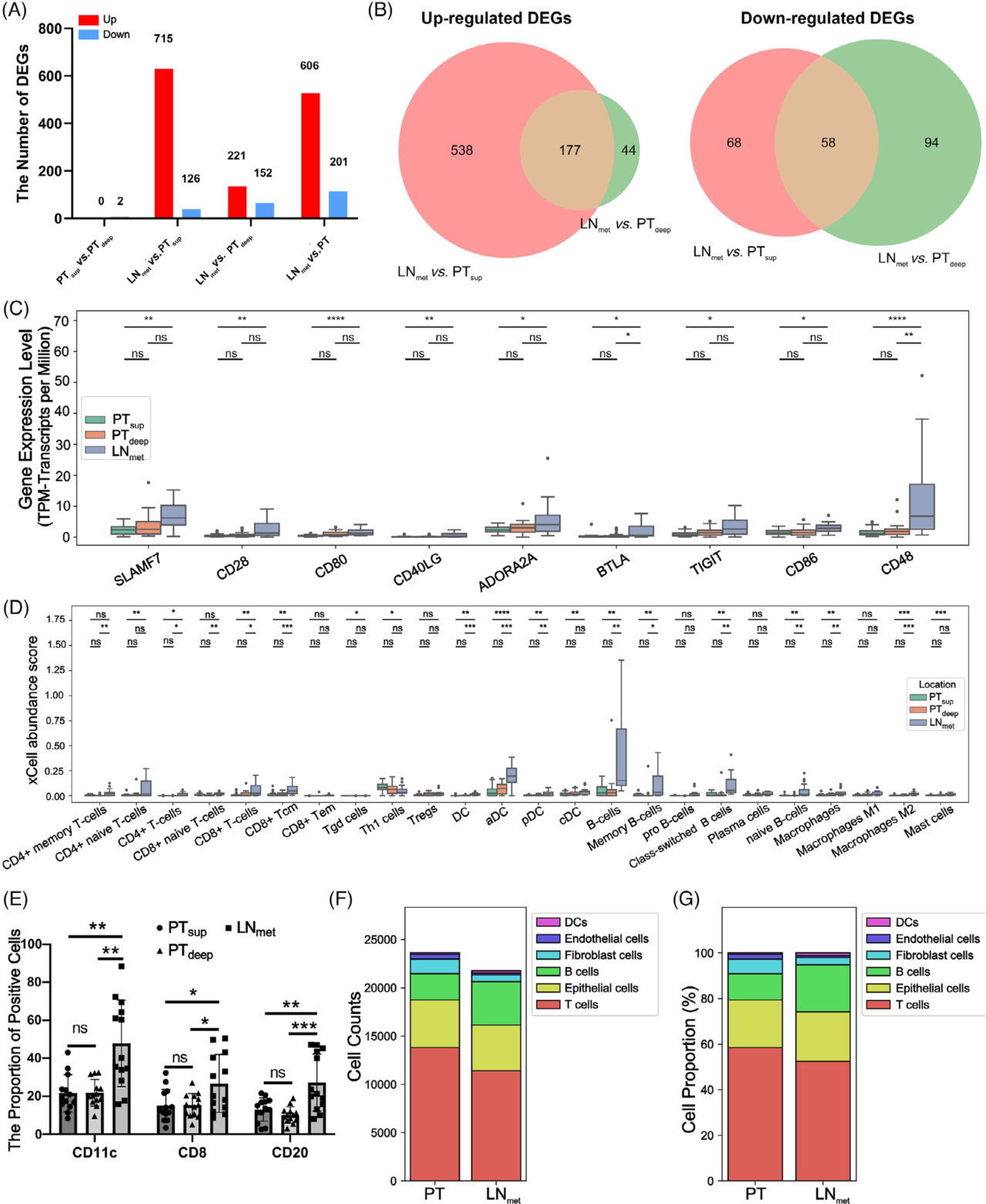
(A)在肿瘤区域分析中具有显著差异的转录组中的基因数量。
(B)韦恩图显示LNmet与PTsup和LNmet与PTdeep之间不同且重叠的DEG。
(C)三个亚区免疫调节基因表达水平的比较。
(D)箱形图显示了使用xCell估计的三个不同亚区中24个免疫细胞的丰度。
(E) CD11c、CD8、CD20染色阳性细胞比例。
(F和G) 柱状图显示了来自Jia等人的scRNA-seq数据集的PT和LNmet中六种主要细胞类型的细胞丰度(F)和比例(G)。
ns: no significance, *P < .05, **P < .01, ***P < .001, ****P < .0001. DCs:树突状细胞, aDC:活化的DC,cDC:传统的DCs,CD8+ Tem:CD8+效应记忆T细胞, DEGs:差异表达基因,FDR:错误发现率,pDC:浆细胞样DC,sscRNA-seq:单细胞rna测序,Th1细胞:辅助性T型细胞;Tregs:调节性T细胞。
结果4:利用DSP研究ESCC免疫环境的空间异质性
空间分辨多路DSP通过表征免疫相关蛋白和免疫细胞库来识别不同区域之间的差异。作者设计了DSP实验来研究ESCC免疫环境的空间异质性(图5A)。为了选择ROIs,同时用荧光标记抗体对TMA切片进行染色,白细胞标记CD45标记基质,上皮细胞标记PanCK标记肿瘤,核染色SYTO13标记细胞核(图5B)。接下来,使用掩蔽和分割策略将每个ROI分割成两个AOI,分别作为基质富集(CD45阳性染色和基质富集段)和肿瘤富集(PanCK阳性染色和肿瘤富集段)的区室(图5C)。作者证实在许多AOI中,PD-L1蛋白表达水平较低,并且AOI之间存在差异(图5D)。作者注意到CTLA4在PTdeep的基质和所有AOI(不包括肿瘤AOI)中的表达明显高于PTsup和LNmet(图6A vs. B, 6E vs. F)。
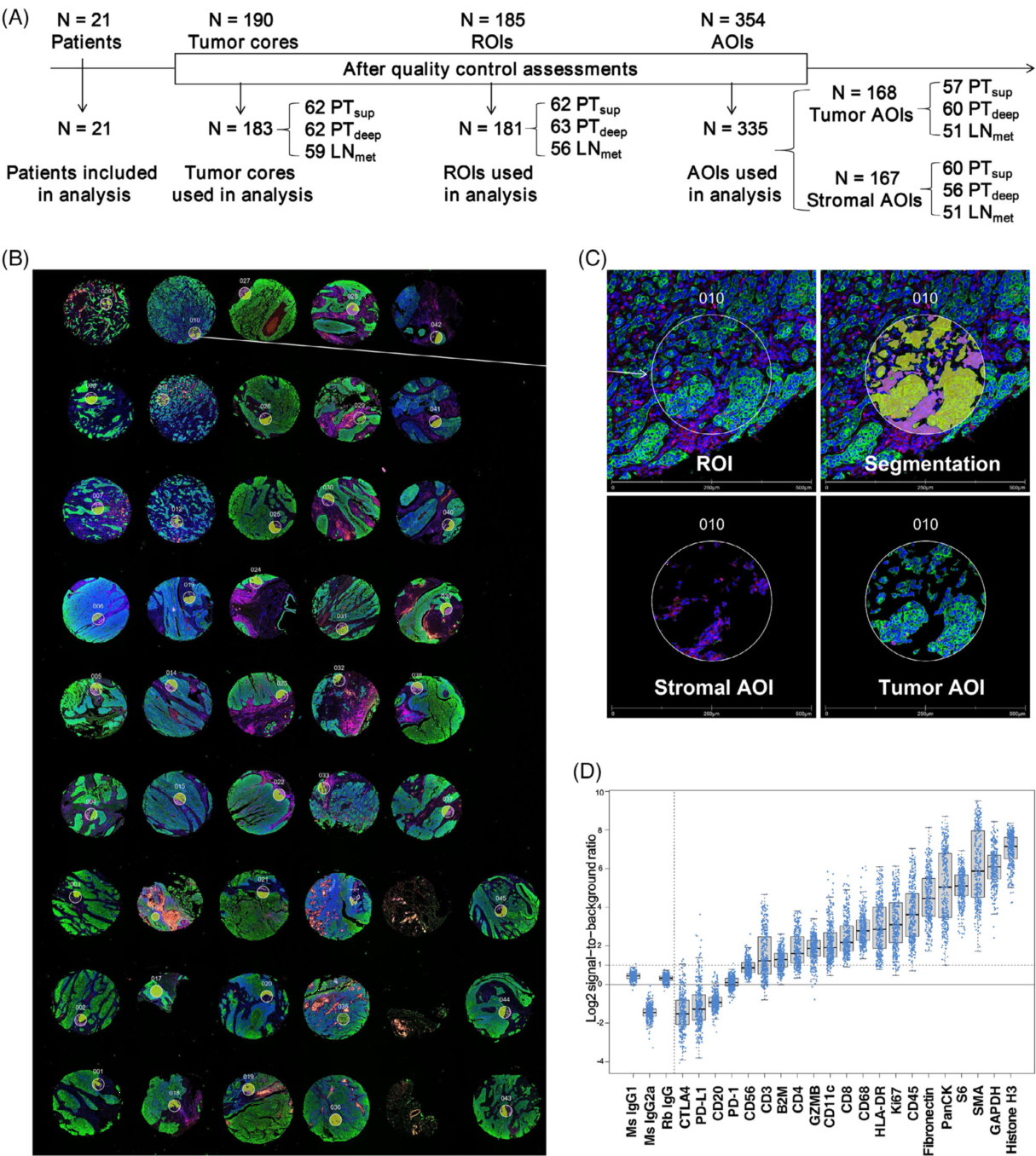
(A)研究设计示意图及工作流程。有LN转移的ESCC患者(n = 21)在免疫细胞图谱(24个蛋白)的4个TMA中代表性DSP。总共185个ROI中,181个用于分割。共分析了335个AOI。
(B)使用GeoMx DSP系统获取的TMA代表图像。对应于各自ROI编号的数字注释。
(C)基于病理学家和形态学标记免疫荧光染色以及荧光共定位产生的区域图像的代表性ROI 和AOI注释。PanCK(绿色),CD45(红色),SYTO13(蓝色)。
(D)各靶蛋白相对于阴性对照的表达质量控制。数据以log2 SNR比表示。每个点代表一个AOI。
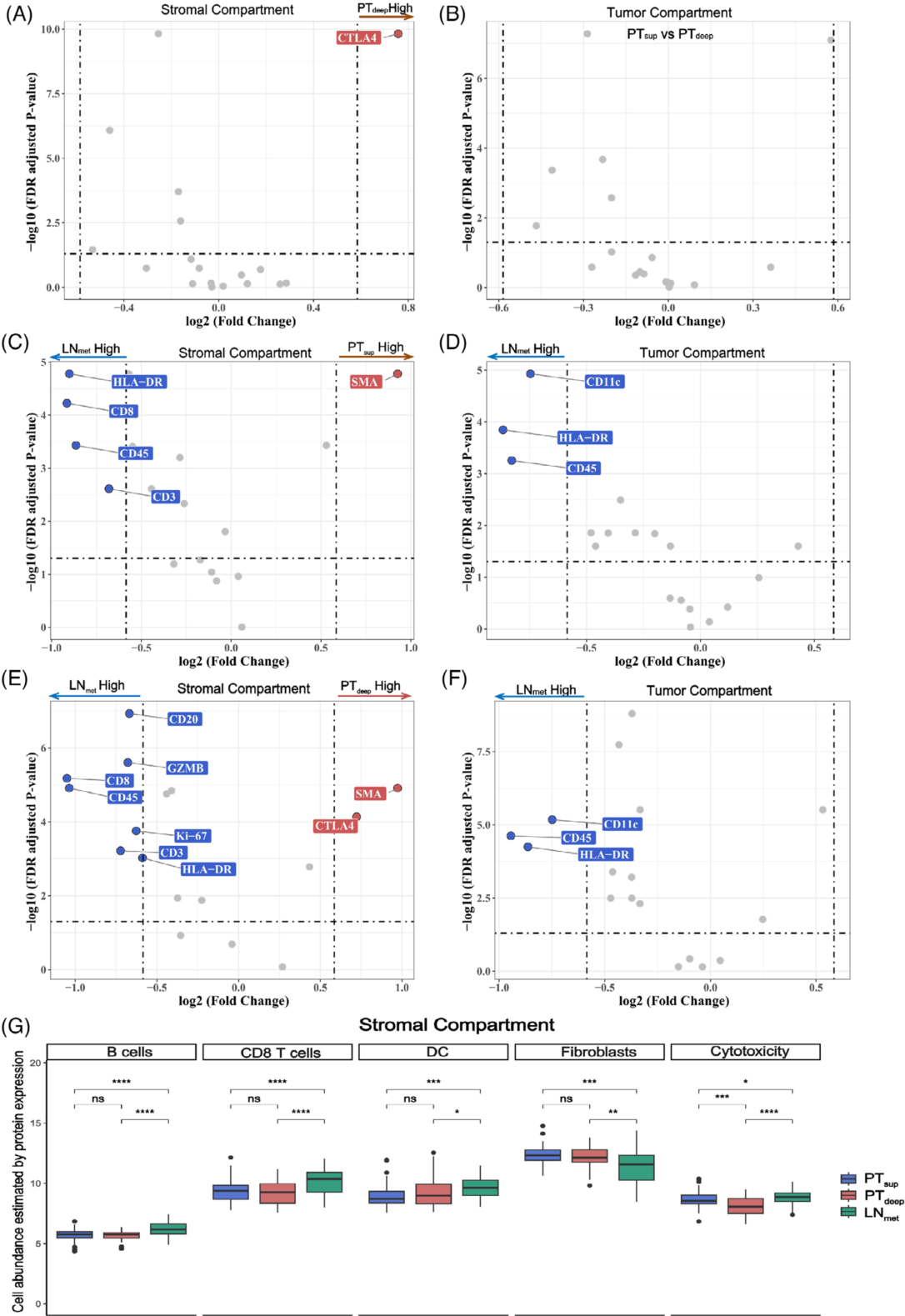
(A和B)火山图显示了在基质(A)和肿瘤富集(B)区域中基于PTsup与Ptdeep相比的差异蛋白表达。
(C和D)火山图显示了在间质(C)和肿瘤富集(D)区域中LNmet和Ptsup相比的差异蛋白表达。
(E和F)火山图显示了在基质(E)和肿瘤富集(F)区域中Lnmet与Ptdeep相比蛋白的差异表达。
(G)箱形图显示三个不同区域基质内由蛋白表达推算出的细胞丰富度。
结果5:结直肠癌的原发灶和肝转移灶中存在不同的成纤维细胞亚群
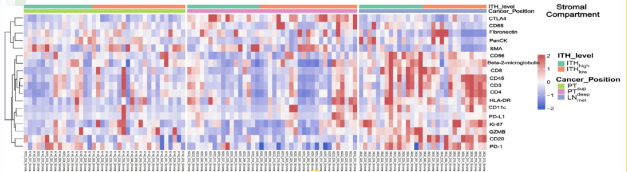
为了更深入地了解ESCC复杂的空间异质性,作者整合了多组学数据,包括包括基因组ITH水平、mRNA/蛋白表达和免疫细胞丰度。如图7A-C所示,PTsup、PTdeep和LNmet的ITHhigh和ITHlow组之间存在差异,表明ESCC各区域存在转录异质性。此外,作者发现基因组ITH水平与免疫细胞丰度之间存在显著关联(图7D)。当关注肿瘤或基质时,在每个亚区内的每组中都出现了不同的蛋白质和免疫细胞谱(图7E、F和S11D),进一步突出了ESCC的空间异质性。

(A - C) ptup (A)、PTdeep (B)和LNmet (C)基因组ITHhigh和ITHlow组之间的deg火山图。
(D)箱形图显示基因组ITH水平与使用xCell估计的三个不同亚区免疫细胞丰度之间的关联。
(E - F)热图显示基因组ITH水平与每个亚区肿瘤(E)或基质室(F)中每个AOI蛋白的相对表达之间的关系。从蓝到红的颜色渐变表示从低到高的相对表达水平。
结论:
1、作者通过对原发肿瘤的浅表和深部区域以及匹配的淋巴结转移区域的多组学分析,全面表征了ESCC的肿瘤内空间异质性。
2、这些发现强调了基于多组学数据的无偏分子分类的临床意义,以及它们在提高对ESCC的认识和治疗方面的潜力。
 技术咨询:
技术咨询: