联合分析专题(十六)综合空间转录组和代谢研究揭示人类损伤脑代谢异质性
2024-01-17

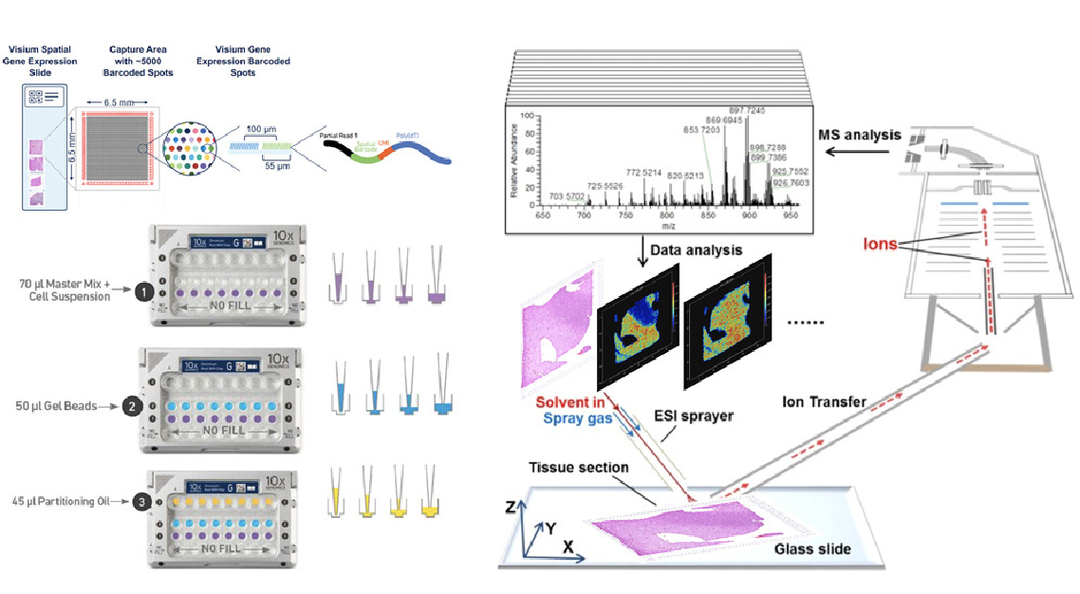
单细胞转录组学可以为大脑中不同细胞类型的大量无偏样本提供定量的分子特征。大脑的细胞构成具有极大的多样性,单细胞分析,特别是RNA测序(RNA-seq)的转录组分析,促进了神经系统疾病中细胞类型的鉴定。尽管单细胞转录组数据集能够定位中枢神经系统中数百种神经元和非神经元细胞类型,但却缺少解剖和生理(代谢)信息。随着多组学数据集的发展,验证并整合结果到空间组织和功能取向的生物学理解中形成了主要的挑战。空间多组学的最新进展为连接基于功能的转录组学和代谢图谱提供了机会,从而促进了跨模式的进展并获得功能信息。
作者从6名创伤性脑损伤(Traumatic brain injury,TBI)患者的手术样本中生成空间转录组和代谢物。由此产生的空间标记基因在分析方法、测序技术和模式上具有高度可复制性,是人类损伤大脑中多种代谢变化的综合分子标记。该图谱包括一个脂质过氧化区域,类似于大脑中受损的神经元,且进一步发现不平衡的肌醇和肌醇磷酸以及相关的空间标记。研究结果强调了受伤大脑中复杂的转录组调控和代谢改变,并将直接使试剂的设计能够针对人类大脑中的特定基因进行功能分析。
文献:Zheng P, Zhang N, Ren D, Yu C, Zhao B, Zhang Y. Integrated spatial transcriptome and metabolism study reveals metabolic heterogeneity in human injured brain. Cell Rep Med. 2023 Jun 20;4(6):101057. doi: 10.1016/j.xcrm.2023.101057
1、单细胞转录组学揭示TBI患者损伤脑细胞亚群的差异
为了探索TBI的细胞组成,收集了手术后TBI患者的脑挫伤组织进行单细胞RNA测序(scRNA-seq),并对细胞进行tSNE分析,得到两组10个簇(图1A)。细胞注释后分别命名为B细胞、内皮细胞、颗粒细胞、小胶质细胞、壁细胞、中性粒细胞、自然杀伤(NK)细胞、少突胶质细胞和T细胞(图1B)。在研究信号通路时,KEGG分析显示,严重TBI中上调的基因主要富集于感染和免疫状态,包括Th1、Th2、Th17分化和抗原加工和递呈(图1C),而下调的基因则富集于神经炎症,如肿瘤坏死因子(TNF)信号、白细胞介素-17 (IL-17)、HIF-1和核因子kB (NF-kB)信号(图1D)。
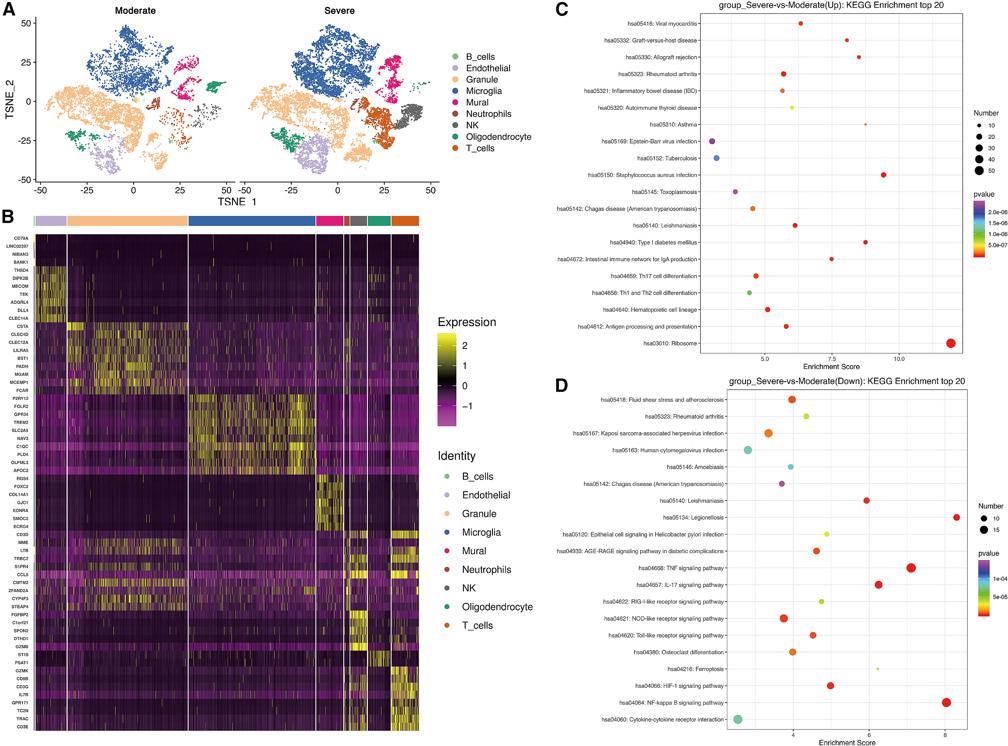
图1 TBI患者损伤脑细胞亚群的差异
(A-B) t-SNE图显示了所有样本中的10个细胞亚群(A)和10个簇中的细胞注释(B);
(C)严重TBI中DEGs上调的KEGG通路;
(D)重度脑外伤中下调的DEGs中的KEGG通路。
使用新鲜手术样本进行空间转录组(ST)来表征受伤大脑的转录水平。首先,使用均匀流形近似和投影(UMAP)对空间转录组数据集进行反卷积,进行降维以可视化集群13(图2A),确定了组织学上可识别的10个基本结构转录组景观。对每个因素的主要贡献基因的分析证实了这些集群的身份及其混合特征(图2B)。在驱动胶质瘤簇3的基因中,发现SLC47A2、C11orf88、MAP3K19和ADGB在胶质瘤组织中高表达,PRG4、BMP5、SIX2和FOXD2在脑膜瘤组织中升高。
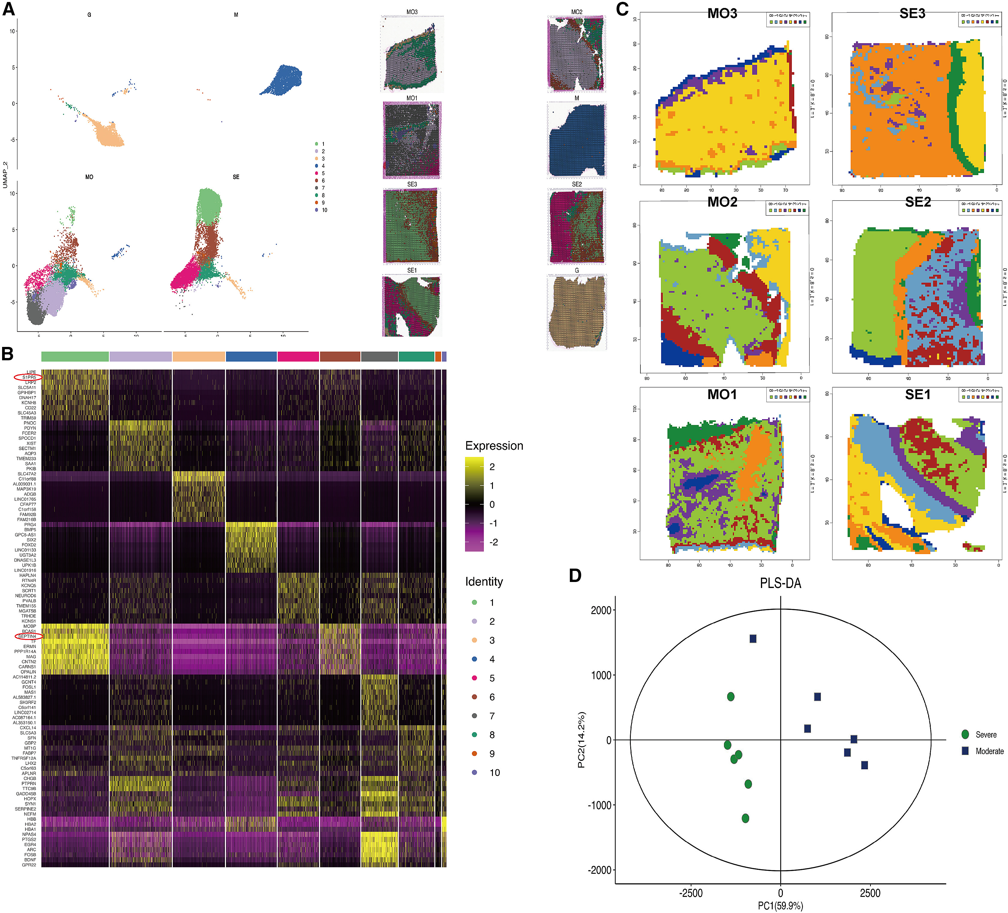
图2 空间转录组学和代谢分析
(A) UMAP还原的聚类分析,以可视化聚类。左图x轴分别表示UMAP降维的第一个和第二个主成分,不同群体的斑点用不同的颜色来区分。右图反映了不同群体在每个样本切片位置的具体分布,颜色与左图对应;
(B)空间标记基因热图。黄色表示高表达,紫色表示低表达;
(C)各样本空间代谢数据在UMAP后的K-means图;
(D) PLS-DA在多个统计比较中区分样本组。
3、空间转录组学筛选代谢物相关基因及通路
使用ST来验证这些基因的区域特异性mRNA表达,ST分析区分了中度和重度脑损伤之间的细胞间室分层(图3A和3B)。进一步应用addmodulescore绘制ST图像中的细胞簇,发现小胶质细胞、NK细胞、T细胞和少突胶质细胞在中度和重度TBI之间的分布不同(图3C-3F)。GO和KEGG富集分析发现,上调基因在髓鞘形成、微管蛋白结合、tau蛋白结合、花生四烯酸代谢和脂质代谢中富集(图3G和3H),而下调基因主要在糖酵解过程、糖皮质激素受体结合、谷氨酸代谢和糖异生中富集(图3I和3J)。

图3 创伤性脑损伤患者脑空间簇的差异
(A-B)t-SNE图显示了所有样本中的12个空间簇(A)和所有样本中空间簇的相对比较(B);
(C-F)样本中细胞簇映射的空间位置:神经胶质细胞(C)、NK细胞(D)、T细胞(E)和少突胶质细胞(F);
(G-J)中度和重度TBI组间空间簇的GO和KEGG结果显示上调基因(G和H)和下调基因(I和J)。
4、通过代谢物相关基因可视化脂质过氧化和神经元缺失
4.1 采用空间代谢分析脑外伤后的代谢变化,发现代谢相关基因S1PR5和SEPTIN4的富集(图4A和4C),这些基因主要在严重TBI组中表达,异质性相对较小。在将这些基因定位到代谢图像上后,观察到S1PR5定义的结构类似于更高的PC(44:7),这是一种脂质标记物,称为脂质过氧化(图4B)。相比之下,SEPTIN4定义了神经元损失区域(图4D), SEPTIN4的表达量较高,其特征是天冬氨酸的分布较低(图4D)。
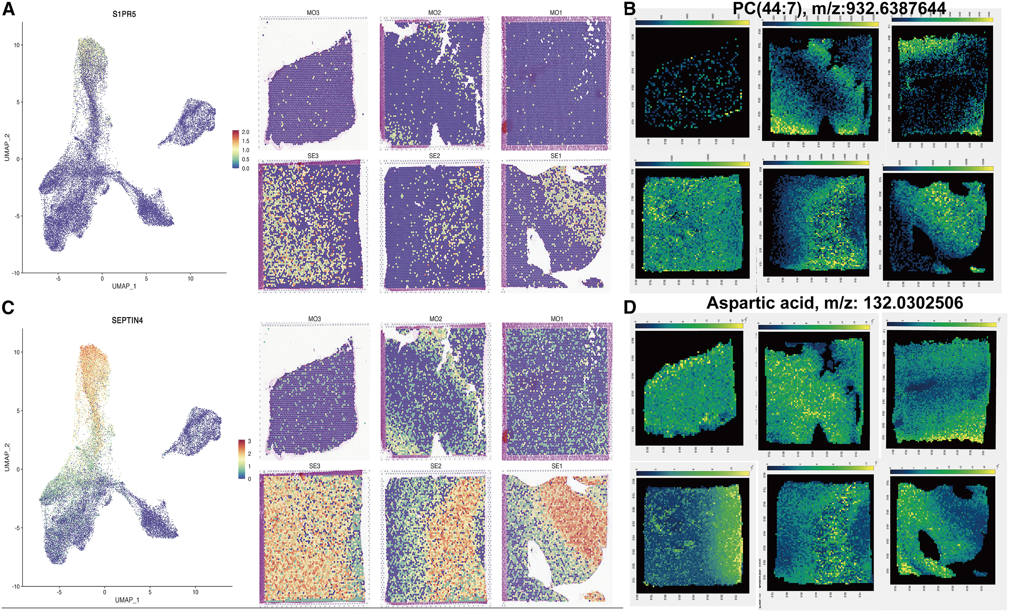
图4 基于S1PR5和SEPTIN4空间标记基因的空间转录组学与代谢物之间的联系
(A) S1PR5的空间表达及其在各样品中的分布,红色表示较高的表达式;
(B)基于空间代谢数据的代谢物:PC(44:7)在各样品中的分布;
(C) SEPTIN4在各样品中的空间表达及其分布。红色表示较高的表达式;
(D)代谢物:根据空间代谢数据,天冬氨酸在各样品中的分布。
4.2 肌醇(MI)增加与脑损伤密切相关,因此进一步研究了肌醇MI的分布,发现MI和MI 1-磷酸的补体表达,MI区域表达越高,MI 1-磷酸的分布越低,反之亦然(图5D和5F)。由于MI的分布与ST集群1和8非常一致,在集群1和8中发现的最前面的基因中,发现SLC5A3(也称为钠/MI交换转运蛋白1)在中度TBI组中高表达(图5A-5C), SLC5A11(也称为钠/MI交换转运蛋白2)在重度TBI组中高表达(图5E, 5G和5H),这与MI和MI 1的磷酸盐分布一致。
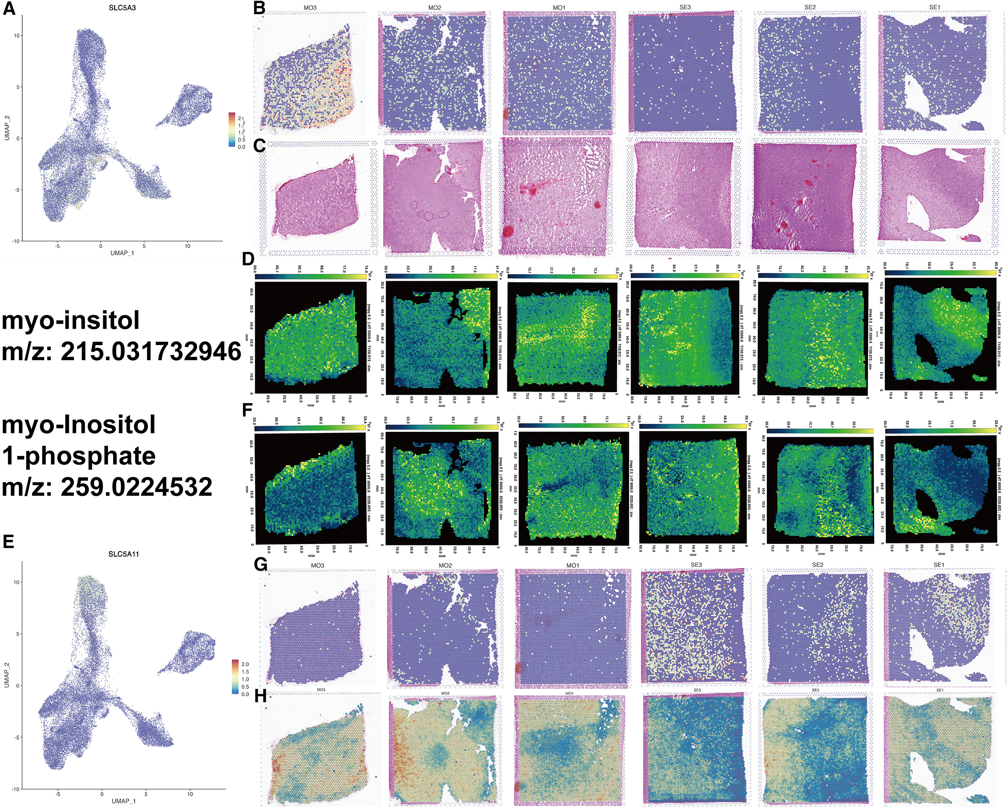
图5 基于SLC5A3和SLC5A11空间标记基因的空间转录组学与代谢物的联系
(A和B) SLC5A3在各样品中的空间表达及其分布。红色表示较高的表达式;
(C)每个样品的H&E图像作为st的参考;
(D)代谢物:基于空间代谢数据的每个样品的肌醇分布;
(E、G) SLC5A11在各样品中的空间表达及其分布,红色表示较高的表达式;
(F)代谢产物:基于空间代谢的肌醇1磷酸在各样品中的分布。
4.3 在之前的报道中,kainic酸可以诱导神经元丢失并增加啮齿动物海马的mINS水平,这是一种癫痫持续状态后(postSE)模型。通过验证发现,与磷酸盐缓冲盐水(PBS)处理的大鼠相比,kainic酸(KA)处理的大鼠NAA/Cr降低,mINS/Cr增加(图6A - 6D)。此外,免疫组织化学(IHC)图像证实,大鼠损伤脑中S1PR5和SEPTIN4的蛋白表达增加(图6E)。通路分析证实,中度和重度TBI组之间不同表达的基因与细胞杀伤和代谢有关(图6F和6G),而氧化石墨烯富集表明细胞杀伤和抗氧化活性参与其中(图6F)。有趣的是,KEGG途径定义了一系列以异种生物降解、萜类、维生素、脂质代谢、聚糖生物合成、能量代谢、碳水化合物和氨基酸代谢为特征的代谢(图6G)。
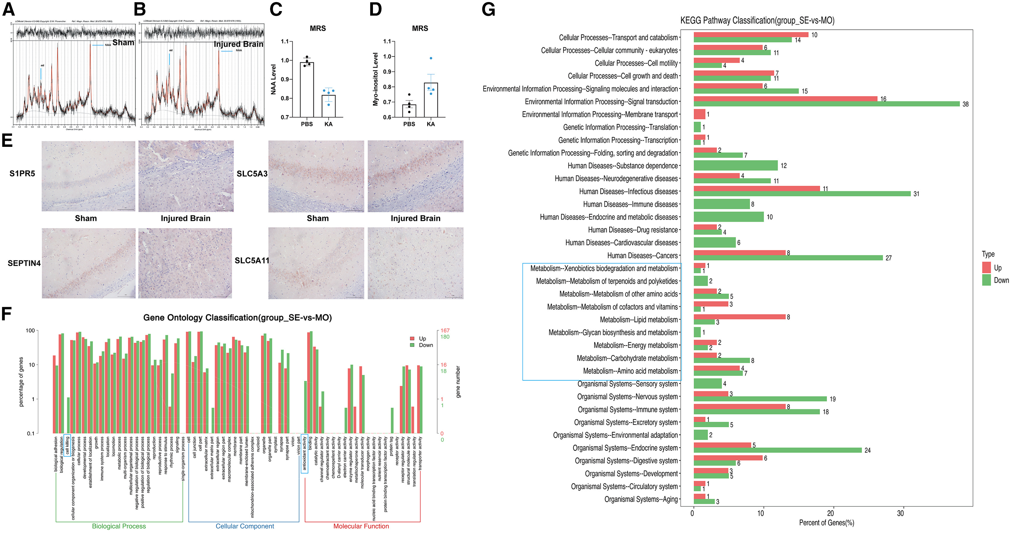
图6 磁共振波谱(MRS)、免疫组化(IHC)和途径验证
(A-D) MRS数据显示NAA/Cr和mINS/Cr水平(每组4个,与Student's t检验相比,*p < 0.05);
(E) KA组和PBS组中SEPTIN4、S1PR5、SLC5A3和SLC5A11的免疫组化图;
(F和G)中度和重度TBI组ST数据中基于DEGs的GO和KEGG分析。
5、空间转录组与代谢物之间的联系
针对代谢物的具体定量指标,考察了SLC5A3、SLC5A11与心肌梗死水平之间的线性关系。首先,特征图和小提琴图用于展示了SLC5A3和SLC5A11的细胞位置。SLC5A3主要表达于内皮细胞,SLC5A11表达于少突胶质细胞、内皮细胞和免疫细胞(图7A-7D)。SLC5A3和SLC5A11都是肌醇和葡萄糖的转运蛋白,SLC5A11与细胞凋亡有关。进一步获得这两个基因的斑点值,并比较中度和重度TBI组中的表达水平(图7E和7F),发现SLC5A3在重度TBI组的相对表达量低于中度TBI组,SLC5A11在重度TBI组的相对表达量高于中度TBI组(图7G和7H);同时发现SLC5A11表达与MI(图7J)和PC(44:7)水平呈正相关(图7P)。
总之,这篇研究表明,与中度TBI患者相比,重度TBI患者的脂质过氧化和心肌梗死水平升高,这可能是其对综合治疗反应较差的原因。
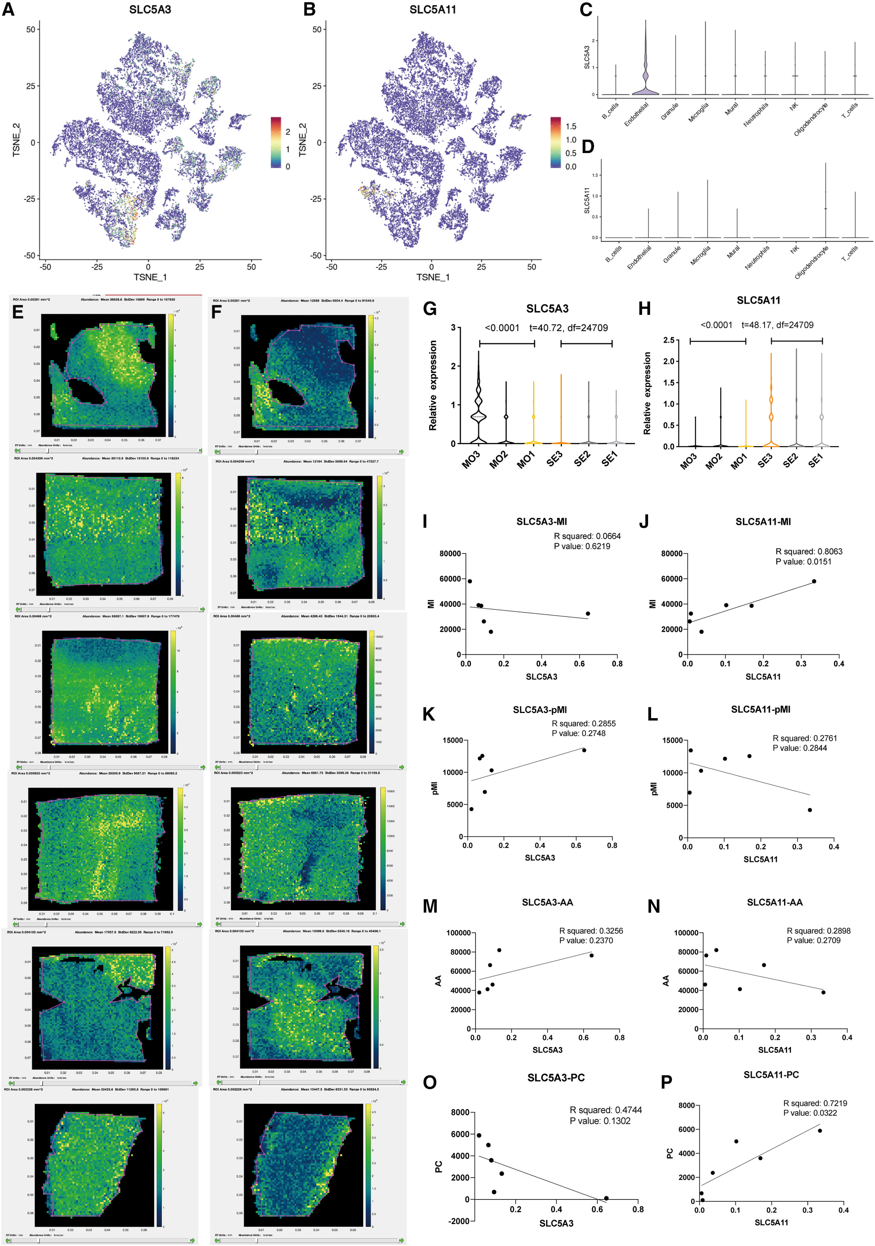
图7 SLC5A3、SLC5A11与TBI代谢物的关系
(A) SLC5A3在不同聚类中的tSNE图;
(B) SLC5A11在不同簇上的tSNE图;
(C) SLC5A3不同簇的小提琴曲线图;
(D) SLC5A11不同簇的小提琴曲线图;
(E) pMI在不同TBI样品(从上到下依次为Se1、Se2、Se3、Mo1、Mo2、Mo3)中的表达情况;
(F)不同TBI样品(从上到下依次为Se1、Se2、Se3、Mo1、Mo2、Mo3)中MI的表达情况;
(G)两组间SLC5A3的相对表达量。
 技术咨询:
技术咨询: