单细胞RNA测序和ATACseq(转座染色质测序测定)揭示肿瘤内中性粒细胞的确定性重新编程
2024-01-22

1、前言
中性粒细胞是体内最丰富的白细胞群。尽管不同类型的中性粒细胞常聚集在肿瘤微环境中,但目前尚不清楚它们如何协调以支持肿瘤生长。Melissa S F Ng等人[1]使用胰腺癌的实验模型,报告了肿瘤浸润的中性粒细胞群,这些中性粒细胞汇聚发育成单个长寿命的“T3”细胞亚群。T3中性粒细胞促进了新血管的生长,从而提高了低氧和营养物质有限的区域的肿瘤存活率。消耗T3中性粒细胞或抑制其血管生成功能可减少肿瘤生长。研究人员认为,中性粒细胞可以在肿瘤微环境中被重新编程为单一功能状态,并且调节前肿瘤中性粒细胞反应可能具有治疗潜力。
[1] Ng MSF, Kwok I, Tan L, et al. Deterministic reprogramming of neutrophils within tumors [J]. Science, 2024, 383(6679): eadf6493.
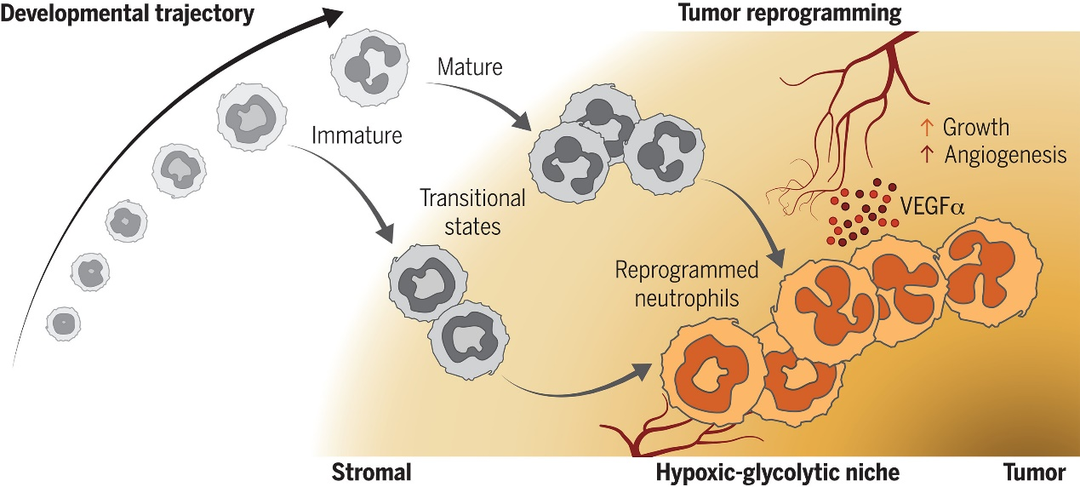
肿瘤浸润的中性粒细胞经历收敛重编程为支持肿瘤生长的促血管生成中性粒细胞。
在癌症中,未成熟和成熟的中性粒细胞均浸润肿瘤。进入肿瘤微环境后,这些中性粒细胞发生分化,导致过渡群体的形成。通过重编程,这些群体最终收敛到终末期中性粒细胞状态。重编程的中性粒细胞强烈表达VEGFα,并定位于肿瘤核心附近独特的缺氧糖酵解生态位。这使它们处于最佳位置,可以在缺氧和营养不良的肿瘤区域发挥促血管生成功能,从而促进肿瘤生长。肿瘤重编程的出现反映了中性粒细胞对环境线索的适应性,使它们能够巩固其前肿瘤反应。
通过单细胞RNA测序、InfinityFlow等方法解析了肿瘤内中性粒细胞的分化途径,发现未成熟和成熟中性粒细胞进入肿瘤后均历经表观组、转录组和蛋白组水平上的重编程,转变成高表达dcTRAIL-R1的T3终末分化状态中性粒细胞,随后定位于具高糖酵解和乏氧特征的肿瘤组织核心区域,发挥促血管生成作用,支持肿瘤生长。研究结果挑战了目前的模型,并提出了靶向中性粒细胞进行癌症免疫治疗的潜力。
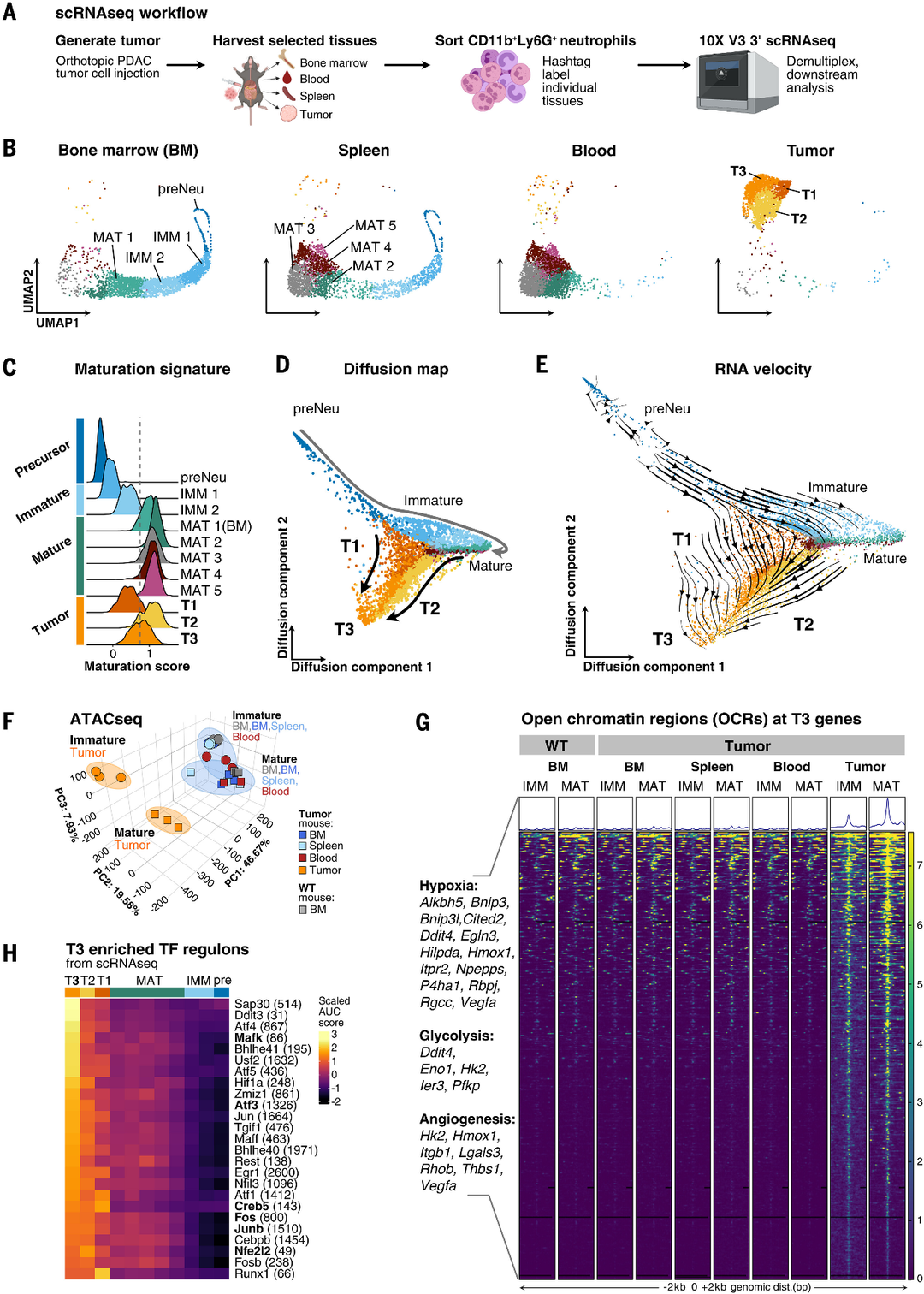
图1. 中性粒细胞浸润胰腺肿瘤并进一步分化并收敛在转录上不同的T3中性粒细胞状态
(A)scRNAseq工作流程示意图。
(B)骨髓(BM)、脾脏、血液和肿瘤中总中性粒细胞的UMAP投影显示肿瘤中三个簇(T1、T2和T3)的强烈富集。进行了Louvain聚类,颜色与识别出的聚类相对应。
(C)中性粒细胞成熟评分可用于沿其分化轨迹识别Louvain簇。直方图显示了(B)中确定的每个簇的成熟基因特征的模块分数,分数最接近1表示最成熟。灰色虚线定义了成熟中性粒细胞的临界值,并设置在成熟2簇的下边界。
(D)使用扩散图方法对所有中性粒细胞进行低维包埋,揭示了成熟中性粒细胞和肿瘤中性粒细胞之间的分支点。散点图显示了扩散分量1和2。浅灰色箭头用于指示从前体、未成熟和成熟中性粒细胞状态的轨迹。黑色箭头表示从T1和T2状态分支成T3中性粒细胞。
(E)RNA速度表明T1和T2收敛分化为T3中性粒细胞。将RNA速度载体投射到扩散图上,嵌入终止于肿瘤和成熟中性粒细胞的速度载体。
(F)ATACseq的主成分分析表明,肿瘤中性粒细胞中建立的染色质可及性的变化使它们远离其他中性粒细胞亚群。对野生型(WT)或荷瘤小鼠的BM(灰色和深蓝色,n=3)、脾脏(浅蓝色,n=3)、血液(红色,n=3成熟,n=2未成熟)和肿瘤(橙色,n=3)中性粒细胞进行ATACseq。数字表示使用的生物重复数。
(G)与差异表达的T3基因匹配的OCR仅在未成熟和成熟的肿瘤中性粒细胞中具有更高的可及性。热图显示指定中性粒细胞亚群的片段映射强度;直方图表示平均映射强度。注释了与缺氧、糖酵解和血管生成相关的T3基因。
(H)热图显示了PySCENIC计算的富含T3中性粒细胞的前25个转录因子调节子的比例AUC分数。括号中的数字表示分配给转录因子调节子的基因数量。在肿瘤相关的未成熟和成熟块状中性粒细胞群中基序富集增加的转录因子以粗体显示。
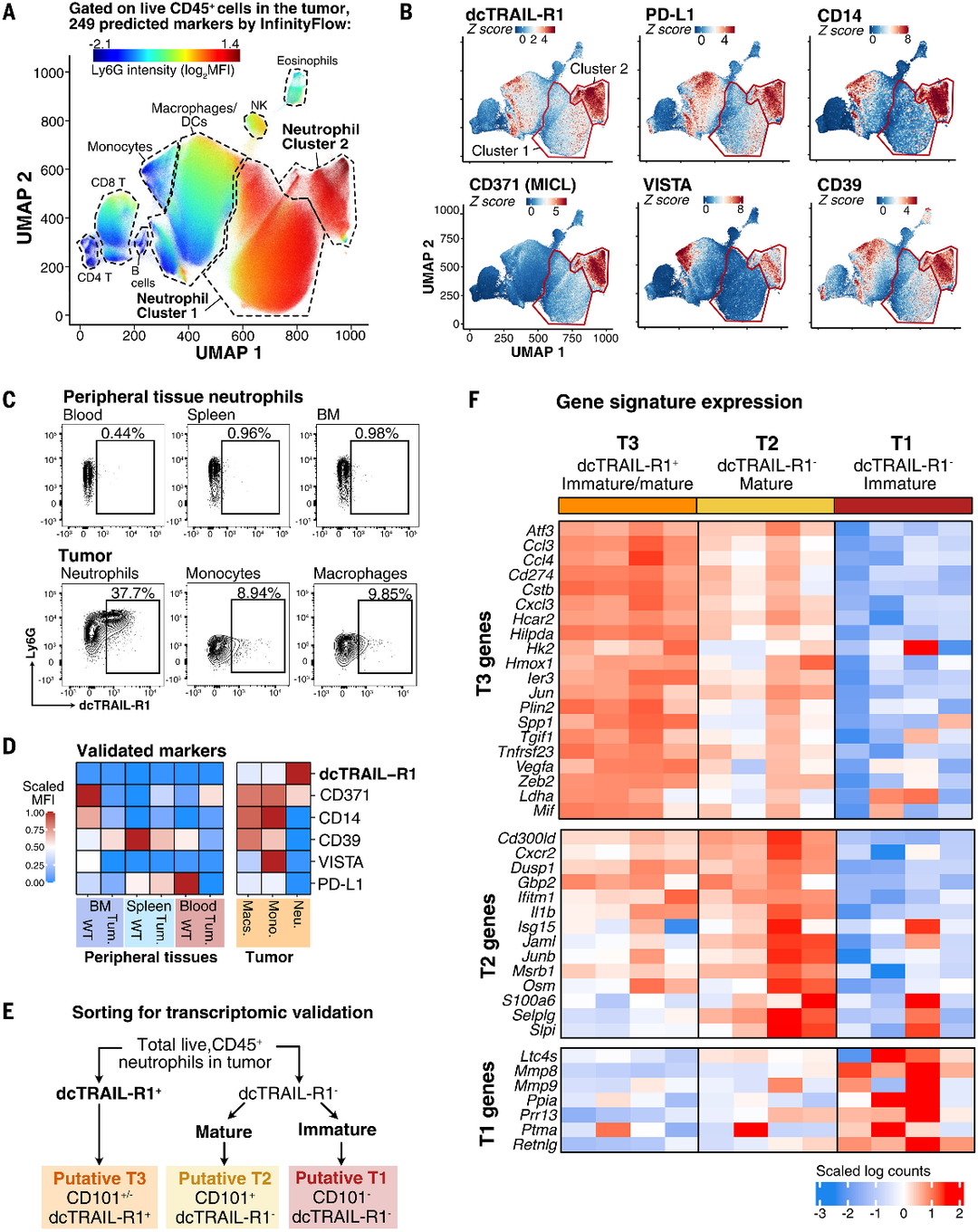
(A)PDAC肿瘤内活CD45免疫细胞的UMAP投影显示两个中性粒细胞簇。
(B)与簇1相比,中性粒细胞簇2的免疫抑制和/或免疫调节表面标志物的表达增加。显示了表面标记物(顺时针方向)的表面标志物表达强度:dcTRAIL-R1、PD-L1、CD14、CD371、VISTA和CD39。
(C)dcTRAIL-R1表达标记,并仅限于单独的肿瘤浸润性中性粒细胞群体。代表性轮廓流式细胞术图显示,对于指定的细胞群,肿瘤中dcTRAIL-R1表达与Ly6G表达相对立。
(D)热图显示了(B)中标记的缩放MFI,在所有总体中缩放在0和1之间,其中0表示最低的MFI。
(E)通过dcTRAIL-R1和CD101表达从肿瘤中分离出T1、T2和T3中性粒细胞的门控策略。
(F)分选的dcTRAIL-R1肿瘤中性粒细胞的T3转录特征表达最高。热图显示了T1(n=4)、T2(n=4)的缩放Nanostring基因计数(根据内部阳性对照和管家基因进行归一化)。和T3(n=4)中性粒细胞根据(D)进行排序。
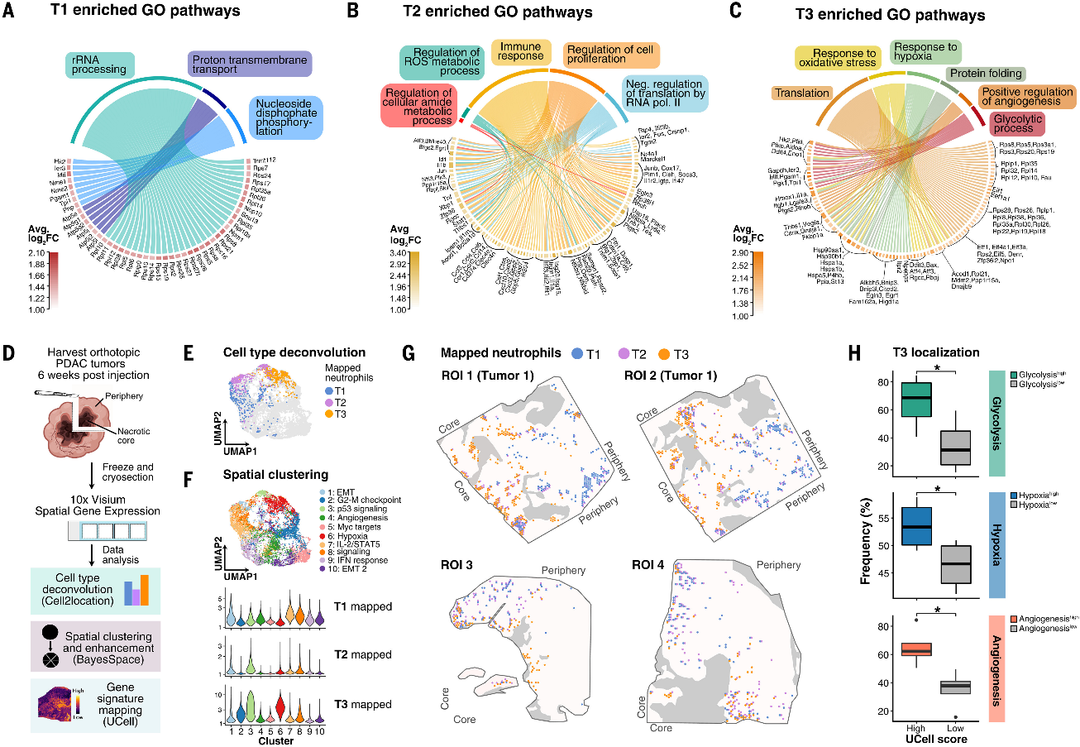
图3.胰腺肿瘤中T1、T2和T3中性粒细胞的空间区室化。
(A)T1中性粒细胞中差异表达基因(DEGs),这些基因富集了与转录和氧化磷酸化相关的GO通路。
(B)T2中性粒细胞中富含与代谢和免疫反应相关的GO通路的DEGs。
(C)T3中性粒细胞中富含与存活和血管生成相关的GO通路的DEGs。
(D)空间转录组分析工作流程。
(E)肿瘤中性粒细胞定位于不同的空间簇。
(F)根据贝叶斯空间识别的簇(顶部)分析肿瘤切片斑点的合并UMAP表示并进行颜色编码。小提琴图显示了映射到每个簇的T1、T2和T3中性粒细胞富集斑点的频率。
(G)通过Cell2location对肿瘤切片(n=4)的T1、T2和T3中性粒细胞进行空间映射。
(H)量化去卷曲的T3中性粒细胞富集点落入GO本体通路的高分点或低分点的百分比:糖酵解(GO:0061621)、缺氧(GO:001666)和血管生成(GO:0045766)。
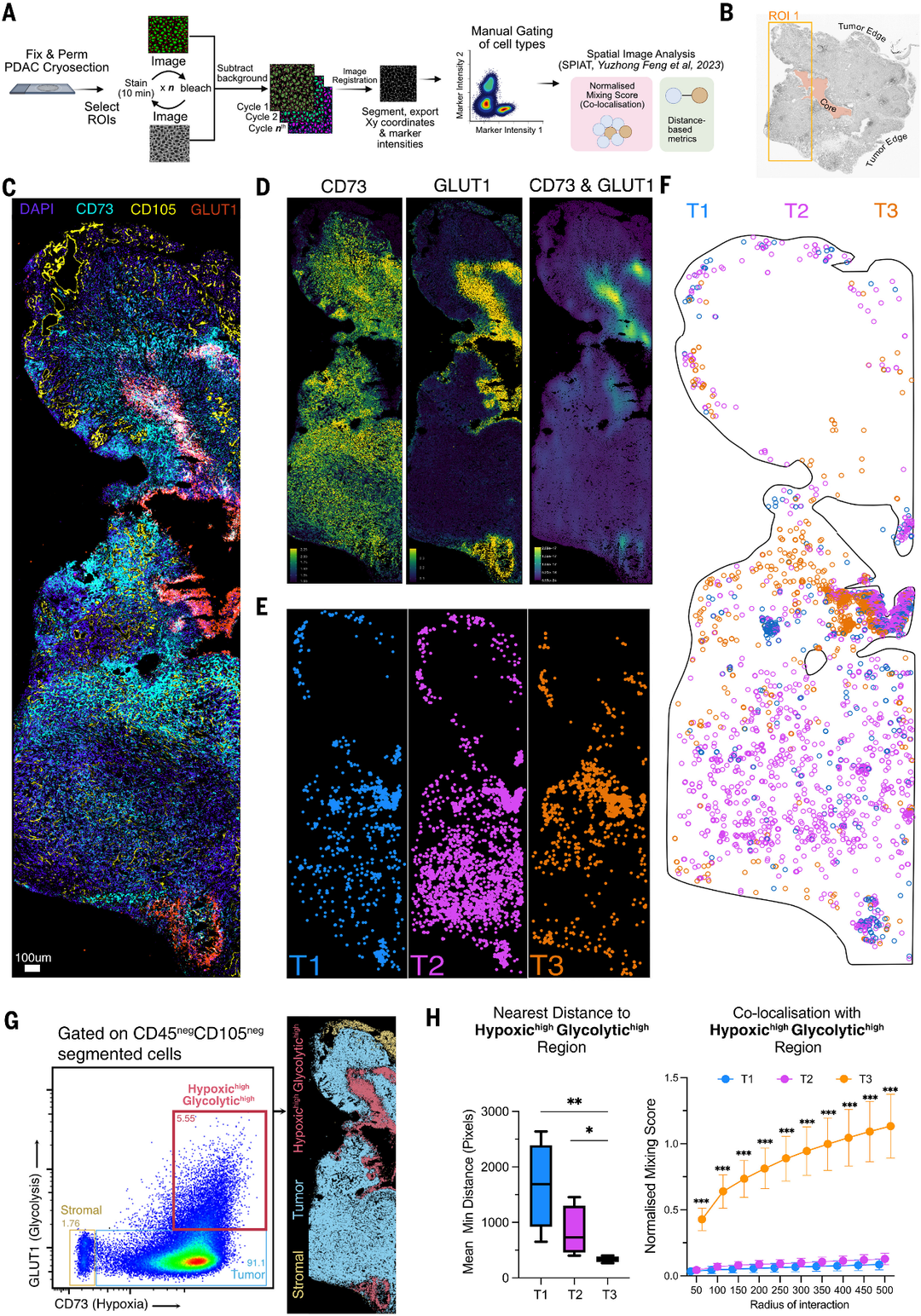
图4.T3中性粒细胞在胰腺肿瘤中占据缺氧糖酵解生态位。
(A)使用MICS技术进行多重成像的工作流程图。
(B)显示ROI1选择区域的肿瘤象形图。
(C)ROI1的免疫荧光图像,带有相应肿瘤区域的指示染色标记物。比例尺,100μm。
(D)左图,CD73和GLUT1的表达标志物强度图。右图为CD73和GLUT1标志物强度的共表达图。
(E)ROI1中每个带注释的肿瘤中性粒细胞亚群的空间映射。
(F)ROI1中性粒细胞亚群的共映射。
(G)左为CD73和GLUT1划定的CD45 - CD105肿瘤区域的门控策略。右,在ROI1分割数据上映射门控区域。(H)分节段肿瘤中性粒细胞的空间统计分析(n = 5个生物重复)。左图为每个分节中性粒细胞亚群到低氧高糖溶酶区域的平均最小距离。箱形图的中线表示中位数,箱形铰链表示第25和75百分位数,须状图延伸到最小值和最大值。经Mann-Whitney U检验,*P < 0.05, **P < 0.01。右图,肿瘤中性粒细胞与低氧高糖溶酶高区域的共定位,使用每个相互作用半径的标准化混合评分进行测量。点表示五个重复的平均值。误差条表示SEM。***经Mann-Whitney检验P < 0.001,使用两阶段上升(Benjamini, Krieger和Yekutieli)方法校正了多次比较,错误发现率(FDR)为1%。
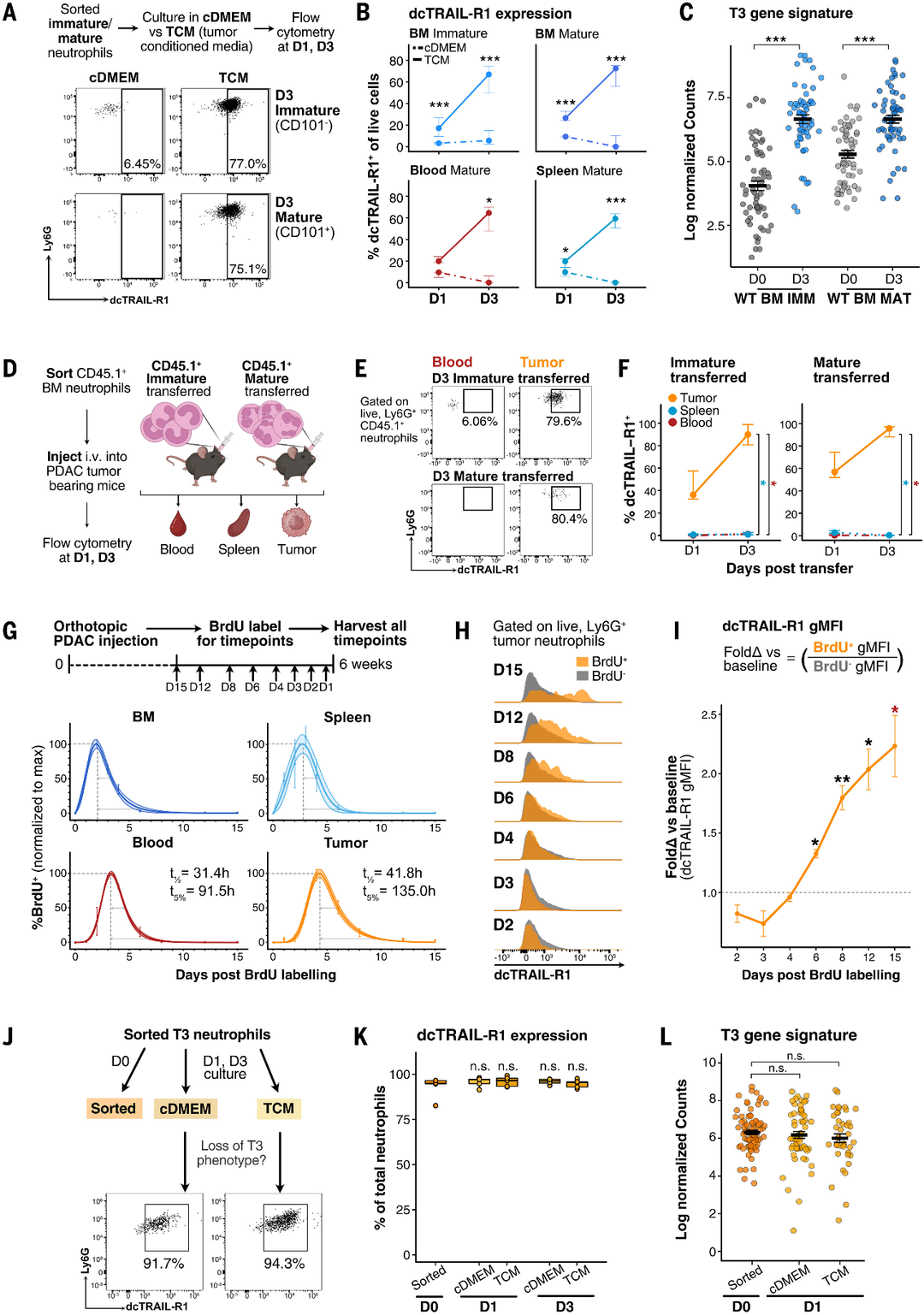
图5.肿瘤环境中的重编程导致长寿命的终末分化T3中性粒细胞。
(A)在cDMEM与TCM中对WT小鼠分选的中性粒细胞进行体外培养的实验设置。代表性流式细胞术图显示,在TCM中培养3天后,从BM中分选的未成熟和成熟WT中性粒细胞的dcTRAIL-R1表达增加,但在cDMEM中则不增加。
(B)TCM培养的中性粒细胞随时间推移上调dcTRAIL-R1。线图显示了(B)中门控的dcTRAIL-R1细胞的百分比,点表示中位数,误差线表示在cDMEM(虚线)和TCM(实线)中培养的中性粒细胞亚群在1天和3天内的Q1和Q3间期。
(C)TCM培养的中性粒细胞上调T3基因特征。
(D)将CD45.1中性粒细胞转移到胰腺荷瘤小鼠中的实验装置。将分选的WTBM未成熟和成熟中性粒细胞静脉注射到WTPDAC荷瘤小鼠中。在转移后1天和3天,通过流式细胞术评估血液、脾脏和肿瘤内CD45.1中性粒细胞的dcTRAIL-R1表达。
(E)dcTRAIL-R1表达的上调仅限于肿瘤。代表性流图显示转移后3天血液或肿瘤中存在的转移CD45.1未成熟和成熟中性粒细胞上存在的dcTRAIL-R1表达。
(F)线形图显示了在两个独立实验中表达dcTRAIL-R1的WT BM CD45.1未成熟或成熟中性粒细胞的比例。
(G)BrdU脉冲标记荷瘤小鼠实验装置。WT小鼠原位注射PDAC细胞,肿瘤生长。
(H)随着时间的推移,BrdU标记的中性粒细胞上调dcTRAIL-R1。(I) (H)中gMFI的定量。
(J) PDAC小鼠T3中性粒细胞在cDMEM或TCM中体外培养1或3天的实验设置。
(K)箱形图显示了(I)中dcTRAIL-R1中性粒细胞的定量频率。
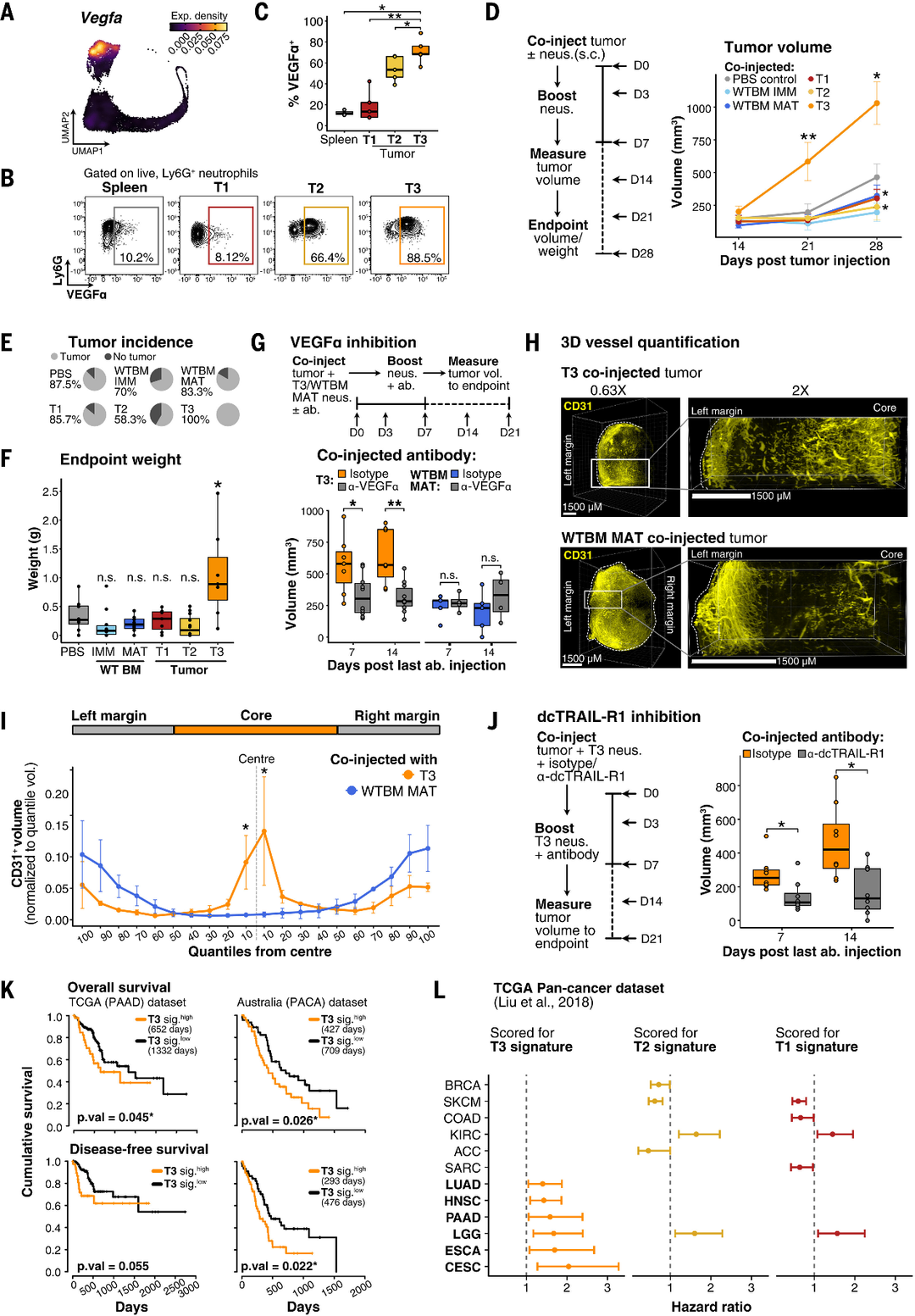
图6.前肿瘤T3中性粒细胞促进肿瘤生长,并与较差的患者预后相关。
(A)T3中性粒细胞的Vegfa转录本表达最高。BM、脾脏、血液和肿瘤中总中性粒细胞的UMAP投影显示Vegba的表达密度。
(B)T3中性粒细胞的VEGFα表达最高。
(C)箱线图量化VEGFα表达,如(B)所示。
(D)T3中性粒细胞促进肿瘤快速生长。
(E)中性粒细胞共注射后PDAC皮下肿瘤发生率的量化。饼图显示了在第28天终点出现肿瘤(浅灰色)或无肿瘤生长(深灰色)的小鼠的频率(D)。
(F)与其他条件相比,与T3中性粒细胞共同注射的肿瘤具有最大的权重。
(G)VEGFα的抗体中和可降低T3介导的肿瘤生长加速。
(H)T3和WTBMMAT共同注射皮下肿瘤内CD31血管的可视化。
(I)与T3中性粒细胞联合注射的皮下PDAC肿瘤在肿瘤核心内具有更大的CD31血管密度。
(J)抗体介导的T3中性粒细胞阻断降低了其促进肿瘤快速生长的能力。
(K)T3中性粒细胞基因特征与胰腺癌患者较差的OS和DFS相关。
(L)T3中性粒细胞基因特征与人类实体癌亚群中较差的患者OS相关。
更多科研思路,请持续关注......
 技术咨询:
技术咨询: