利用单细胞、空间和原位综合分析法绘制肿瘤微环境高分辨率地图
2024-01-31

乳腺癌是全球范围内女性最常见的癌症,仅2020年一年就新增大约230万例;癌症作为人类的头号杀手,发病率正逐年上升,在发展中国家,这一趋势尤其明显。我们如何利用单细胞、空间和原位综合技术来应对这一挑战,关键就在于这些技术能否从石蜡包埋(FFPE)的癌症组织中获取高质量的数据。临床上,用以保存样品的石蜡包埋方法已经非常成熟,因为这种方法可以保持样品高度的形态细节,因此,生物样本库中有大量的 FFPE 标本可用于基因组学研究。利用RNA模板化连接(RNA templated ligation)(RTL)技术和精心设计的探针组,我们能够克服样品保存所使用的福尔马林导致的链裂解和交联障——这些问题几十年来一直困扰着研究人员。
单细胞基因组学的高通量方法使得根据全转录组基因表达和细胞表面蛋白数据将单次实验中的数千至数百万个细胞聚类为不同类型成为可能,同时,空间转录组学的进步为组织切片引入了具有空间背景的无偏见基因表达分析,将基因组学、成像和组织病理学结合起来,这些技术是相辅相成的——单细胞方法缺乏空间背景,而空间方法则需要与单细胞数据整合才能推断出细胞类型组成的详细信息。
文献:High resolution mapping of the tumor microenvironment using integrated single-cell, spatial and in situ analysis. Nat Commun. 2023 Dec 19;14(1):8353. doi: 10.1038/s41467-023-43458-x. PMID: 38114474; PMCID: PMC10730913.
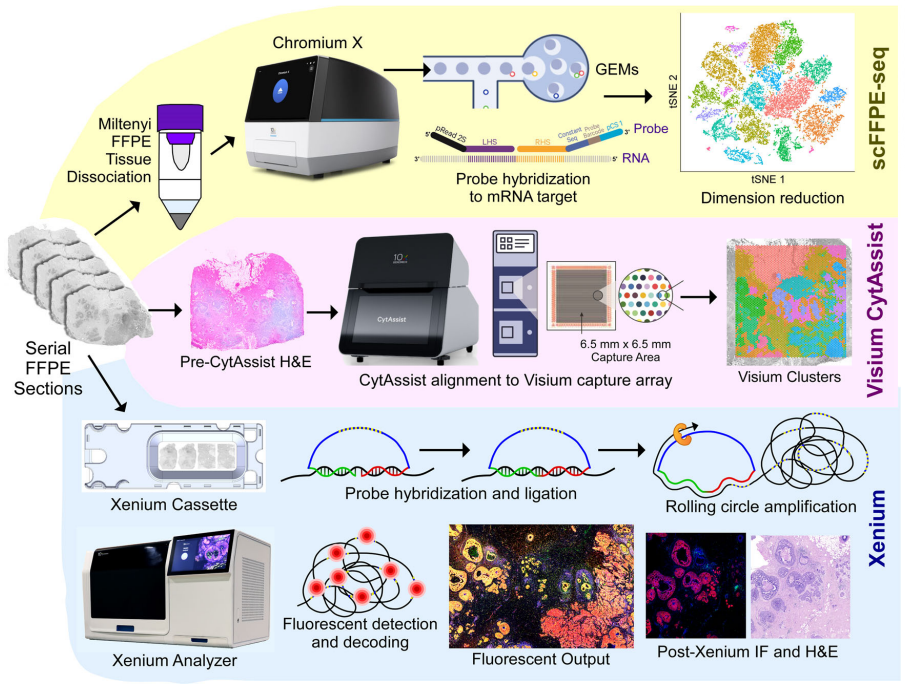
上方: The Chromium Single Cell Gene Expression Flex工作流程与 Miltenyi FFPE Tissue Dissociation protocol (scFFPE-seq)相结合(单细胞测序);
中部: The Visium CytAssist 进行具有空间背景的全转录组分析,并可与来自连续相邻 FFPE 组织切片的单细胞数据轻松整合;
下部:The Xenium In Situ technology 获得显微荧光结果。
结果1: 利用全转录组单细胞和空间技术对保存在 FFPE 中的乳腺癌样本进行表征,揭示了复杂的肿瘤和肌上皮异质性。

a. 对 scFFPE-seq 数据进行降维处理后,产生了 17 个无监督聚类。每个点代表一个细胞,颜色/标签表示注释的细胞类型。巨噬细胞 M1 聚类由 LYZ、IFI30 和 ITGAX 标识。巨噬细胞 M2 聚类由 SELENOP、F13A1 和 RNASE1 标识;
b. Visium 结果的降维投影也确定了 17 个群集,根据差异基因表达分析,可标识出10个明确归类的细胞类型,其他群组则是多种细胞类型的混合物;
c. 对b图的细胞集群分别进行空间转录组分析以及整体的HE染色。
结果2:Xenium 数据提供了极高分辨率的单细胞信息,并对目标基因进行了空间定位。
a. 5μm FFPE切片中 RNA 荧光信号的最大强度投影(共15组重复,其为第一组结果);
b. 显示了代表主要细胞类型的部分基因:基质(POSTN,黄色)、淋巴细胞(IL7R,蓝色)、巨噬细胞(ITGAX,绿松石色)、肌上皮细胞(ACTA2、KRT15,绿色)、内皮细胞(VWF,深蓝色)、DCIS(CEACAM6,粉红色)和浸润性肿瘤(FASN,红色);
c. Xenium分析后对组织的HE染色,显示Xenium分析对组织的破坏极其轻微;
d. 基于深度学习将单个转录本分配给分割好的单个细胞;
e. 显示每个细胞转录本分布的直方图(Q ≥ 20);
f. 整个切片中的每个细胞的转录本取log10后的结果;
g. scFFPE-seq方法从每个细胞中检测到的基因数量;
h. Xenium方法从每个细胞中检测到的基因数量;
i. 使用全部 17 696 个基因(左图)对scFFPE-seq数据进行降维投影,然后筛选出 313 个基因(右图);
j. 用scFFPE-seq数据监督标签注释的 Xenium 细胞的降维投影;
k. Xenium 数据中不同细胞类型基因相对表达的热图。
结果3:整合scFFPE-seq和Xenium数据,解读乳腺导管癌(DCIS)亚型和浸润性肿瘤区域之间细胞类型组成和分子标记物的差异。
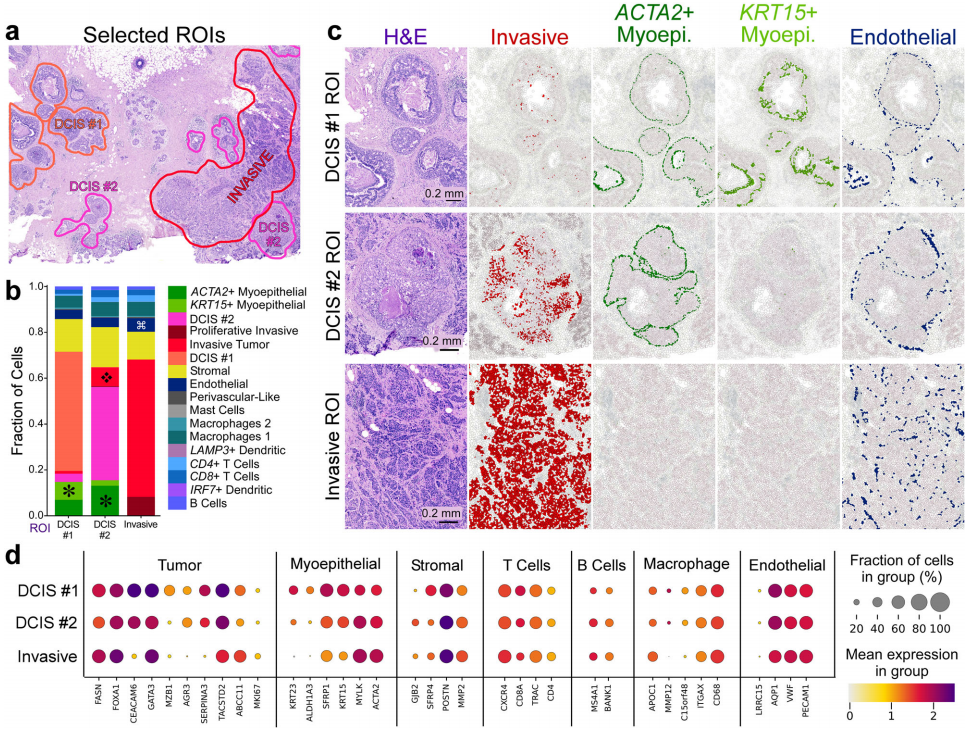
a. 结合组织学、病理学及scFFPE-seq的数据,我们选择了三个感兴趣的区域(ROI)分别为DCIS #1、DCIS #2和浸润性肿瘤细胞区域,以及它们附近的所有其他细胞;
b. 我们确定了这些感兴趣的区域(ROI)中 17 种细胞类型的比例;
c. ROI中不同细胞类型的显微验证;
d. 点阵图显示细胞类型的典型标记以及肿瘤亚型之间的差异表达基因。
结果4:整合Visium和Xenium的数据揭示三阳性受体区域中的基因的差异表达情况。
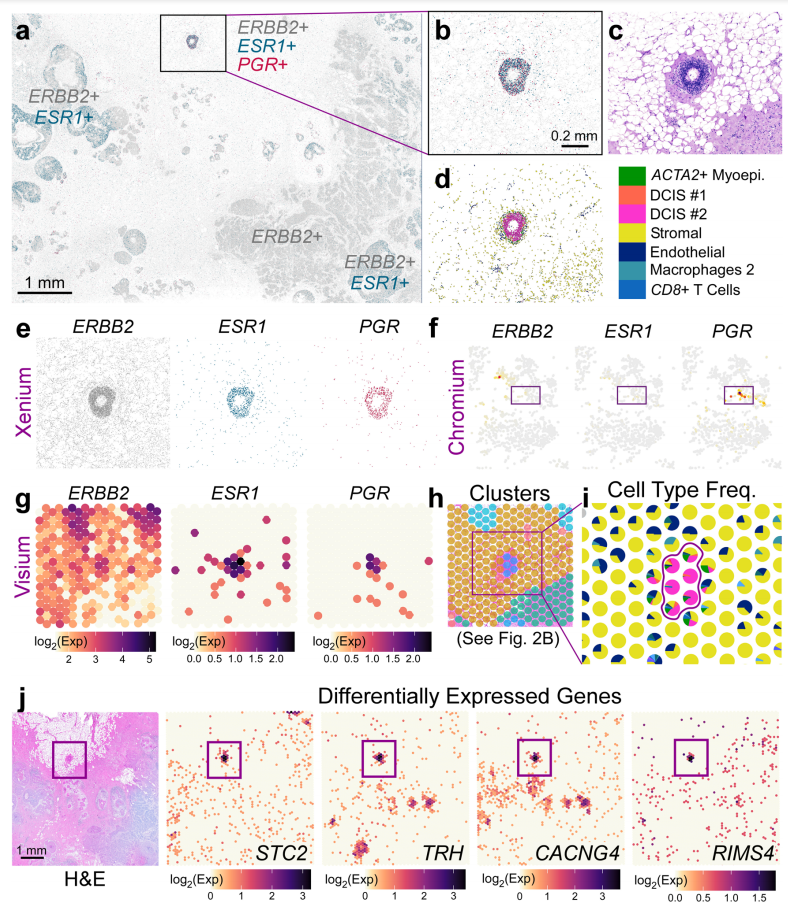
d. ROI中的细胞类型显示三阳性受体区域是 DCIS #2 肿瘤上皮组织;
e. 三阳性受体区域的单个Xenium空间图;
f. scFFPE-seq数据中只定位到约30个PGR阳性的细胞,没有表达ERBB2和ESR1的细胞;
g. 在Visium中确定三阳性区域(根据 Xenium 的先验知识确定);
h. 部分细胞类型的结果;
i. 点内插法可提供每个Visium点内的细胞类型频率;
j. HE染色Visium数据在转录组中揭示肿瘤上皮细胞中四个具有代表性的差异表达基因。
结果5:边界细胞(一种罕见细胞类型)的基因表达图谱。
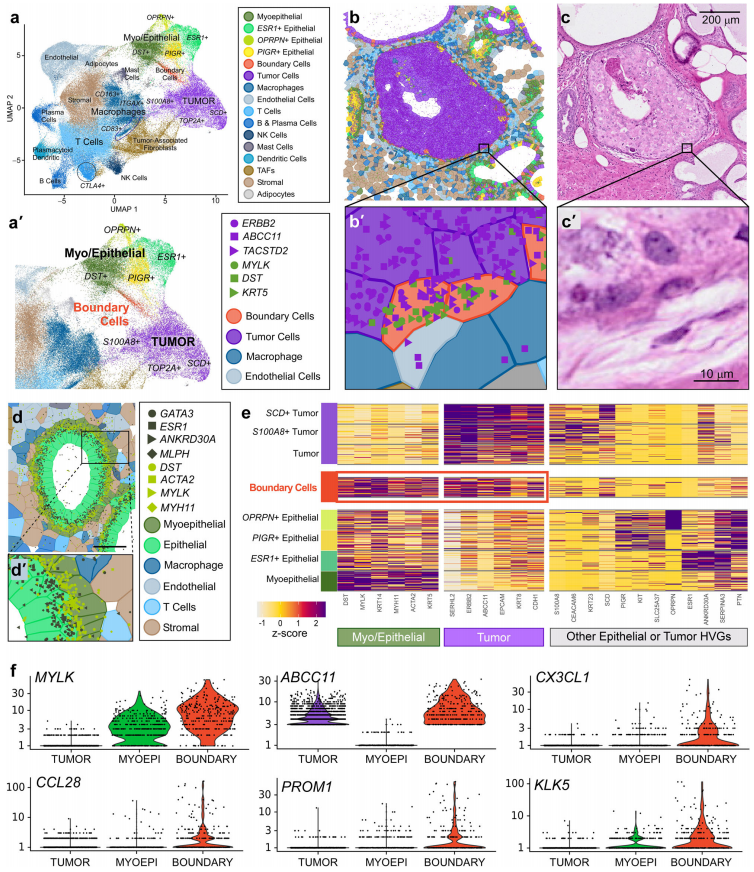
a. Xenium 对浸润性导管癌的不同生物切片(样本 #2)的UMAP算法降维投影;
b. 样本中的肿瘤细胞(紫色)和肌上皮细胞(绿色);
c. 样本中的肿瘤细胞和肌上皮细胞的HE染色结果;
d. 每种细胞类型的转录本:肌上皮细胞(深绿色)和上皮细胞(浅绿色)的混合程度最小;
e. 对于选定特征的相对表达量的热图;
f. 边界细胞的基因表达谱。
对复杂组织的高分辨率原位分析提供了一个前所未有的研究角度,将彻底改变我们对生物学的理解。随着研究这些生物学问题的工具的不断发展,我们将更深入地了解分子特征与组织结构的关系,以及细胞如何在局部组织环境中与其他细胞和非细胞成分相互作用。我们的研究结果表明,通过结合互补技术,可以获得最高分辨率和最丰富的生物信息。虽然每种技术都能独立阐明来自 FFPE 组织的高质量基因表达数据,但与单独使用一种技术相比,整合这些数据才能更严谨、更精细地阐明生物学。我们所描述的这些技术的分辨率和广度对整个生物科学,特别是对未来的转化和临床研究,以及最终对促进人类健康都具有深远的影响。
 技术咨询:
技术咨询: