泛肿瘤单细胞和空间转录组学的整合揭示了肿瘤微环境中基质细胞的特征和治疗靶点
2024-02-21
1.前言
肿瘤微环境(TME)由一个复杂的生态系统组成,包括免疫细胞、非免疫基质细胞、分子成分(如细胞因子、细胞外基质(ECM))以及癌细胞。它为癌细胞提供了一个生态位,以增强肿瘤血管生成、增殖、侵袭、转移和治疗耐药性。此外,新出现的证据表明,与肿瘤相关的非免疫基质细胞也是构成TME的关键因素,它们通过提供生长因子、促进血管生成和抑制免疫反应促进肿瘤的发展。鉴于这些证据,新的治疗靶点正在以非免疫基质细胞为基础开发。非免疫基质细胞的组成在不同肿瘤类型之间存在显著差异,主要包括成纤维细胞、内皮细胞(EC)、壁细胞(MC)、间皮细胞和胶质细胞。内皮细胞形成血管壁的周围层,是关键的TME成分,它们参与过度的血管生成,以满足肿瘤对营养和氧气的代谢需求,从而加速癌细胞的迁移、侵袭和转移,而血管的存在也允许更好的药物输送和具有抗肿瘤免疫的免疫细胞的输送。MCs,包括平滑肌细胞(SMC)和周细胞(PC),通常围绕在ECs的血管层周围,具有高可塑性,可响应血管活性刺激并调节血管稳定性、通透性和微循环中的血流。
在这项研究中,作者将来自16种人类癌症类型的258名患者的非免疫基质细胞与单细胞转录组学相结合,并将来自7种癌症类型的16名患者的非免疫基质细胞与空间转录组学(ST)相结合,以描绘肿瘤相关的基质细胞图谱,并表征非免疫基质细胞亚群在不同癌症类型中的分化途径、多样性和功能作用。作者发现肿瘤相关的PGF+内皮细胞在各种EC亚群中表现出最差的存活率,并且与免疫丢失的TME类型的上皮-间质转化(EMT)相关。同时,两种不同的肿瘤相关PCs (TPC),即纤维性和血管性PCs,也被发现在免疫丢失的TME中富集,并与PGF+ tip表现出强烈的相关性,导致过度的ECM沉积和血管功能障碍,从而促进肿瘤进展。此外,成纤维细胞亚群的空间分布表明,ECM-CAFs在肿瘤边界周围富集,形成屏障结构,限制了免疫治疗的效果。总之,作者绘制的肿瘤相关非免疫基质细胞综合概略为理解TME复杂性提供了前所未有的资源,并且它可以潜在地指导多种人类癌症类型基质靶向治疗的发展。
文章信息:Integration of Pan-Cancer Single-Cell and Spatial Transcriptomics Reveals Stromal Cell Features and Therapeutic Targets in Tumor Microenvironment. DOI: 10.1158/0008-5472.CAN-23-1418.Cancer Res 2024;84:192–210.
2.结果
结果1:单细胞分辨率下的泛癌基质细胞谱
为了建立人类间质细胞的单细胞转录组图谱,作者从公共数据集中收集了306例原发肿瘤患者和122例癌旁组织,涵盖16种癌症类型(图1A)。作者进行了严格的质量控制,收集了来自13种癌症类型的癌旁组织来源的75329个基质细胞,以及来自16种癌症类型的肿瘤来源的139643个基质细胞(图1B)。然后将基质细胞分为六种常见的主要类型(图1C和D),包括表达COL1A1、DCN和LUM的成纤维细胞(n=79,862);表达PECAM1、PLVAP和CLDN5的ECs (n=87,706);表达RGS5、ACTA2和PDGFRB的MCs (n=41,976);表达KRT19、MSLN和CALB2的间皮细胞(n=1,247);表达STMN1、TOP2A和MKI67的增殖基质细胞 (n=2,601);以及表达GPM6B、S100B和CDH19的胶质细胞(n=1,580)。虽然所有16种癌症类型中都存在成纤维细胞、内皮细胞和MCs,但这些主要细胞类型在癌症之间或癌旁组织和肿瘤组织之间的浸润是不同的,这反映了TME中基质细胞的不同细胞组成(图1 E和F)。
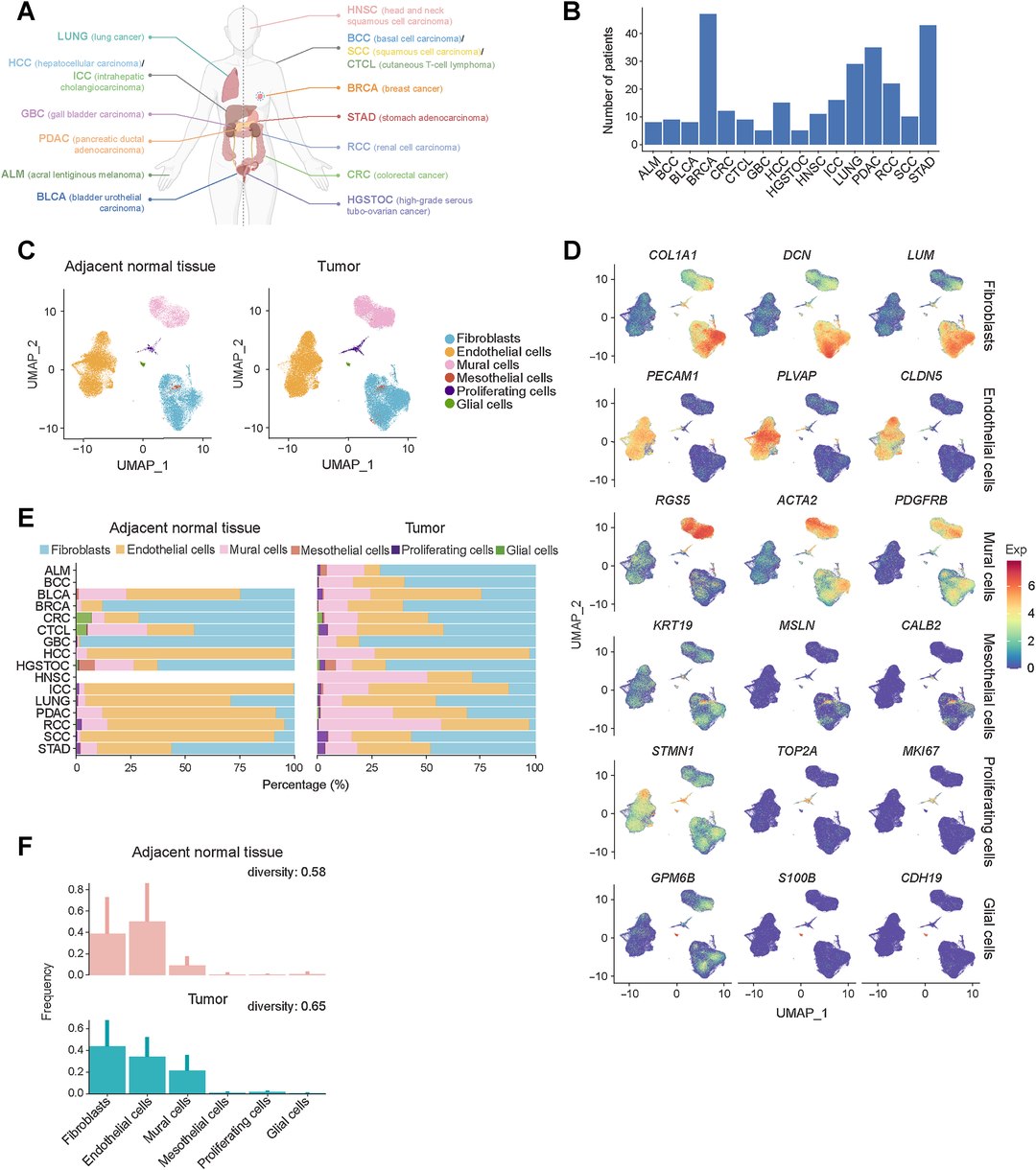
结果2:具有EMT特征的PGF+ tips在免疫缺陷的TME中富集
作者基于Harmony和RPCA对批次效应进行了校正,以获得一致的结果,并对16种癌症类型的392个样本的ECs图谱进行了分析,然后根据相应的差异基因表达将ECs分为11个亚群(图2A-C)。为了测量EC亚群在癌旁组织和肿瘤组织中的作用,作者进行了卡方检验,比较了每个簇中观察到的和预期的细胞数量(RO/E),并鉴定出RO/E值最高的PGF+ tips(图2D)。通过比较癌旁组织和肿瘤组织之间PGF+ tips浸润的百分比验证结果(图2E)。作者进一步发现,通过使用TCGA队列中的全RNA转录组数据,通过单细胞PGF+ tips细胞中特异性表达的前20个基因计算的PGF+ tips浸润较高的患者与多种癌症类型的预后较差相关(图2F),提示PGF+ tips的原瘤功能。此外,功能富集分析证实,PGF+ tips参与了包括血管生成、细胞迁移、EMT和细胞-基质粘附在内的肿瘤途径(图2G)。此外,作者构建了一个反映癌细胞侵袭和转移能力的EMT评分程序,发现在全RNA转录组的TCGA队列中,PGF+ tips的富集与EMT评分显著相关(图2H)。作者分别对PDAC和结直肠癌中的这两种细胞类型进行了NicheNet分析,发现顶部的前20位配体(图2I)。此外,作者对尖端-肿瘤细胞相互作用轴上的靶基因进行了功能注释,发现它们与VEGFA-VEGFR2信号、缺氧相关功能以及细胞迁移的正向调控相关(图2J)。
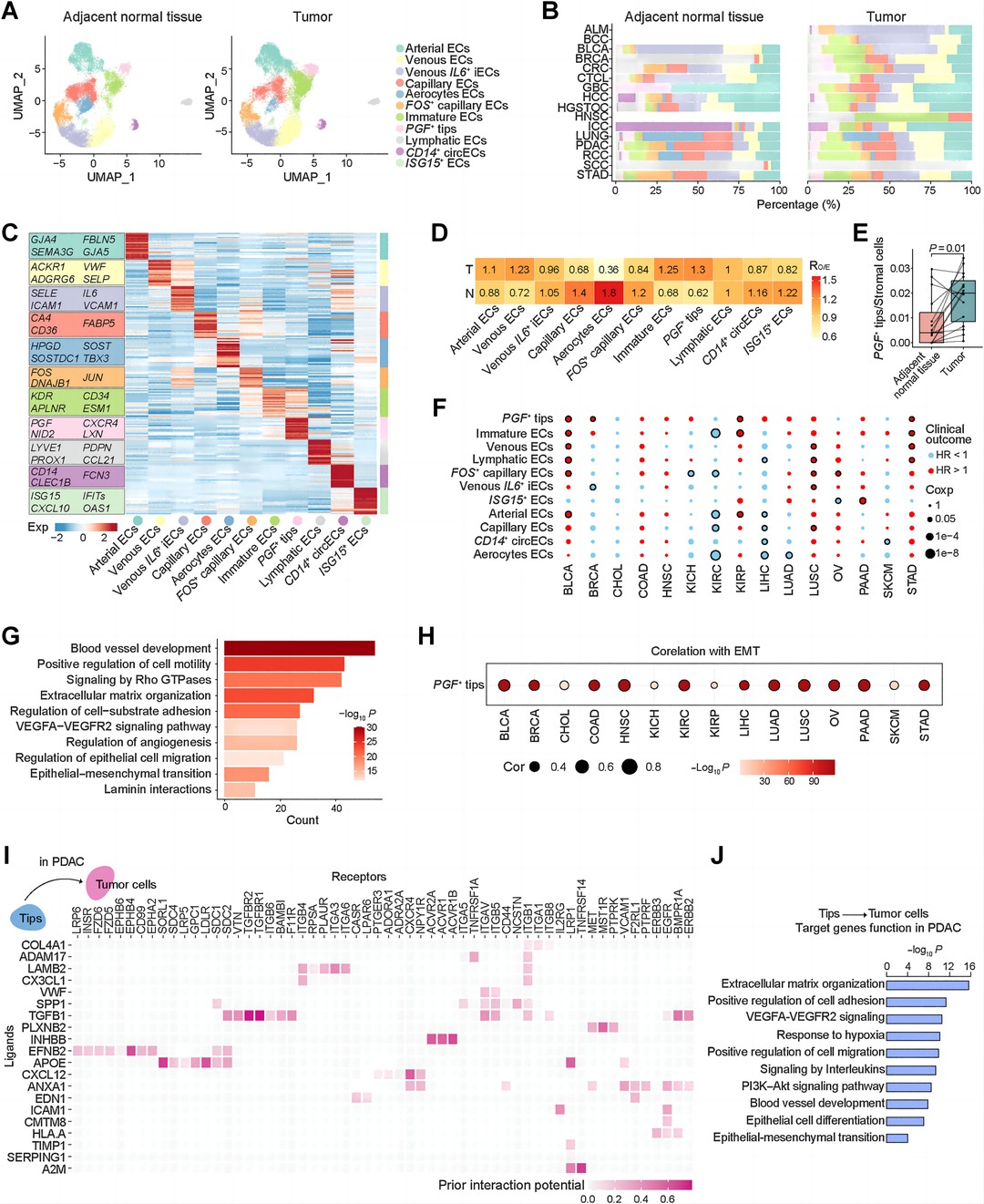
作者证明PGF+ tips在六种癌症类型的D TME亚型中显著富集,这表明PGF+ tips在免疫耗竭中具有重要的功能作用(图3A)。在所有六种癌症类型中,与PGF+ tips水平较低的患者相比,PGF+ tips水平高的患者的淋巴细胞浸润都明显较低(图3B)。作者发现具有PGF+ tips的多种肿瘤紧密地包围肿瘤区域,而很少有CD8细胞浸润肿瘤(图3C)。作者采用结直肠癌冷冻切片进行ECs基因标记(CD31, ESM1)、肿瘤细胞标记(EPCAM)和CD8的多重ISH(图3D),发现PGF+ tips紧密环绕肿瘤区域,不同于仅有的CD31阳性细胞,而很少有CD8细胞浸润肿瘤。作者还采用PDAC的冷冻切片进行ECs基因标记(CD31和ESM1)和CD8的多重co-IF(图3E),发现PGF+ tips与CD8+细胞浸润呈负相关。
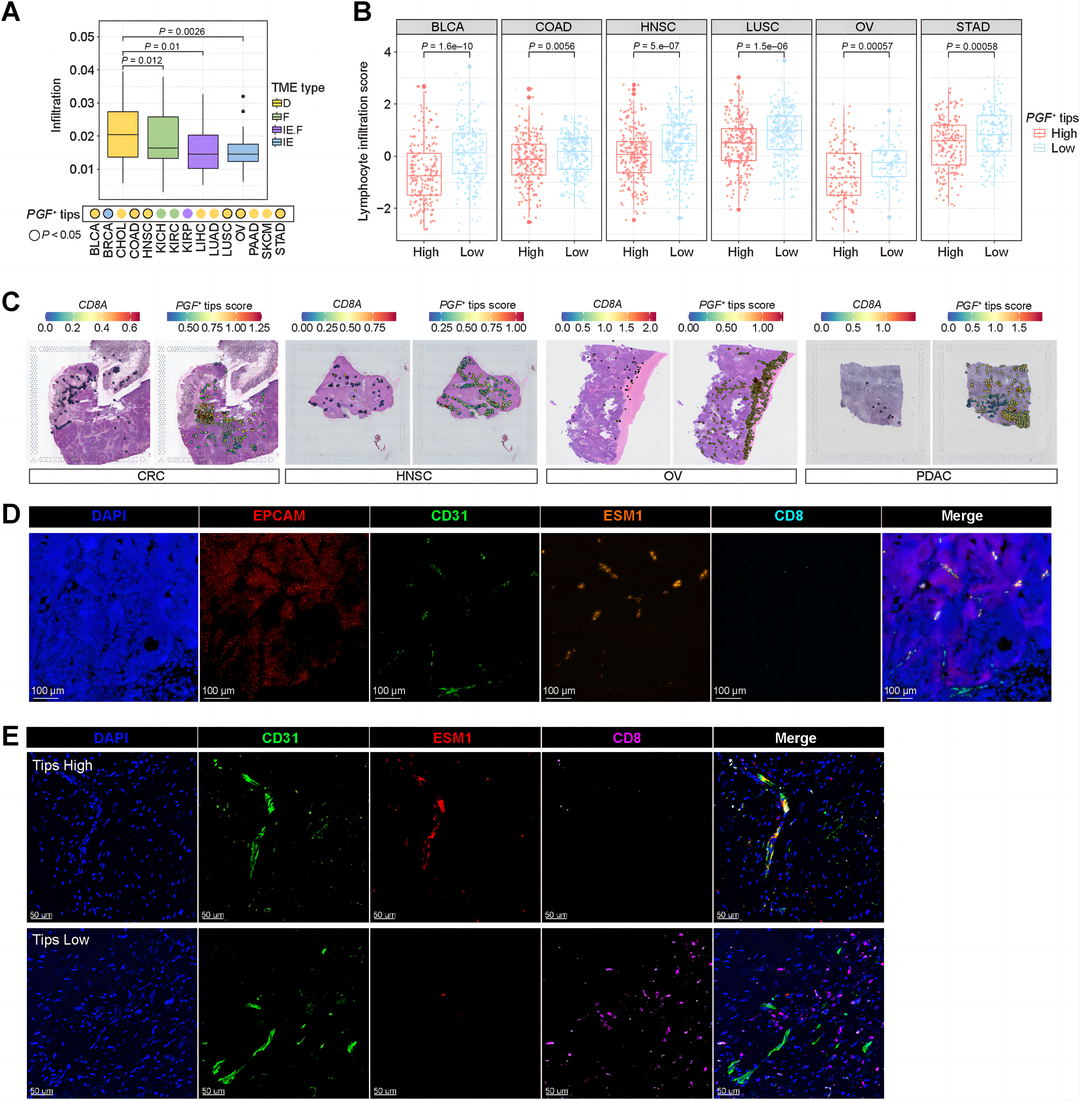
结果3:肿瘤相关的纤维化和血管PCs与PGF+ tips相互作用促进肿瘤进展
以前的单细胞数据并没有完全解决PC的异质性,作者通过成纤维标记基因区分PC,RGS5、CSPG4、NDUFA4L2和KCNJ8只存在于PCs中,ACTA2和PDGFRB在成纤维细胞中少量富集,PDGFRA和PDPN只表达于成纤维细胞,并基于其各自的标记进行基于图的聚类将PCs分为9个子集(图4A-C)。5个PC亚群在癌旁组织和肿瘤组织中显示出较高的的丰度度,称为panPCs,包括表达ERGs的ATF+ PCs,具有较高的细胞因子(如CCL19,CCL12和CXCL12)表达的CCL19+ PCs,表达脂质代谢基因(如FABP4、CD36、FABP5、LPL)的FABP4+ PCs,高表达SERPINE1,IGFBP2和BMP2的SERPINE1+ PCs,其与细胞粘附和肌肉结构构建相关,表达HTRA3、SPON2和THY1的HTRA3+ PC,其参与基质相互作用和轴突引导(图4C-E)。其余四种PC亚群被称为TPCs,与癌旁组织相比,它们在肿瘤组织中显著富集,包括纤维原性PCs、ECM-PCs、血管PCs和ISG15+ PCs。此外,作者使用Monocle3和Slingshot工具箱构建了分化轨迹,并观察到FABP4+ 祖细胞panPCs通过ECM-TPCs分化为纤维性或血管性TPCs的两条不同分支路径,突出了这两种TPCs的不同分化特征(图4G)。在这里,我们揭示纤维性和血管性TPCs与PGF+ tip一致,在D TME亚型中都显著富集(图4H)。此外,细胞与细胞的互作分析发现,纤维和血管TPCs与PGF+ tip强烈互作,并有最高的互作权重(图4I)。PGF+ tip通过层粘连蛋白/胶原- ITGA /ITGB相互作用与纤维化和血管TPC相互作用,这些TPC可能与过度ECM丰度相关,并通过VEGFA-VEGFRs和WNT5A-MCAM与血管TPC特异性相互作用(图4J),表明TPC和PGF+ tip共同作用,促进肿瘤进展。
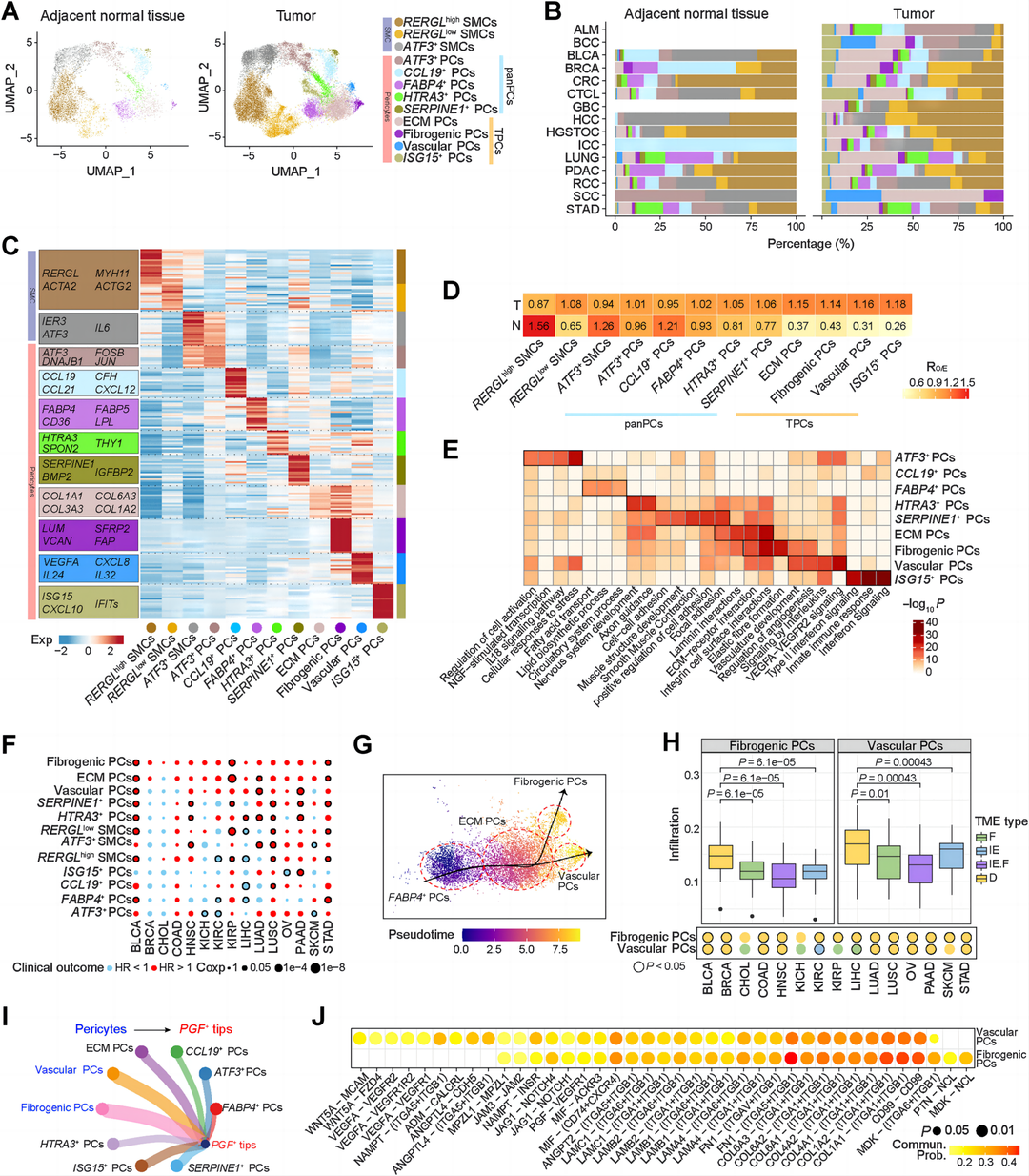
结果4:不同癌症类型中成纤维细胞亚群的不同功能模块
在校正了16种癌症类型(PC和ECs)的单细胞批量效应后,作者探索了不同癌症类型的成纤维细胞特征,并根据它们的差异基因表达确定了14个成纤维细胞亚群(图5A-D)。这14个成纤维细胞亚群可分为5个模块特征,包括泛组织成纤维细胞(PanFib)、组织特异性常驻成纤维细胞(TrsFib)、肌成纤维细胞(myoFib)、免疫相关成纤维细胞(ImmFib)和ECM-相关CAFs (ECM-CAFs)。所有泛组织成纤维细胞亚群均存在于所有癌旁组织中,RO/E值证实,根据其组织富集度评分,泛组织成纤维细胞亚群在肿瘤组织中逐渐减少(图5E)。热图显示了本研究中人类成纤维细胞亚群和Buechler及其同事的小鼠成纤维细胞亚群之间的Pearson相关性(图5F)。然后,作者构建了成纤维细胞状态轨迹,结果表明ECM-CAFs从PanFib分化而来,并位于分化末端,而TrsFibs最初位于癌旁中,并在另一个分支的末端分化(图5G)。LAMP5+ CAFs、SFRP4+ CAFs、COL11A1+ CAFs和CA12+ CAFs是分别与调控运动/EMT、酶联受体蛋白、平滑肌构建/胶原代谢过程和酵解代谢/缺氧相关通路关联(图5H)。尽管CA12+ CAFs在大多数癌症中所占的百分比相对较低,但它们在多种癌症(包括BLCA、HNSC、KICH、KIRP、LIHC、LUSC和PAAD)中显示出与不良预后的最大关联(图5B和I)。
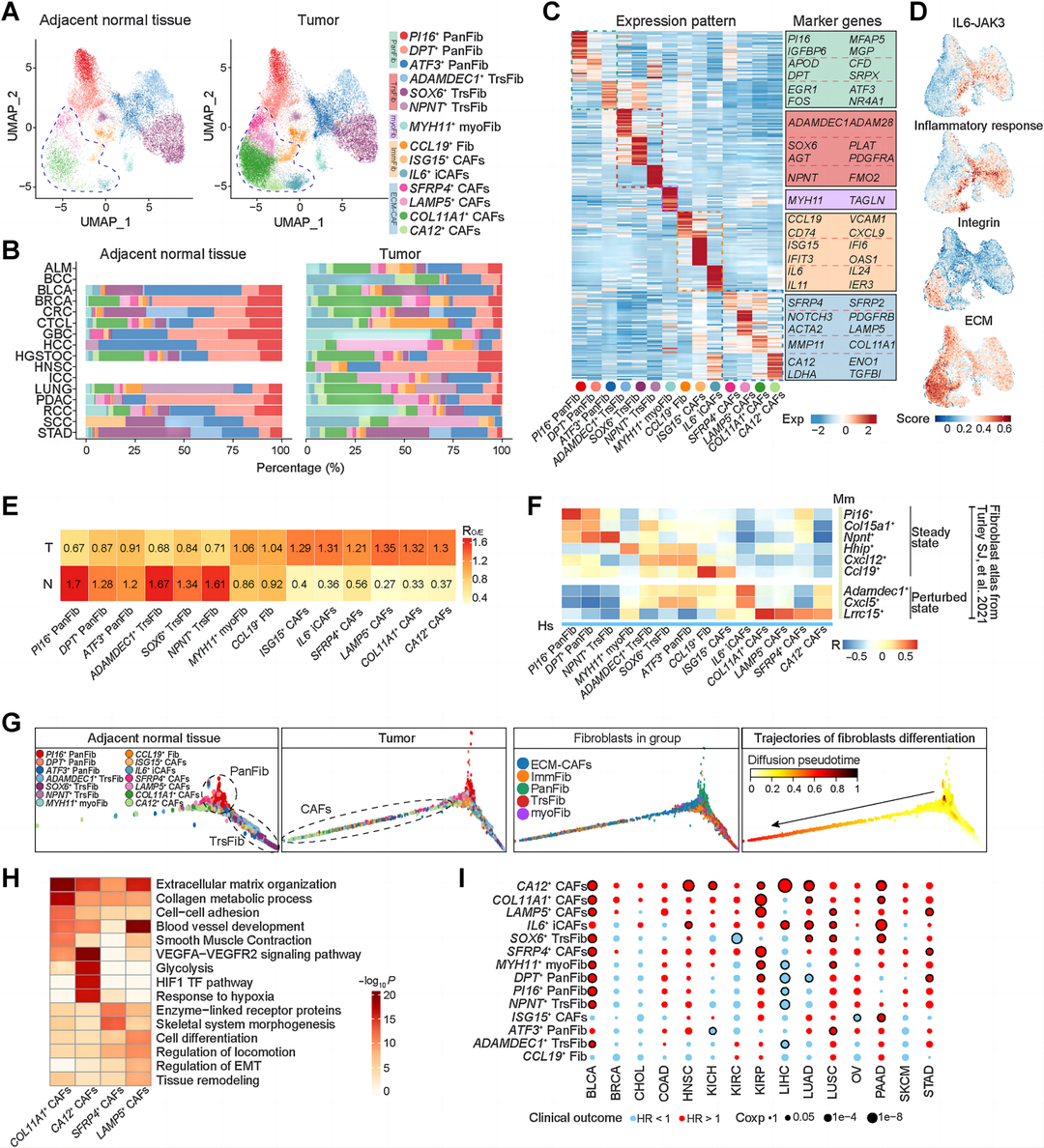
结果5:肿瘤边界空间富集的ECM-CAFs与恶性细胞相互作用促进肿瘤进展
作者基于成纤维细胞亚群的scRNA-seq依赖的特征基因进行了模块评分分析,以注释集群,包括ECM-CAFs、IL6+ iCAFs、MYH11+ myoFib、CCL19+ 成纤维细胞、panFib和ADAMDEC1+ TrsFib(图6A和B)。为了探索成纤维细胞亚群的空间位置,作者区分了结直肠癌ST切片的恶性区域、肿瘤边界和非恶性区域,并使用苏木精和伊红染色确定成纤维细胞,确定ECM-CAFs通常包围或浸润恶性区域,而ADAMDEC1+ TrsFib位于正常上皮内,其他成纤维细胞亚群均位于非恶性间质区域(图6C和D)。为了排除ECM-CAFs在特定肿瘤类型中的空间分布偏倚,作者使用了更多来自BRCA、PDAC、HCC和RCC的ST切片,并证实ECM-CAFs位于周围或浸润恶性区域(图6E)。为了证实这一点,作者进一步量化了成纤维细胞亚群在不同空间区域的分布。一个点通常可以容纳10个细胞,作者探索了含有成纤维细胞点的细胞组成,发现ECM-CAFs和恶性细胞占据相同的空间,而与其他成纤维细胞亚群的点不能与恶性细胞共定位(图6F和G)。肿瘤边界是连接恶性和非恶性细胞的桥梁。作者证实ECM-CAFs在边界生态位与恶性细胞的相互作用最强(图6H)。为了探索ECM-CAFs恶性细胞的下游功能,作者进行了NicheNet分析,揭示配体高度活跃的前20个基因(图6I)。这些配体基因与恶性细胞上的受体基因相互作用,导致靶基因的表达,如肿瘤相关蛋白ANXA2,在各种类型的肿瘤中促进肿瘤进展,如增殖、侵袭和转移。这些靶基因也是肿瘤进展相关通路的重要组成部分,如ECM相关通路、DNA复制和缺氧相关通路(图6J)。
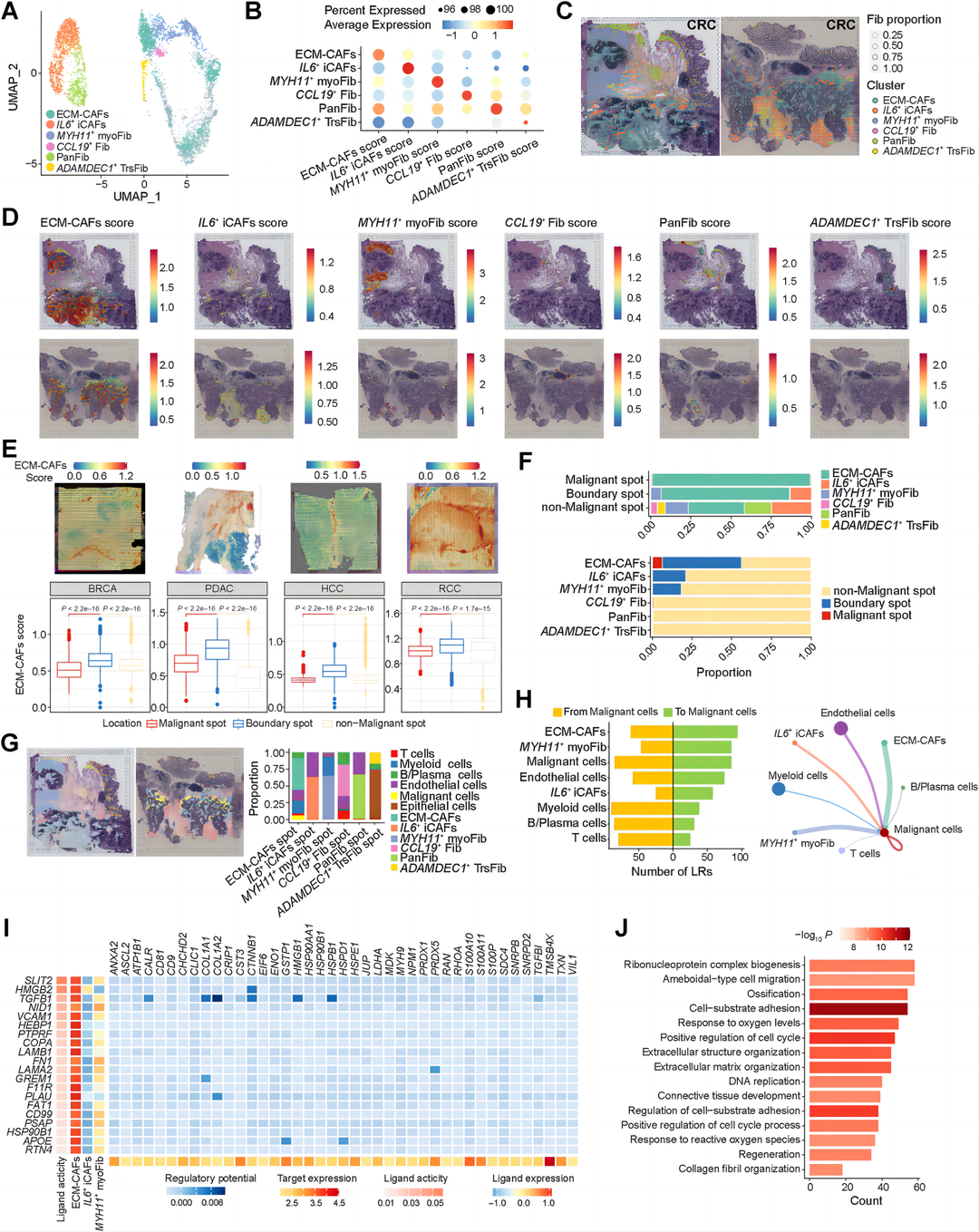
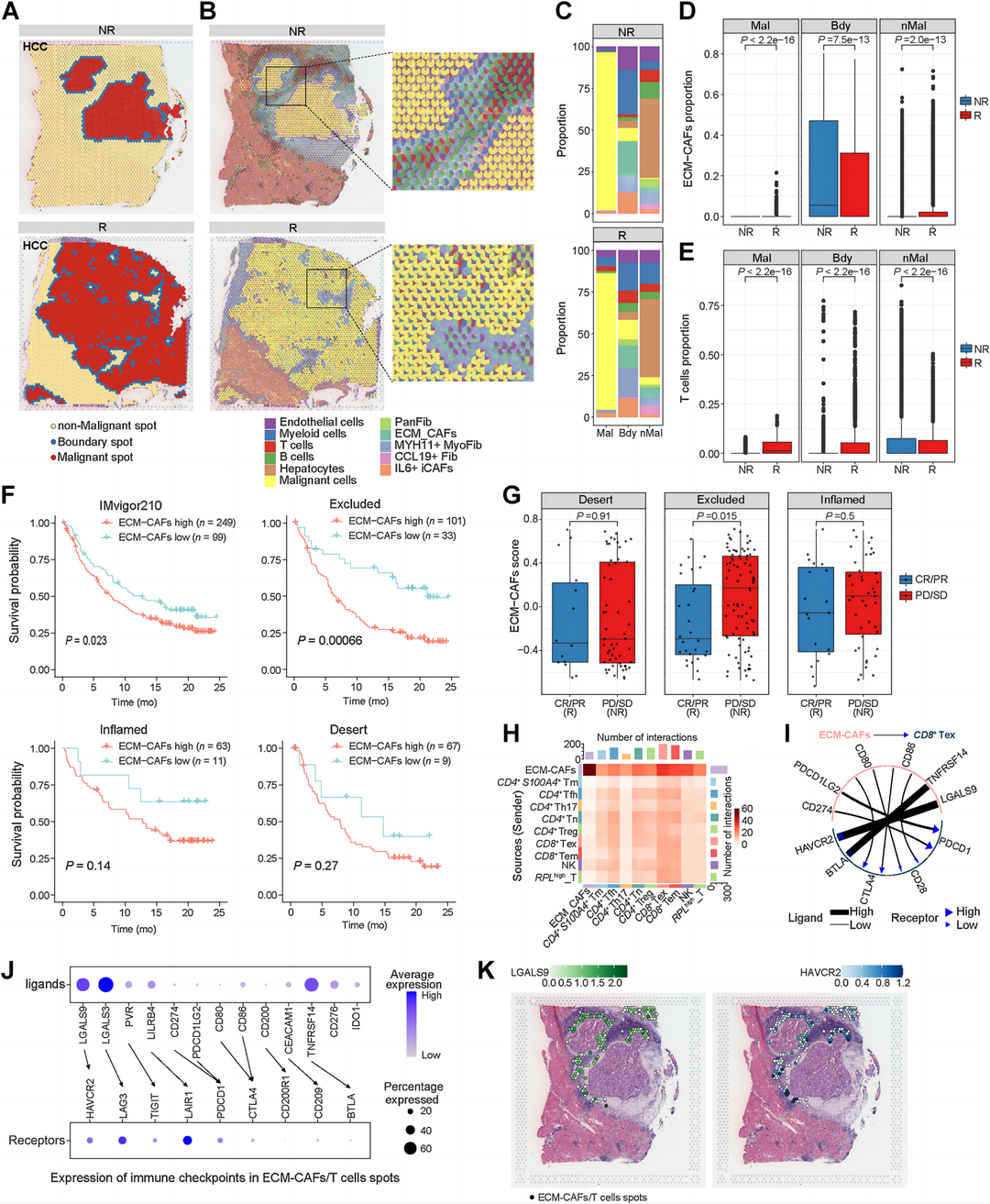
结果6:ECM-CAF作为空间免疫屏障与耗竭型T细胞相互作用,阻碍免疫应答
为了验证ECM-CAFs在ICB治疗中的作用,作者使用了他们先前制作的6份抗PD-1治疗的HCC ST切片,包括四个应答型和两个非应答型。作者勾画了每张切片的恶性、肿瘤边界和非恶性点区域,并估算了每个点的细胞组成(图7A和B)。作者观察到ECM-CAFs在边界点富集,在肿瘤边界,无应答者的ECM-CAFs水平明显高于应答者,无应答者的T细胞被排除在肿瘤核心(图7B-E)。抗PD-1治疗的膀胱癌患者的生存时间与ECM-CAFs特征评分的关联分析表明,接受抗PD-L1治疗的患者的ECM-CAFs与较差的预后相关(图7F)。这种效应可以用抗PD-L1治疗无效的患者的特征表达增强来解释,仅适用于免疫排斥肿瘤,而不适用于炎症或免疫缺乏表型的肿瘤(图7F和G)。接下来,作者进行了ECM-CAFs与所有T/NK细胞亚型之间的相互作用分析。根据作者的分析,ECM-CAFs和枯竭型CD8 T细胞表现出最多的相互作用(图7H)。接下来,作者在ECM-CAFs和枯竭型CD8+细胞上发现了与免疫检查点配体受体的多种相互作用,包括LGALS9-HAVCR2、TNFRSF14-BTLA和PDCD1LG2- PDCD1(图7I)。作者在ECM-CAFs或T细胞占据的HCC无应答的空间点上,预测了上述单细胞转录组学获得的ECM-CAFs和枯竭型CD8+细胞之间免疫检查点配体受体的表达,作者发现了与单细胞转录组学一致的结果,并表明LGALS9-HAVCR2、LGALS3-LAG3是ECM-CAFs调节的免疫抑制的主要原因(图7J和K)。
 技术咨询:
技术咨询: