人类前列腺癌细胞(PC-3)中溶血磷脂酸信号的全蛋白质组学分析揭示CCN1 的作用
2024-03-01

研究背景:
溶血磷脂酸(LPA)是一类简单的脂质,来源于膜磷脂,是G蛋白偶联受体(GPCR)的激动剂。在人类前列腺癌细胞系中,已经鉴定出七种LPA受体(LPARs),其中一些在前列腺癌细胞中表达。LPA在前列腺癌细胞中可以作为自分泌介质,能够诱导细胞增殖、迁移和粘附,这些响应主要由LPAR1介导。
LPA在信号转导中的早期事件包括激活Erk MAPK、Akt和FAK等信号通路。然而,为了启动如粘附和增殖等长期响应,需要考虑在初始急性信号变化之后的中间事件,这些事件将早期信号与细胞功能的后期变化联系起来。LPA已被证明能够调节细胞外基质(ECM)中的蛋白质,并且能够诱导某些ECM蛋白的表达。CCN1(也称为Cyr61)是LPA诱导的ECM蛋白之一,它在Rho依赖的方式中被诱导。
CCN1是CCN(Cysteine-rich angiogenic inducer 61)家族的成员,这个家族的蛋白质能够与细胞膜上的蛋白质(如整合素)以及ECM中的蛋白质(如纤维连接蛋白)相互作用。CCN1的诱导和分泌是由生长因子以及磷脂介质LPA和鞘氨醇-1-磷酸(S1P)在转录水平上快速诱导的。CCN1在LPA添加后的2-6小时内能被检测到,这使得研究者推测CCN1在LPA响应的中间阶段发挥作用。
此外,CCN1在癌症进展中的作用也受到了关注。先前的研究表明,LPA在基质和上皮前列腺细胞中诱导CCN1的表达,并且CCN1是良性前列腺增生的一个有效标志物。CCN1的诱导通过激活转录共激活因子YAP在癌细胞中发生。由于CCN1是整合素的配体,因此它可能至少部分地通过整合素介导下游信号。
文献:Global Proteomics Analysis of Lysophosphatidic Acid Signaling in PC-3 Human Prostate Cancer Cells: Role of CCN1. Int J Mol Sci. 2024 Feb 8;25(4):2067. doi: 10.3390/ijms25042067. PMID: 38396744; PMCID: PMC10889543.
结果展示:
结果1:鉴定 LPA 处理后差异表达的蛋白质
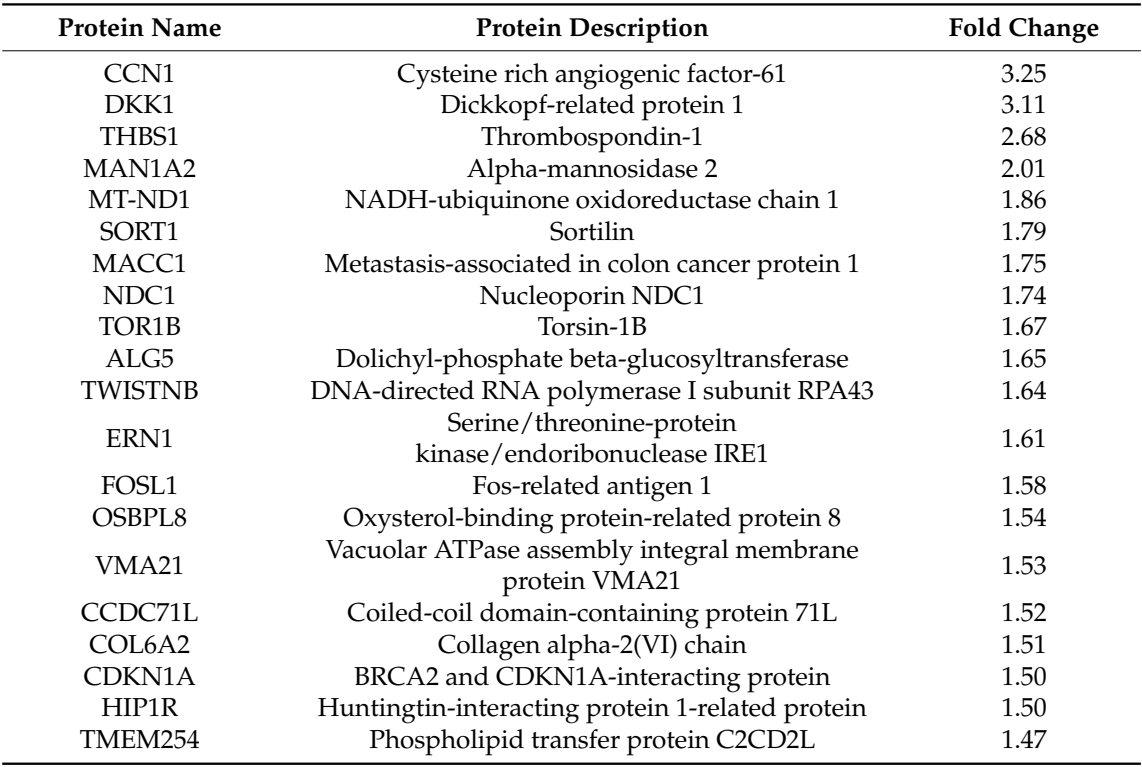
非靶向的全局蛋白质组学揭示了4299个在两组处理中都表达的蛋白质。在LPA处理的PC-3细胞中,有199个蛋白质是独特的,而在对照组中有321个蛋白质是独特的(图1B)。LPA诱导的蛋白质直接或间接调节下游信号通路,揭示了256个在PC-3细胞中与LPA处理相关的蛋白质上调。CCN1是LPA处理组中上调程度最高的蛋白质之一,证明了LPA在PC3细胞中显著诱导CCN1。
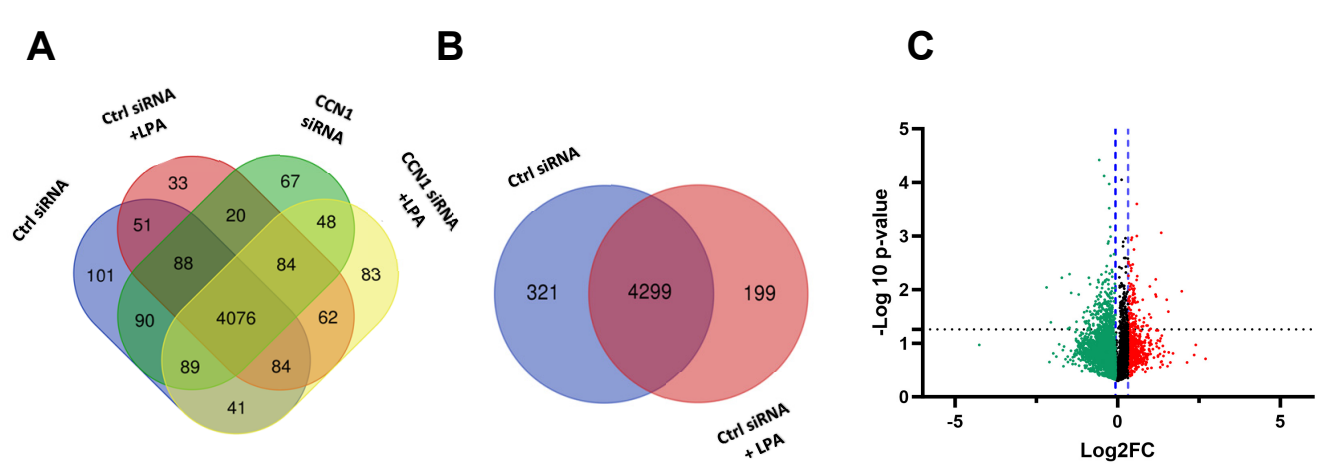
最高度上调的蛋白质列在(表1)中。在LPA处理的PC-3细胞中显著上调的前20个蛋白质中,包括结肠癌转移相关蛋白1(MACC1)、血小板素-1(TSP1)、转录因子Jun-B和Dickkopf相关蛋白1(DKK1)。
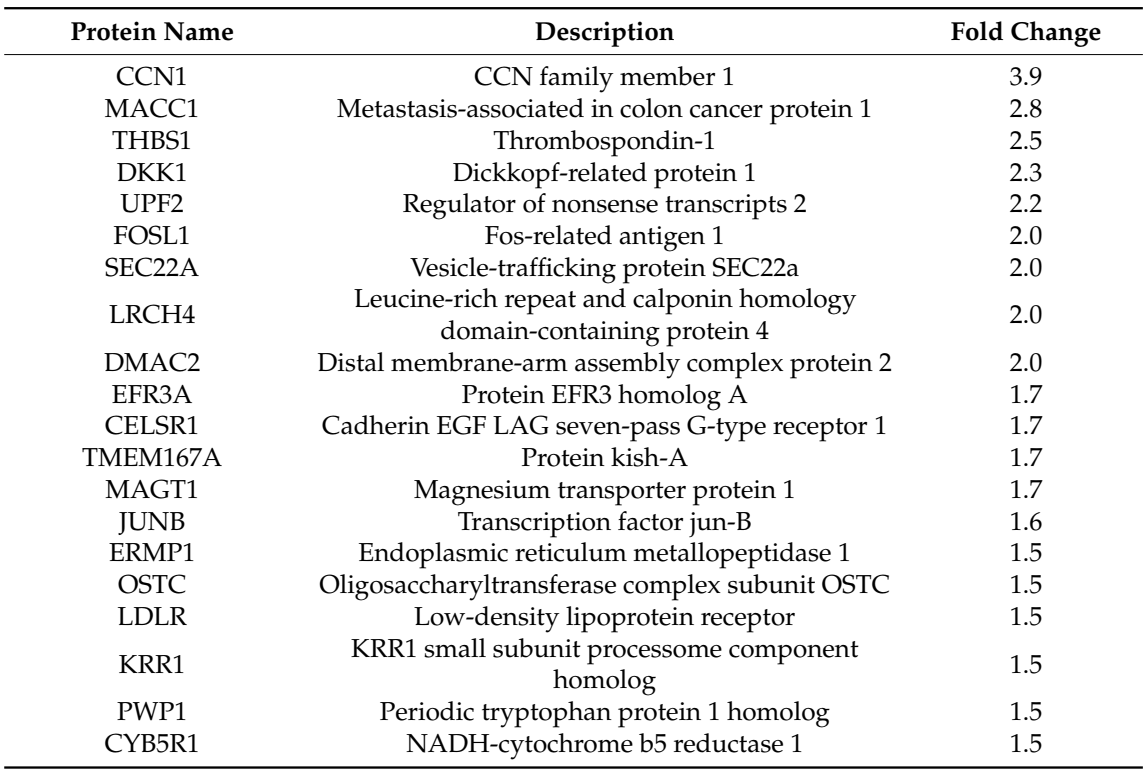
定量蛋白质组学结果如(图2)所示。LPA上调的几个蛋白质,包括CCN1,在细胞中的作用可能与LPA对前列腺癌细胞粘附和迁移的影响相关。MACC1是一种癌基因产物,作为多种癌症的预后生物标志物。血小板素-1(TSP1)与CCN1类似,是一种基质细胞蛋白,与细胞表面受体以及细胞外基质组分相互作用。JUNB是AP-1复合物的一个组成部分。它在细胞周期的S期上调,对细胞分裂起重要作用,也可以在上皮-间充质转化和肿瘤细胞侵袭中发挥作用。DKK1是一种分泌蛋白,是多种癌症(包括前列腺癌)的预后生物标志物。CCN1、MACC1、TSP1、JUNB和DKK1的上调共同指向了LPA可能调节细胞-ECM相互作用的多个步骤。
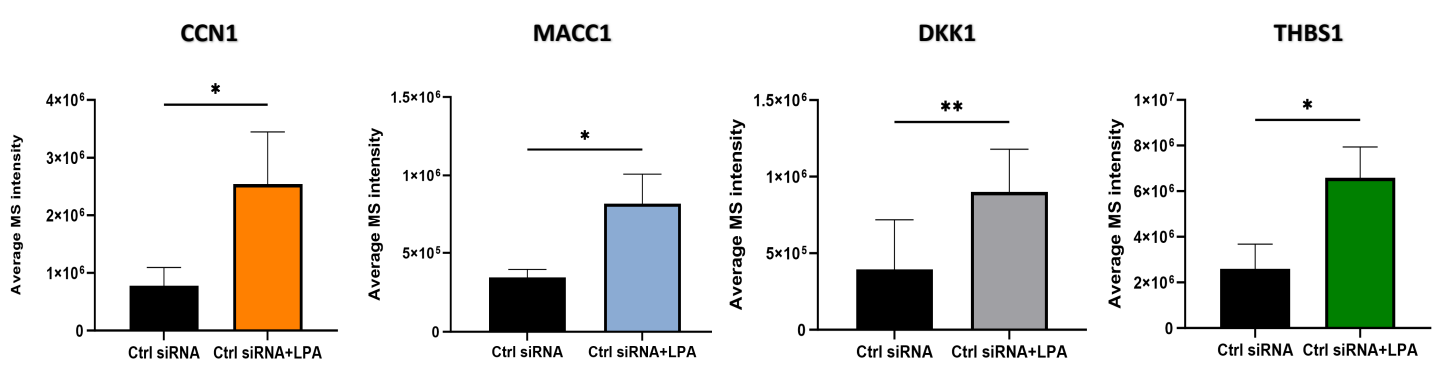
对下调蛋白质的分析(表2)还显示了LPA受体LPAR1的水平降低,LPAR1在PC-3细胞中介导了LPA的大部分效应。可以预期GPCRs在被激动剂长时间刺激后通常会下调。LPA响应下调的另一个蛋白质是硫氧还蛋白互作蛋白(TXNIP)。
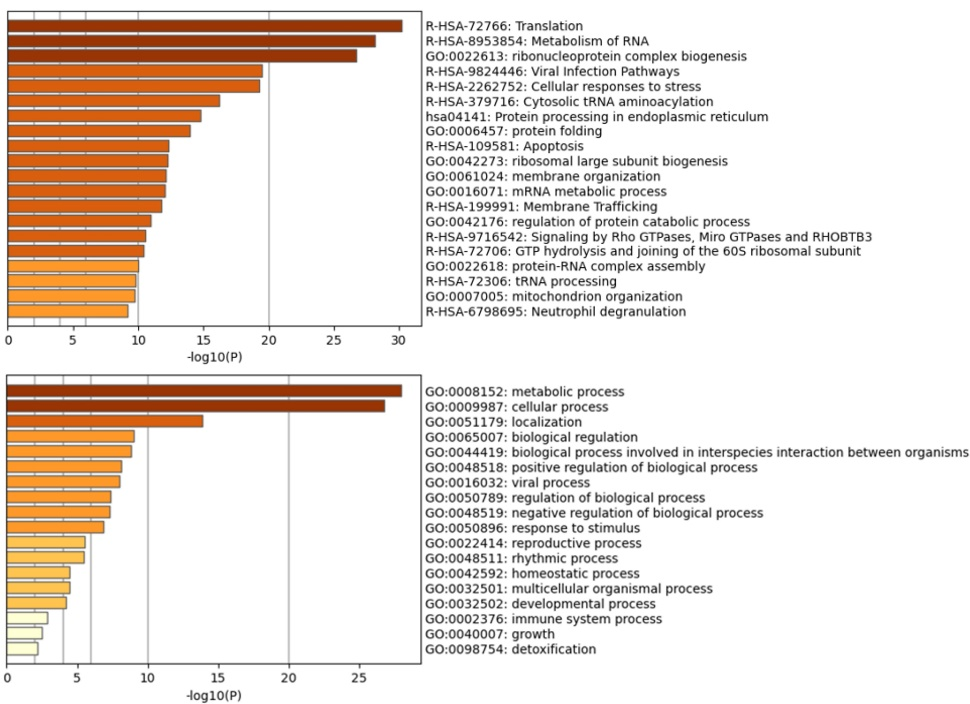
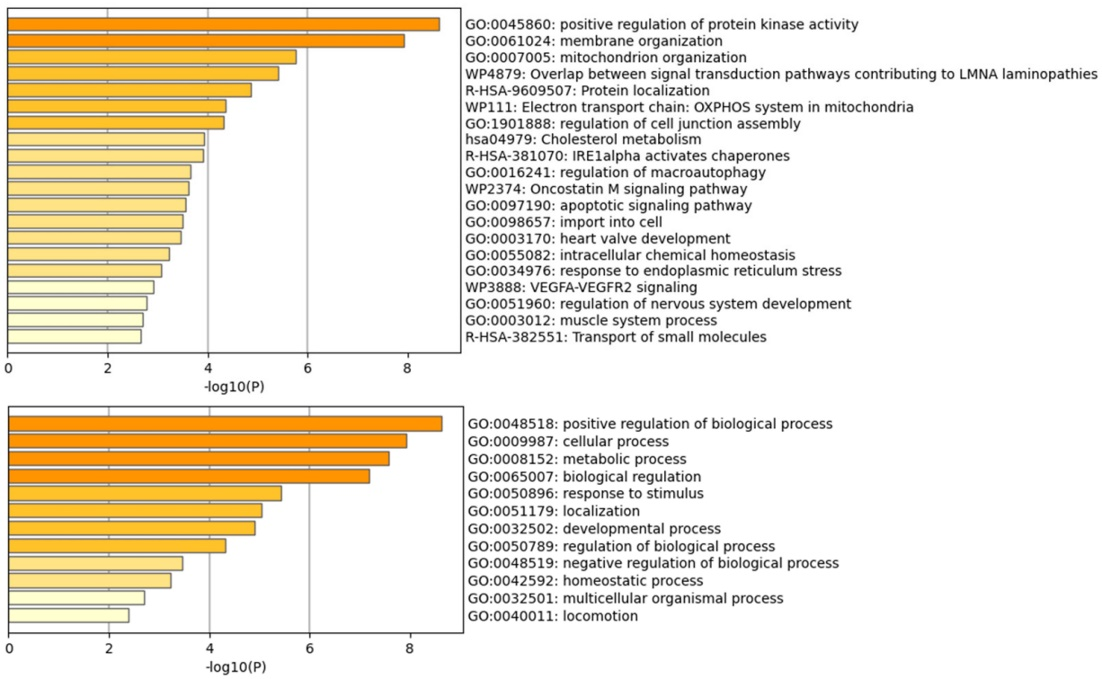
基因富集分析揭示了LPA影响的主要途径,包括整合素信号、有丝分裂和伤口响应,以及细胞连接的负向调节(图3)。所有这些途径都与已知的LPA影响途径一致。
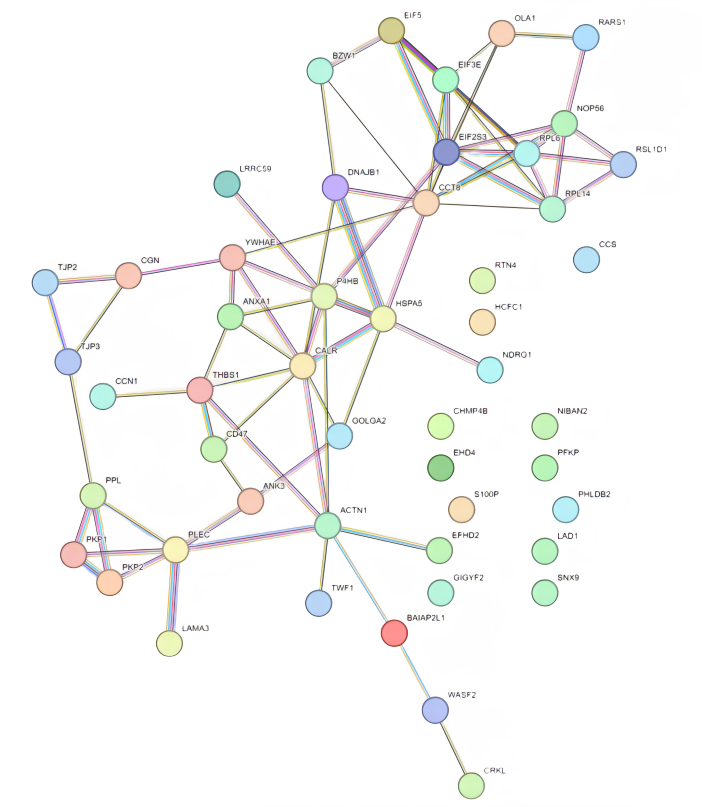
STRING分析,以检查与细胞粘附相关的由LPA上调的蛋白质之间的相互关系(图4)。TSP-1被确定为在功能上将CCN1与其他LPA响应蛋白联系起来的关键。
结果2:CCN1敲减后差异表达蛋白质的鉴定
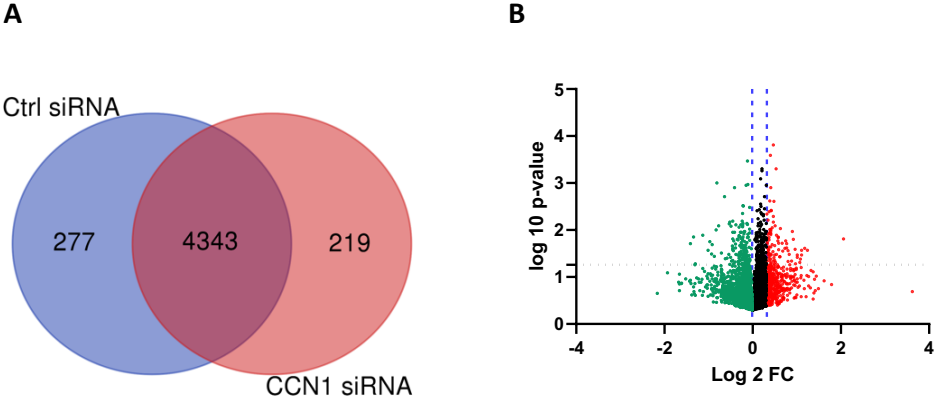
这一系列分析的目标是确定CCN1的敲减是否会影响LPA响应时观察到的蛋白质组学反应。如(图5)所示,在CCN1敲减组(± LPA)中检测到了4297个蛋白质,其中276个蛋白质是在用CCN1 siRNA处理并随后与LPA孵育的细胞中独特表达的。从总体分析来看,许多在CCN1敲减前对LPA反应最敏感的蛋白质,在CCN1敲减后仍然被LPA上调。
通过比较(表1)和(表3),可以看到CCN1敲减前后LPA反应的差异。CCN1、MACC1、DKK1和TBS1对LPA的倍数增加在用CCN1 siRNA孵育后都降低了。
由LPA下调的蛋白质(表4)在某些方面在CCN1敲减前后是相似的。例如硫氧还蛋白互作蛋白(TXNIP),是arrestin家族的成员,在前列腺癌中被报道减少,并作为肿瘤抑制因子。(表4)中还有一些在表2中没有出现的蛋白质,表明CCN1敲减增强了这些蛋白质对LPA的下调反应,包括FAM92B/ciBAR1和syndecan-1 (SDC-1)。其中FAM92B/ciBAR1在纤毛生成和自噬中发挥重要作用;SDC-1参与细胞粘附,在癌症中过度表达,并被释放到细胞外环境中,SDC-1的上调与更具侵袭性的前列腺肿瘤相关。

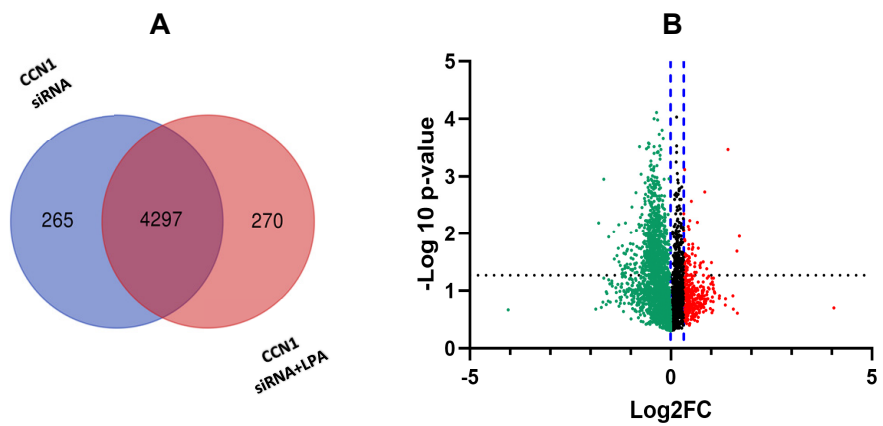
CCN1敲减单独(无LPA诱导)的蛋白质组学效应也相关,(图6)显示了CCN1敲减后的蛋白质组学差异。(图6A):Venn图显示了两个处理组中检测到的蛋白质数量(与CCN1 siRNA一起孵育和未孵育的细胞);(图6B):火山图显示了在CCN1 siRNA处理与否的细胞之间差异表达的蛋白质。
前列腺相关微精蛋白(MSMP/PSMP)在CCN1敲减后发生变化。结果显示CCN1敲减增加了MSMP的水平。研究表明MSMP是受体CCR2的趋化因子配体。在低氧条件下,MSMP在前列腺癌细胞中上调,导致药物抗性增加。在CCN1敲减后对LPA反应差异表达的蛋白质的GO分析如(图7)所示。
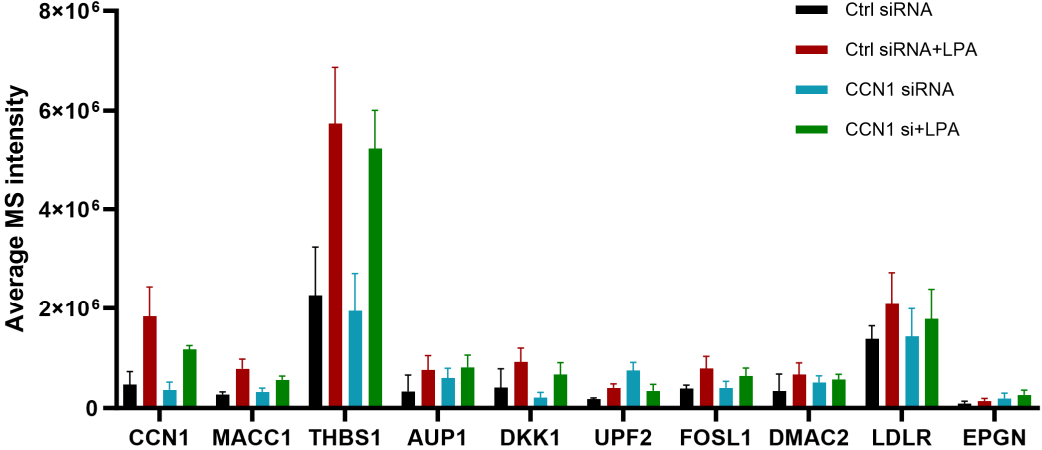
所有四种实验条件下LPA反应蛋白的表达水平在(图8)中呈现。在对照情况下对LPA反应最敏感的几种蛋白质在CCN1敲减后对LPA的反应性降低,包括前面讨论的蛋白质:CCN1、TSP1、MACC1、JUNB和DKK1。
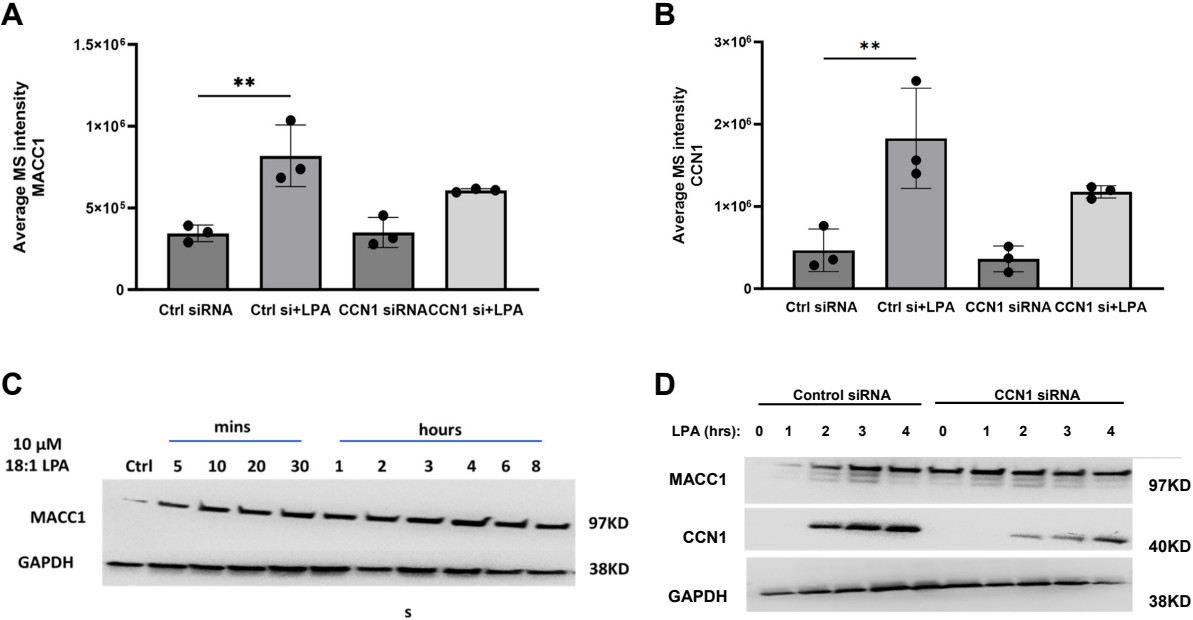
结果3:CCN1敲减对LPA诱导的MACC1和TSP1上调的影响为了进一步了解蛋白质水平的变化,进行免疫印迹实验以检查LPA对MACC1的影响时间过程,以及CCN1敲减对此诱导的影响。
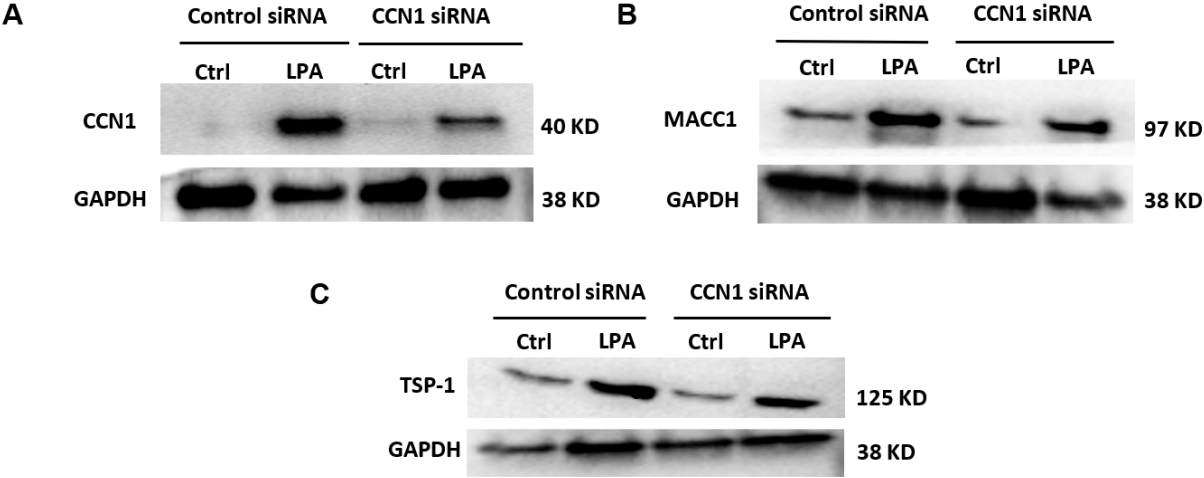
在额外的免疫印迹实验中(图10),分析了在有无LPA处理以及有无CCN1敲减的情况下,孵育三小时的细胞中CCN1、MACC1和TSP1的表达水平。显示LPA增加了CCN1、MACC1和TSP1的水平,并且CCN1敲减部分抑制了对LPA的响应。
研究结论:
 技术咨询:
技术咨询: