腹水细胞外囊泡蛋白质组学分析揭示卵巢癌肿瘤微环境
2024-04-10
前言:卵巢癌(OC)是妇女第八大癌症,在所有妇科癌症中死亡率最高,其中最常见的形式——卵巢、输卵管和腹膜的高级别浆液性癌(HGSC),可导致70%的卵巢癌死亡。这种疾病早期主要是无症状,但进展迅速,往往在晚期(III-IV)诊断时就已经发生转移。因此,5年生存率非常低。与其他利用造血途径进行转移性传播的癌症不同,HGSC是优先通过腹水进行种植性转移的。然而在临床治疗中腹水通常会被清除,但它往往代表了一种独特的、未充分研究的疾病相关材料,由于包含着各种细胞、蛋白质和细胞外囊泡(EVs),对腹水进行蛋白质组学研究能反映出一定的肿瘤特性和微环境特征。
本篇文章的研究人员通过聚焦于细胞外囊泡(EVs),以下简称EVs,对其进行蛋白组学分析。不仅发现了一组“核心腹水EV相关蛋白”,还定义了它是HGSC腹水特有的亚群。后续他们联合单细胞RNA测序数据,对HGSC特异性EVs与腹水中不同类型的细胞进行溯源,结果惊讶地发现EVs并不主要来自肿瘤细胞,而是来自非恶性细胞类型(如巨噬细胞和成纤维细胞)。流式细胞术的进一步分析也显示,分析这种HGSC中细胞类型特异性EV标记物比分析腹水细胞具有更大的预后潜力。
总之,这项研究表明EVs的蛋白质组学分析可以定义HGSC肿瘤微环境的细胞组成。这一发现为更好地揭示EV在肿瘤促进/预防中的作用和改进HGSC的临床诊断开辟了更多途径。
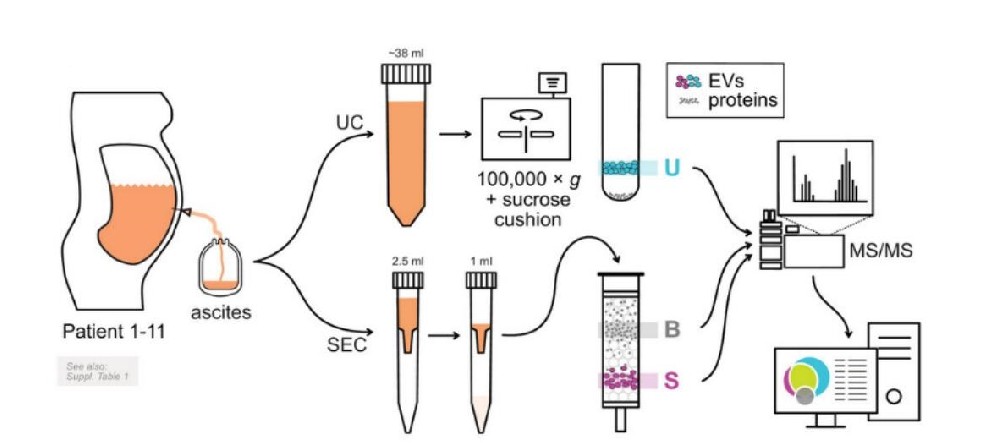
首先为了分离HGSC患者腹水的EVs并分析其蛋白质组成,研究者们收集了11名HGSC患者的原发性腹水活检。采用超速离心(UC)和尺寸排阻色谱(SEC)分离得到EVs。其中U代表UC,S代表SEC,以及来自排阻色谱法(B)的初级蛋白质组分来作为每个患者的阴性对照,然后进行MS/MS分析。
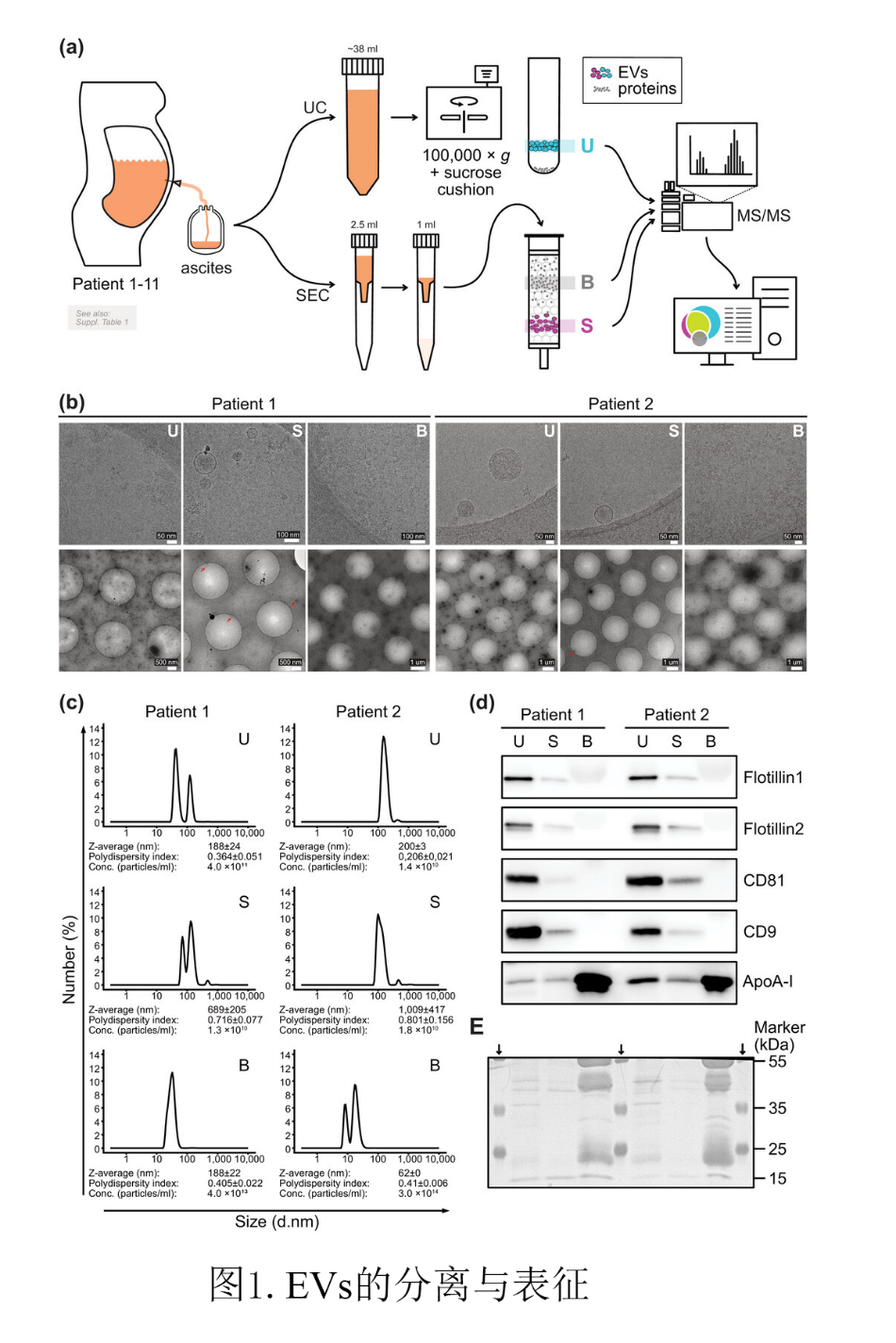
随后他们利用冷冻电镜(Cryo-EM)证实,具有双层膜的圆形EVs仅存在于组分U和S中,而不存在于组分B中(图1b)。通过Western blotting (WB)检测四种EV相关蛋白(Flotillin1、Flotillin2、CD9和CD81)和“阴性标记物”即非EV相关蛋白ApoA-I的表达情况(图1d),其中由于U和S之间由于样品量差异显示出蛋白印迹强度的差异(图1a,e),而ApoA-1脂蛋白在组分B中明显更丰富,这表明此项EV分离方法是较为成功的。
根据上述样品验证效果,研究者们提交了33个样品(U1-U11, S1-11, B1-11)进行定量无标签MS/MS分析。得到一批鉴定的蛋白质列表(见表S2),相较于S(909-2060)和B(335-704),U组分(2415-3093)显示鉴定出更多的蛋白质。前面的研究也显示这种蛋白质差异(比较U与S,参见图1d),这可能反映了UC组获得的EVs样品中蛋白质含量较高, 而B组分的丰度高但多样性低(参见图1e中的氨基黑色染色膜)。
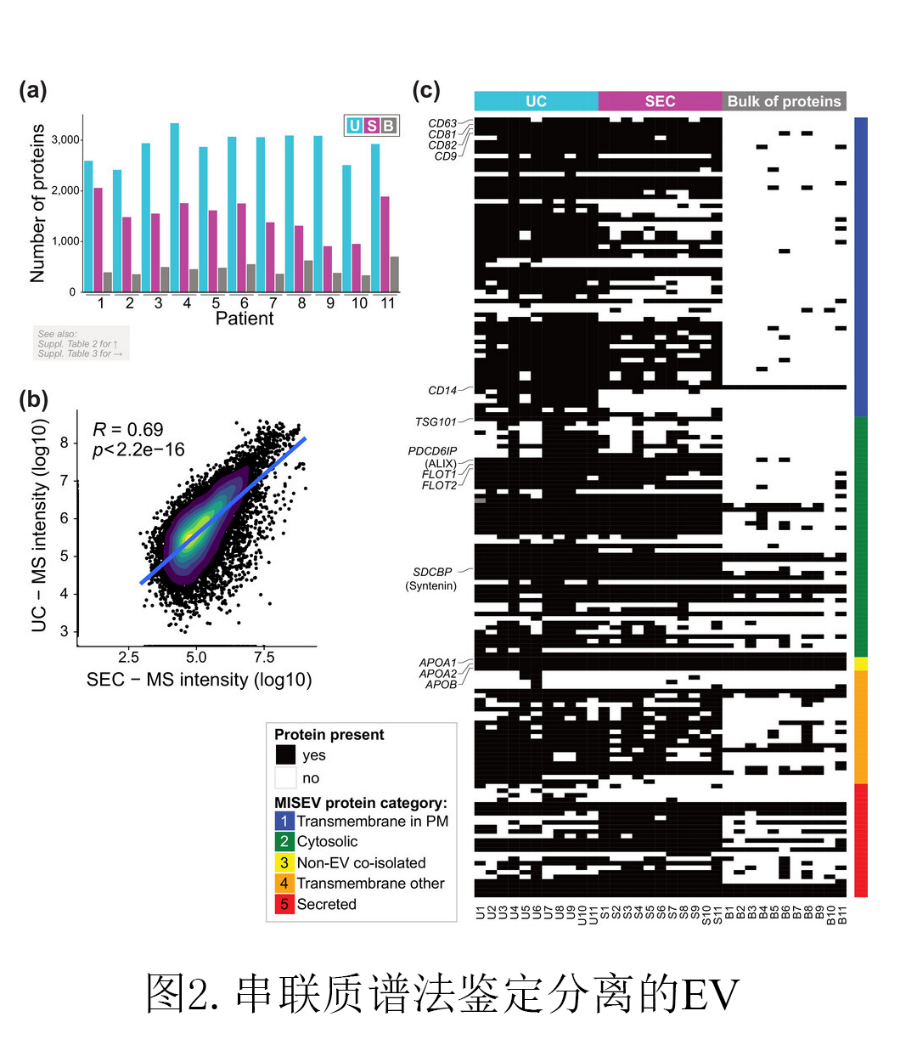
图2(a)柱状图显示每个患者的样本通过质谱鉴定的蛋白质数量。研究人员通过将质谱结果与发表在in the minimal information for studies of extracellular vesicles (MISEV2018) (Théry et al., 2018)的一篇研究中的EVs相关蛋白列表进行了比较,得到一张热图(图2(c))。该研究曾报道过390种蛋白质,而本篇文章的研究者们在至少一个测量样品中就检测到172种蛋白。这些蛋白绝大多数属于第1类,即“与质膜、核内体相关的跨膜或GPI锚定蛋白”;或第2类,即“被EVs回收包裹的细胞质蛋白”,而这些蛋白主要存在于U和S组分中,但在B组分中基本不存在,这表明他们的EVs分离质量较高。
为了鉴定HGSC相关腹水中EVs的蛋白质组成,他们合并了两条纯化路径的分析数据(图3a)。为避免每种分离方法所带来的污染物的干扰 ,他们接下来只分析每个患者的UC和SEC同时鉴定的蛋白质即S&U(黄绿色)部分。
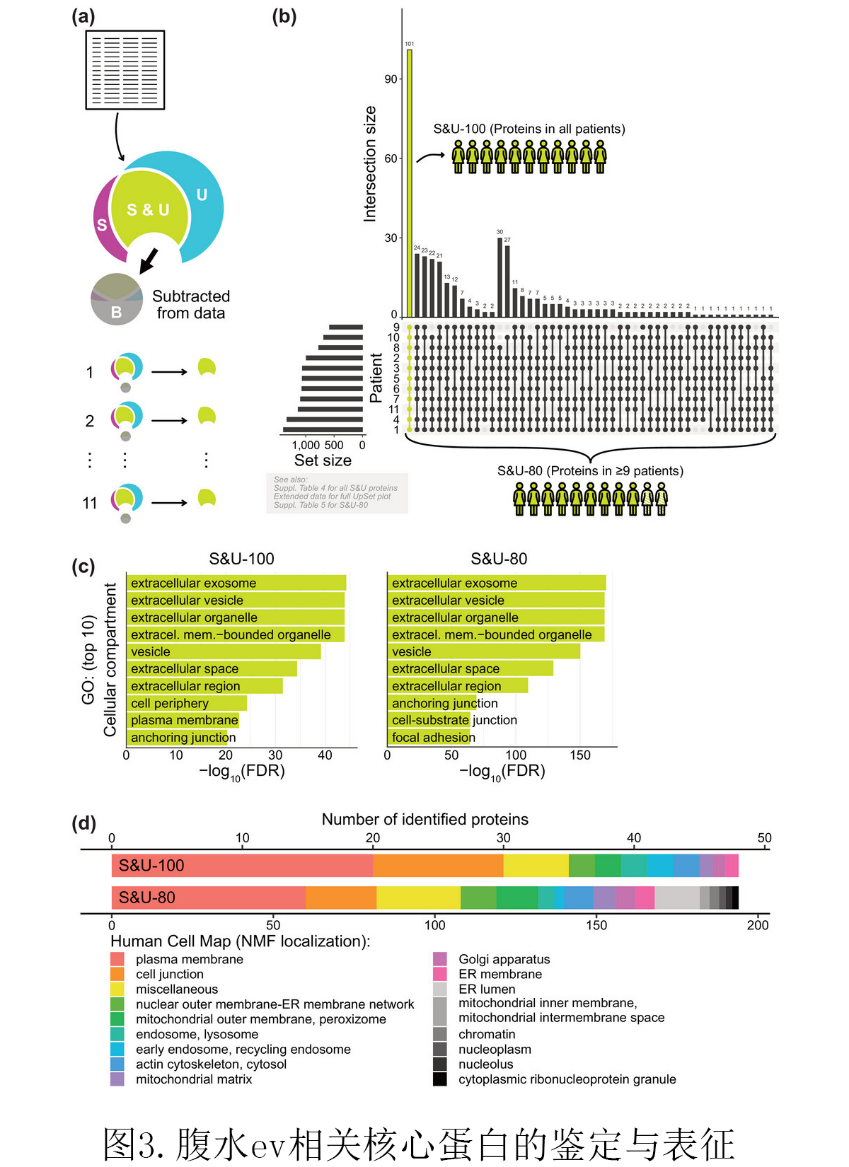
结果表明几乎所有患者中都存在许多S&U蛋白(图3b)。他们认为这些蛋白可能就是腹水中EVs相关的核心蛋白。为了进一步分析,他们设置了两类蛋白质分组,在所有患者中被发现设为S&U-100,和在80%以上患者中被发现设为S&U- 80。在S&U-100组中,他们检测到101个腹水EVs相关核心蛋白;在S&U-80组中,在9例以上的患者中发现了392种蛋白。在MISEV2018的EVs相关蛋白列表中,我们总共发现了18个来自S&U-100的蛋白(17.82%)和50个来自S&U-80的蛋白(12.75%)。这些蛋白和经典的EVs标记相关,如CD81、CD82、Flot1和Flot2。对S&U-100/80蛋白的Gene ontology (GO)分析显示,细胞外泌体和细胞外囊泡等在中EVs相关的GO类别高度富集(图3c),表明这些蛋白是真正完整的EVs蛋白。通过Reactome数据库分析发现在S&U-100组和S&U-80组与免疫系统、止血、信号转导、神经系统、疾病、小分子转运、细胞-细胞通讯和细胞外基质组织等通路高度相关。为了进一步表征蛋白质组,我们利用了人类细胞图谱(Human Cell Map)分析发现S&U-100和S&U-80两组中大多数腹水EVs相关核心蛋白都定位于细胞质膜或细胞交界处的细胞亚区(图3d)。使用这种方法他们鉴定了大约一半的腹水EVs相关蛋白。
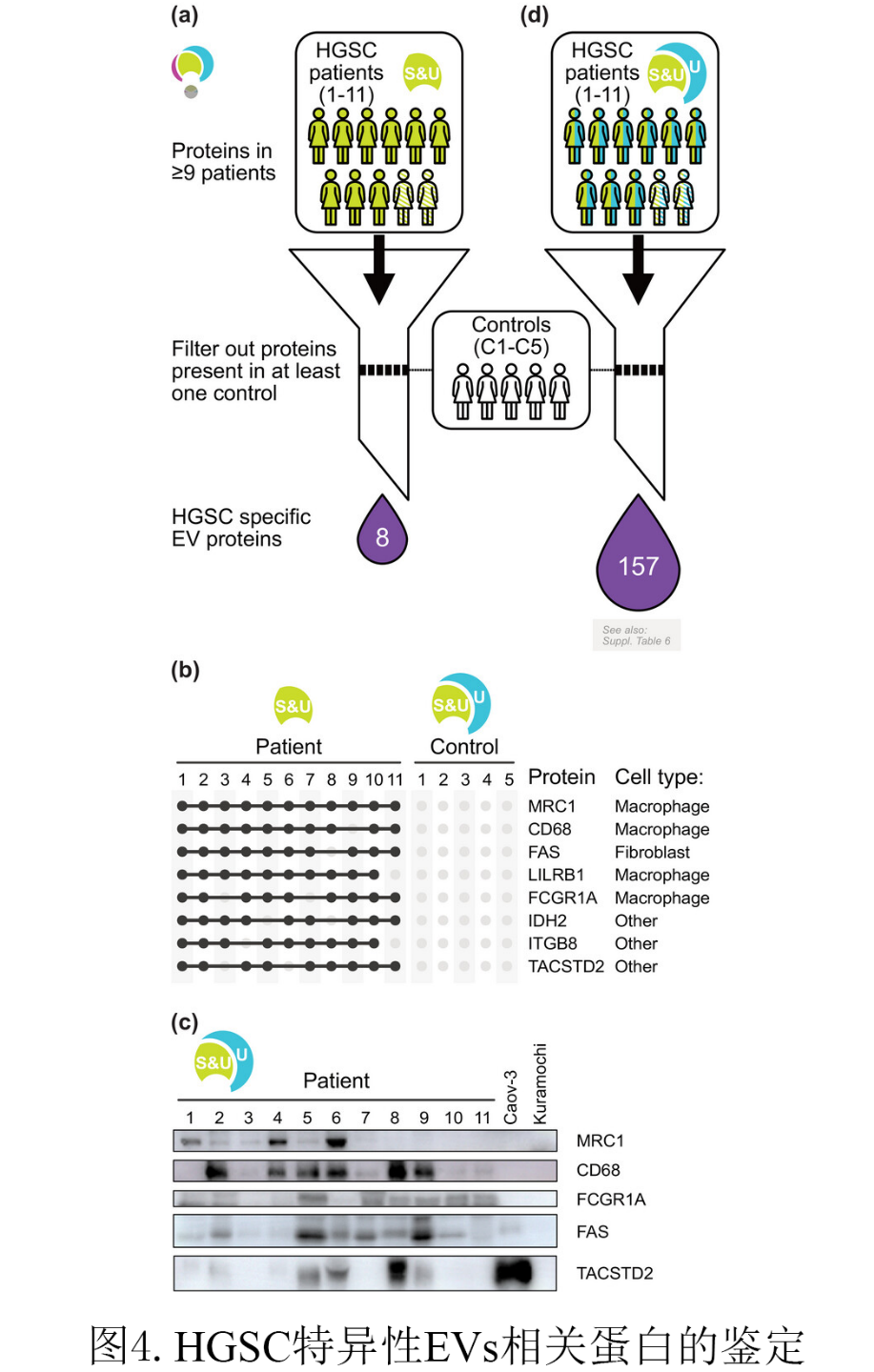
为了找到HGSC特异性EV相关蛋白,他们分离了5个对照样本的非恶性腹膜积液并提取其中的Evs,筛选去掉所有对照样品中测得的“腹水EVs核心相关蛋白”(见图3,S&U-100/80)(图4a)。只留下HGSC患者腹水特有的8种蛋白质,结合细胞类型标记基因参考数据库CellKb的分析,发现它们可能起源于各种细胞类型,而不仅仅是恶性肿瘤细胞。其中有四种蛋白被报道为巨噬细胞的标记(MRC1又称CD206、CD68、LILRB1、FCGR1A),一种被报道为成纤维细胞的标记(FAS),另外三种(IDH2、IGB8、TACSTD2)与特定细胞类型没有直接联系(图4b)。为了验证这些鉴定的特异性,他们对从患者和对照细胞系中获得的U部分进行了western blotting检测,靶向这5个标记物(图4c)。其中Caov-3和Kuramochi细胞被用作巨噬细胞标记物MRC1、CD68和FCGR1A的阴性对照。对于TACSTD2, Caov-3作为阳性对照,Kuramochi作为阴性对照。
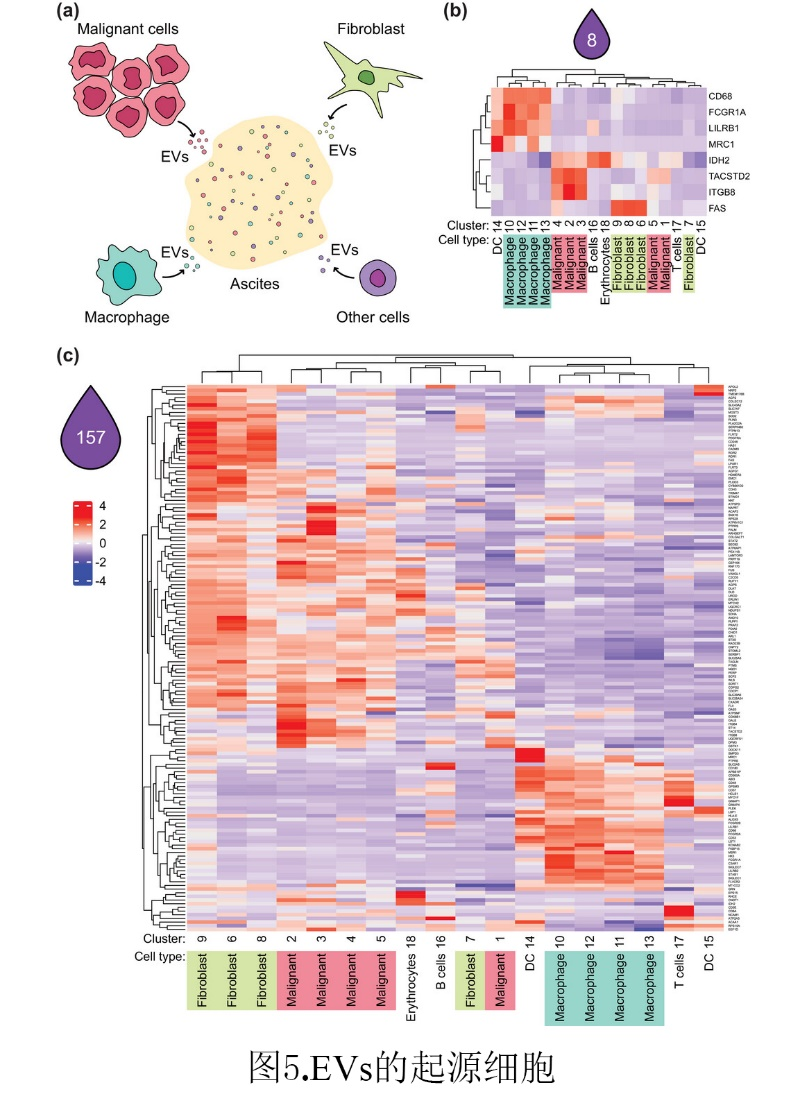
我们知道,HGSC腹水中Evs存在多种来源(图5a),为了确定这种不同类型的细胞在多大程度上促成了HGSC中Evs的腹水池的形成(图5a),研究者们联合已有的单细胞测序数据(Izar et al., 2020),绘制出HGSC腹水特异性EVs标记蛋白的表达(图4)(图5b,c),该项数据,样本量更大,却同样显示在157个EV标记上观察到非常相似的趋势(图4d),其中许多标记几乎由一种优势细胞类型(巨噬细胞、成纤维细胞、恶性细胞和淋巴细胞)特异性表达(图5c)。这一数据有力地表明,恶性腹水特异性的单个EV来自不同的细胞类型,这提示我们Evs的分析可用于评估肿瘤微环境(TME)的组成。
为了探索EVs作为HGSC中TME细胞多样性标志物的这种潜力,研究者们设计了具有细胞类型特异性的一组标记制剂,可以通过UC和SEC在他们的EV制剂中进行检测,进而对每个患者EV样本中的特定细胞类型来源进行量化和评分。
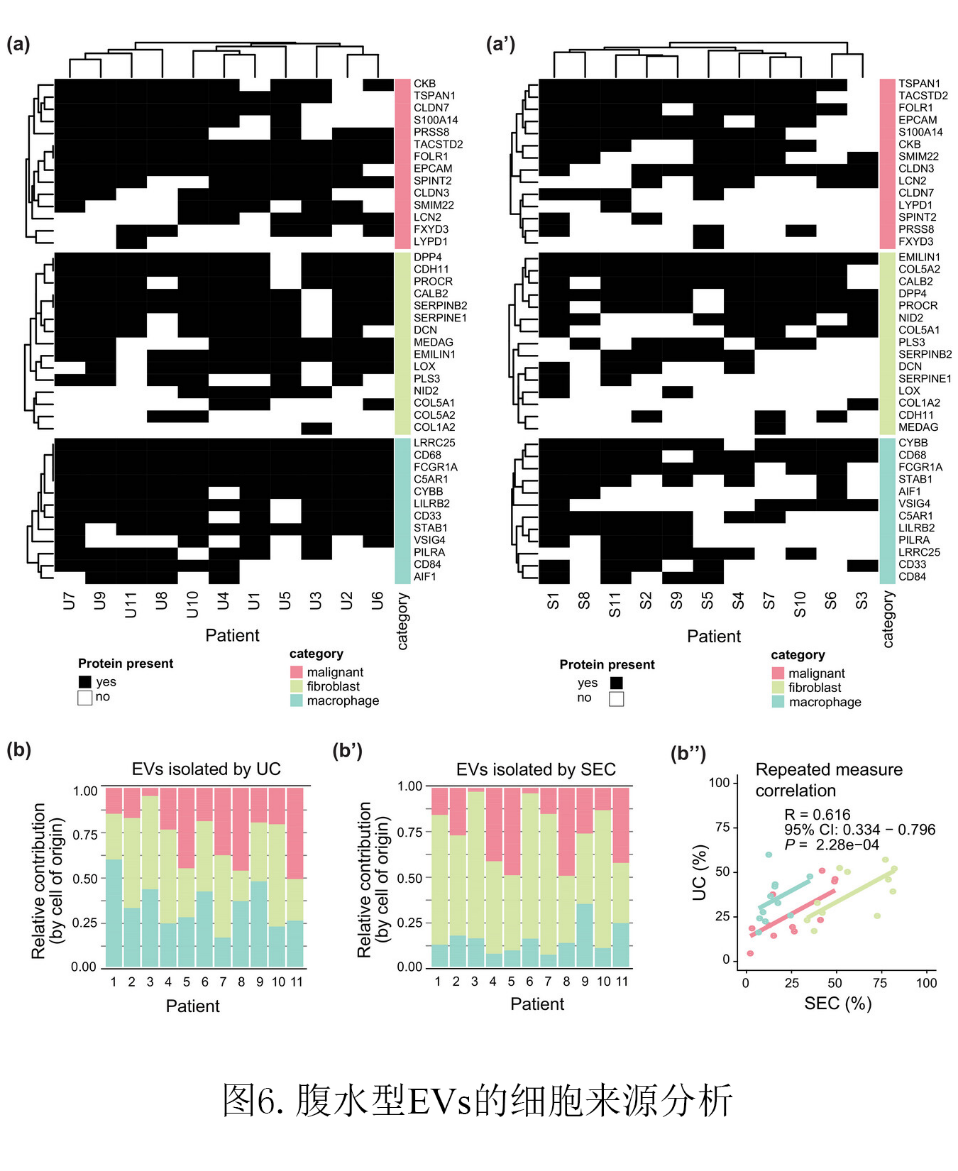
(a)是在UC (a)和SEC (a’)分离的EVs样品的质谱数据中发现的细胞类型特异性标记物的热图 (b)根据每个患者细胞类型特异性标记物的蛋白质强度显示细胞类型比例的图表。数据基于UC (b)和SEC (b’)分离的EV样品所测得的蛋白质强度。(b '')表示(b)和(b ')数据的相关性。
最后,回到临床上来,为了探究这种细胞类型特异性EV相关蛋白预测HGSC患者的生存率的中可行性,即腹水的细胞或EVs组成是否有任何诊断读数以及具有预后价值。研究者们使用总生存期(OS)研究腹水环境组成对患者预后的影响。通过测试了腹水中单个细胞类型(恶性细胞、成纤维细胞、巨噬细胞和外周血细胞)的比例是否与所分析患者的OS相关。
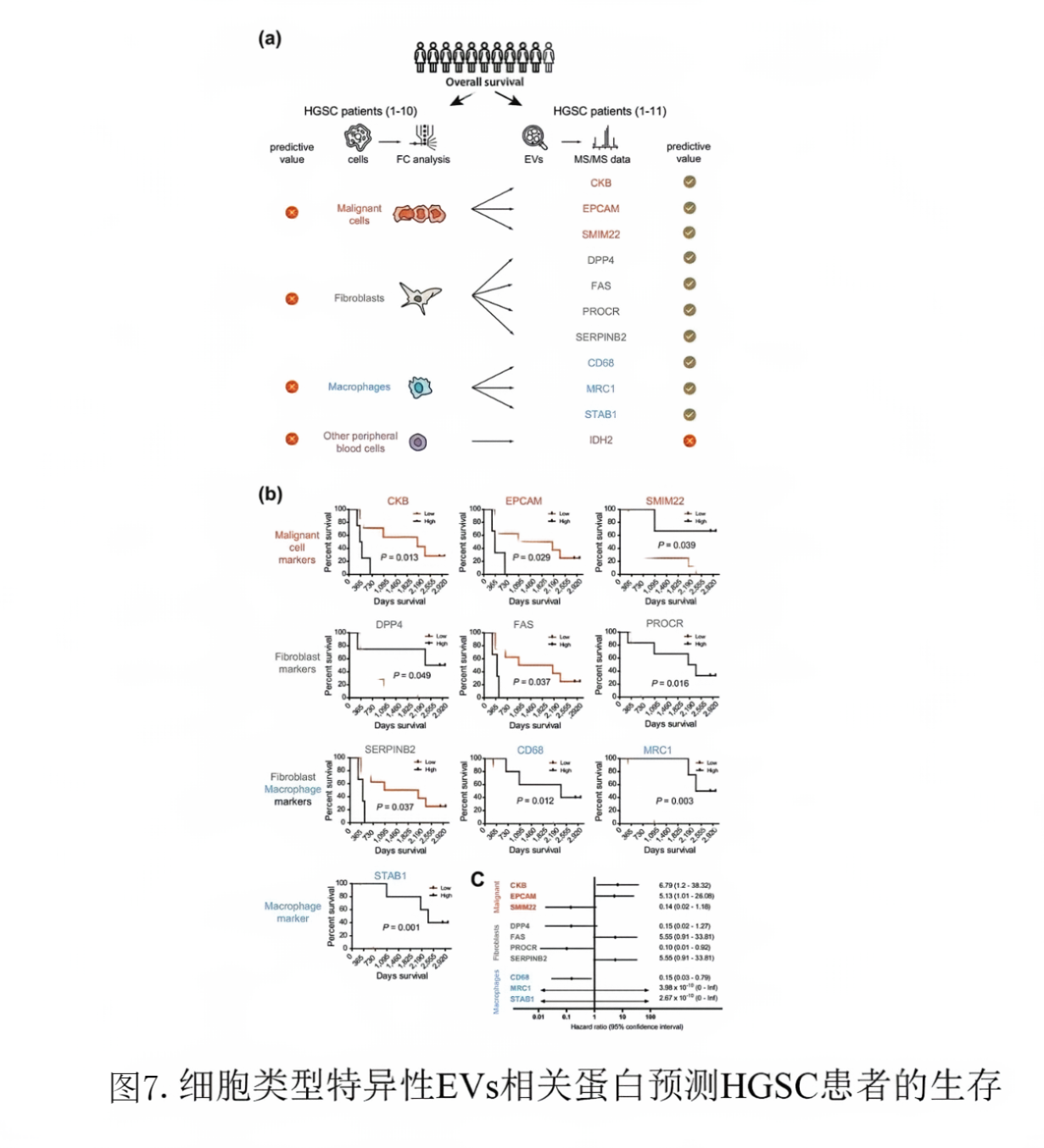
然而,没有一个细胞参数与患者生存相关(图7a)。接下来,分析这些细胞类型特异性的EV标记物(如图6a所示)和另外四种HGSC特异性EV相关蛋白,在45种细胞类型特异性蛋白中,发现其中10种具有潜在的区别性(图7a,右)。一些细胞标记如CD68、MRC1和STAB1等对OS有强烈的积极影响。相反,在腹水环境中仅有恶性细胞(EPCAM和CKB)和成纤维细胞(FAS和SERPINB2)表达的标记物对OS有强烈的负面影响(图7b,c)。
因此,他们的数据证明对HGSC患者腹水中EVs相关蛋白的分析适合作为肿瘤功能状态及其微环境的复杂足迹。这种潜力,可以用来提高我们对肿瘤生物学的理解,简化一些临床诊断方式,并提供这种致命疾病的治疗标志物参考。
 技术咨询:
技术咨询: