多组学分析PCB126对酒精性肝病的影响
2024-05-07
酒精相关性肝病(ALD)是一个主要的公共卫生问题,过量饮酒是 ALD 发展的主要病因,这种疾病表现为脂肪肝病(SLD)谱系,从单纯性肝脂肪变性开始,可伴随炎症和纤维化疤痕发展。此外,ALD可能发展至终末期肝病,失代偿性肝硬化和肝细胞癌可能成为患者预后的一部分。
而肝脏类疾病,如代谢功能障碍相关性脂肪肝病(MASLD)已被证明会因环境暴露而改变或增强,最常见的是,多氯联苯(PCB)等环境污染物会作为代谢干扰物,影响肝脏中间代谢,有毒物质也被证明会降低人体必需金属微量营养素的水平,如锌 、硒、铜,特别在肝脏中。
为研究环境污染物对ALD的影响,有研究人员[1]通过构建小鼠慢性酗酒模型,在通过EtOH饲养造模前,将PCB126按0.2 mg/kg对小鼠进行口服灌药,对照组则口服灌药玉米油,分组为PCB126组、veh.组,后将以上两组分别进行EtOH饲养及对照饲养,分组为EtOH组、pair-fed组,共计4组样本:pair-fed+veh.、pair-fed+PCB126、EtOH+veh.、EtOH+PCB126。后通过多组学联合分析PCB126对小鼠慢性酗酒模型的mRNA、蛋白质、脂质代谢等的影响。
取小鼠肝脏组织进行RNA-seq分析由 EtOH 喂养或 PCB126 暴露引起的组转录组差异(图1),可观察到乙醇喂养是差异的主要来源,而EtOH+veh.组和EtOH+PCB126组在转录组方面也存在较大差异。
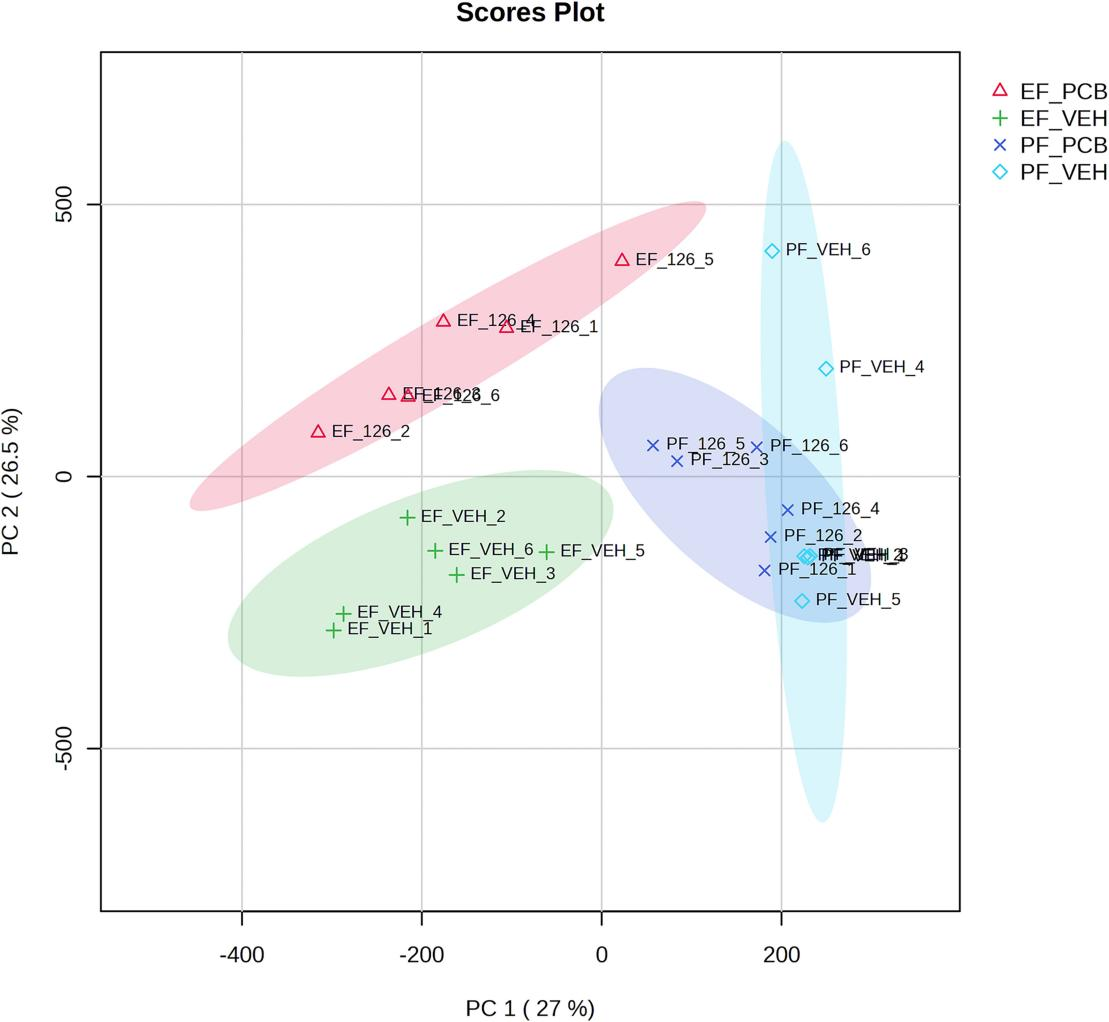
图1差异基因分析
根据RNA-seq检测结果,分析得到各组间的差异基因,并分为表达上调基因和下调基因(表1)。挑选出EF组(Veh. vs PCB126)中最显著的20个上调基因及20个下调基因(表2)。
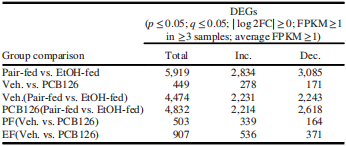
表1每组显著差异基因计数
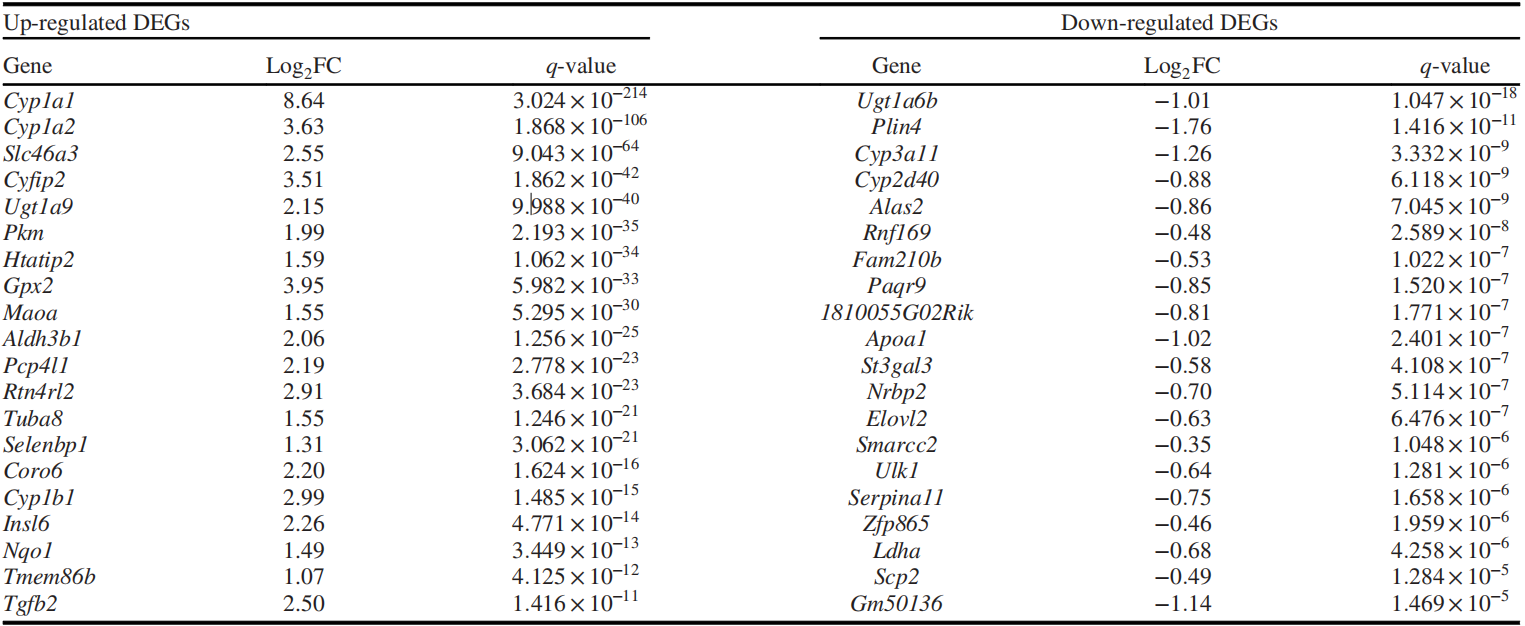
表2 EF比较组中差异最大的20个上调及下调差异基因
在筛选出的差异中,根据差异基因在EtOH和/或PCB126的不同作用筛选出4个特定基因进行RT-PCR实验(图2),分别为Abcb10(图2A)、Ugt1a6b(图2B)、Slc46a3(图2C)、Tuba8(图2D)。
ATP结合盒亚家族B成员10(Abcb10)是一种多重耐药线粒体转运蛋白,在EtOH喂养后表达量下调50%;UDP葡糖醛酸基转移酶1家族多肽A6B(Ugt1a6b)是参与葡萄糖醛酸化过程的一种蛋白,在对照喂养的小鼠中PCB126刺激后其表达量有少许上升,而在EtOH喂养的小鼠中PCB126刺激后表达下调60%;溶质载体家族46成员3(Slc46a3)是一种溶酶体转运蛋白,参与小分子和分解代谢物的分布,在PCB126刺激后有显著上调,EtOH组上调较少;微管蛋白α8(Tuba8)是一种参与微管形成和信号传导的非经典α-微管蛋白分子,在PCB126刺激后表达量均有上调。
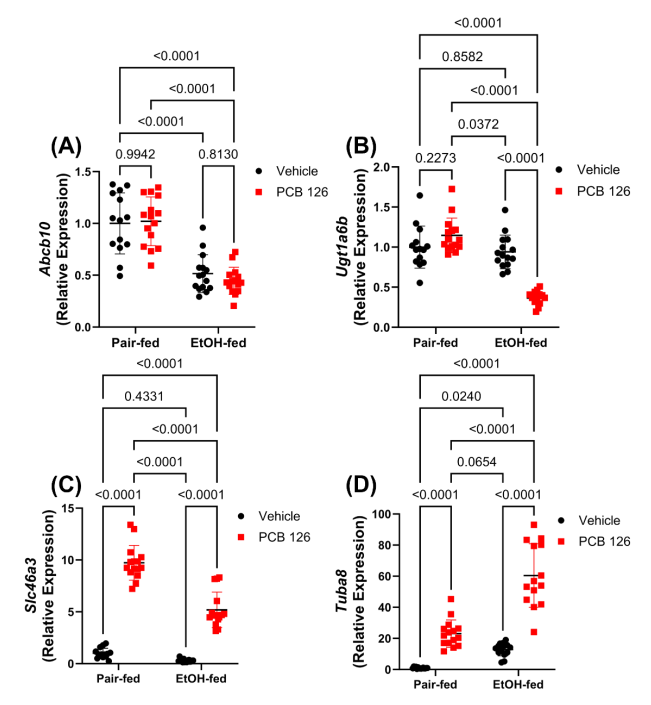
图2 RT-PCR检测结果
通过GO富集分析EF组(Veh. vs PCB126)的907个差异基因(图3),根据筛选的生物过程信息,研究者假定在PCB126刺激方式中是磷酸化,特别是酪氨酸残基的磷酸化,具有破坏信号传导或其他催化功能。

图3 EF组(Veh. vs PCB126)前20个生物过程
同时,通过GO分析筛选出前25个分子功能(图4),除最多的“结合”、“蛋白结合”外,其中有几个较多的分子功能,包含“离子结合”、“阳离子结合”、“金属离子结合”、“过渡金属离子结合”和“锌离子结合”。因此研究者假设PCB126刺激会导致金属离子水平变化。

图4 EF组(Veh. vs PCB126)前25个分子功能
为了跟踪确认GO富集分析中筛选出的生物过程,研究者通过label-free方法进行磷酸化蛋白质组学检测,以探究磷酸化蛋白质各组之间的差异(图5A)。同时,由于GO分子筛选出的生物过程中有4个包含肽基酪氨酸修饰/磷酸化的描述,因此研究者量化了酪氨酸磷酸化的相对差异,但未发现有显著差异(图5B)。
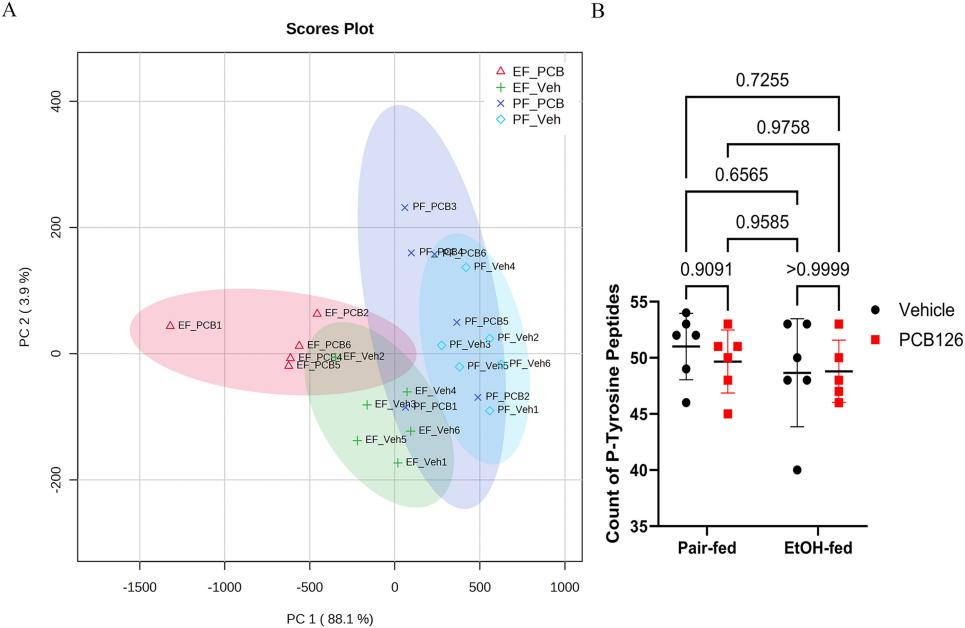
图5磷酸化蛋白质组学分析
根据以上检测结果,研究者通过MetaCore数据库围绕“肽基酪氨酸修饰”生成了一个网络(图6),观察发现JAK-STAT信号通道的基因差异表达,其中酪氨酸磷酸化是正常信号转导所特别需要的。
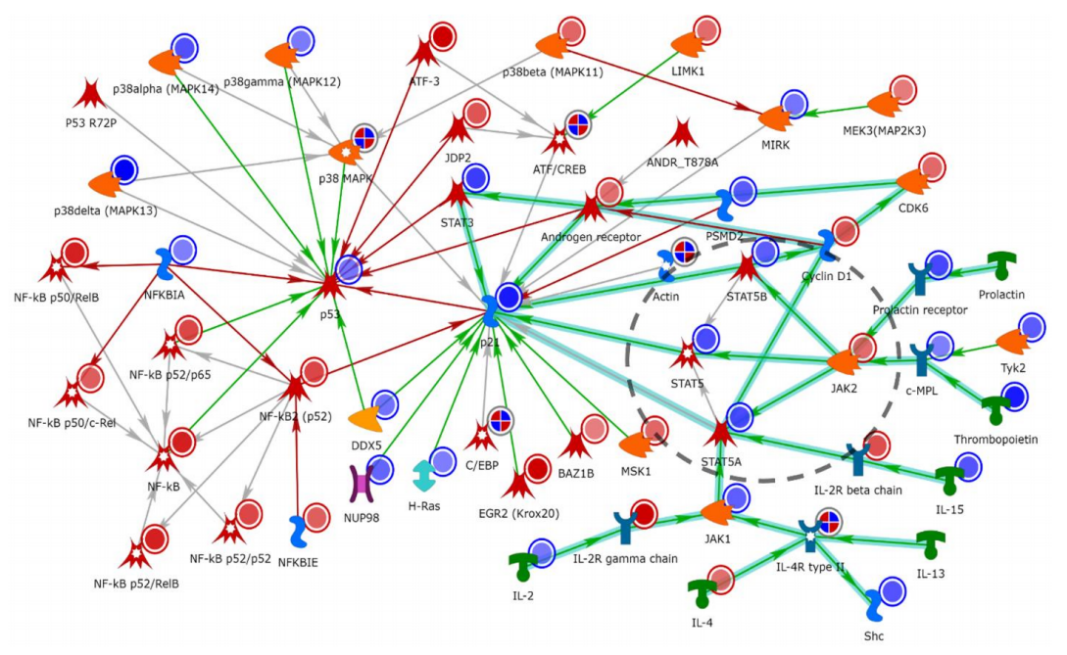
图6 MetaCore围绕“肽基酪氨酸修饰”生成的网络
为评估这种环境暴露模式下JAK-STAT通路的两种关键蛋白质的磷酸化水平,研究者通过WB检测分析JAK2、p-JAK2、STAT5、p-STAT5的表达水平(图7)。根据检测结果发现,除了p-JAK2/JAK2外,在EtOH喂养造模的小鼠中,所有磷酸化蛋白质和蛋白质均显著下降,但在PCB126刺激下变化不大。
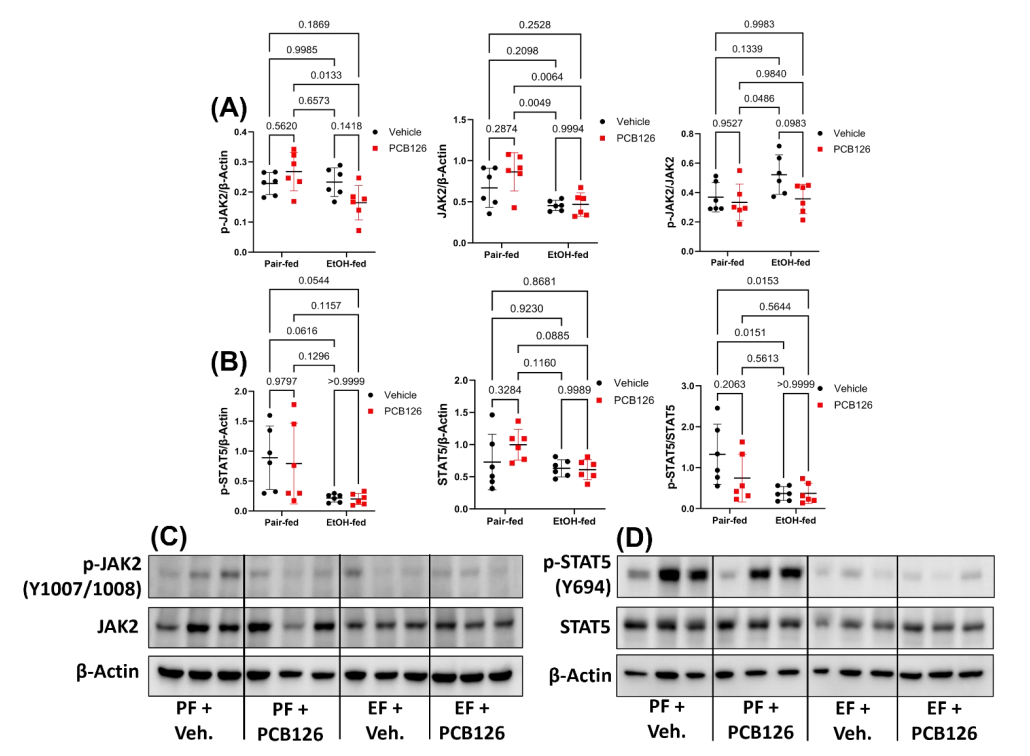
图7 WB检测JAK2、STAT5及对应磷酸化蛋白
根据GO富集分析的分子功能中主要包含“离子结合”、“金属离子结合”和“锌离子结合”,因此研究者通过ICP-MS方法测量了小鼠肝脏金属水平,并展示了四种关键的微量金属元素:(A) Na、(B) Co、(C) Mg、(D) Zn(图8)。根据检测结果发现,EtOH+PCB126组的Co、Mg、Zn离子含量相对于其他组均有显著降低,所有的金属离子水平均受到EtOH喂养影响,而PCB126暴露的影响相对较小。
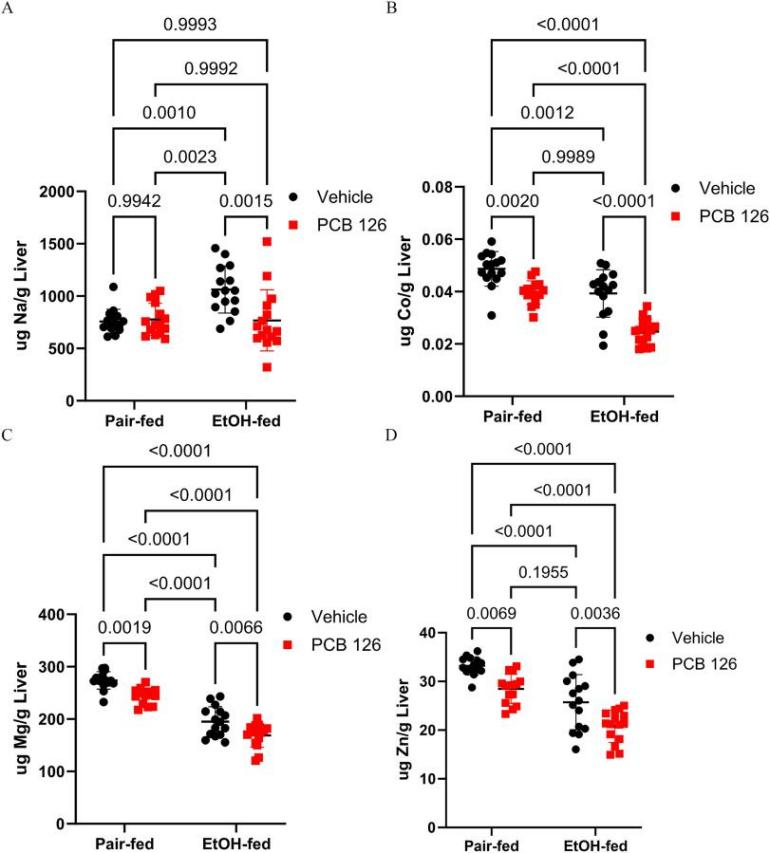
图8 ICP-MS分析四种必需微量营养素金属
此外,研究者通过MetaCore数据库对EF(Veh. vs PCB126)组的转录组数据进行分析,筛选出前20个重要转录因子(表3)。根据数据发现最高的转录因子是Fbi1,也称锌指蛋白ZBTB7A,此外前20的转录因子中含8个锌指结构域。
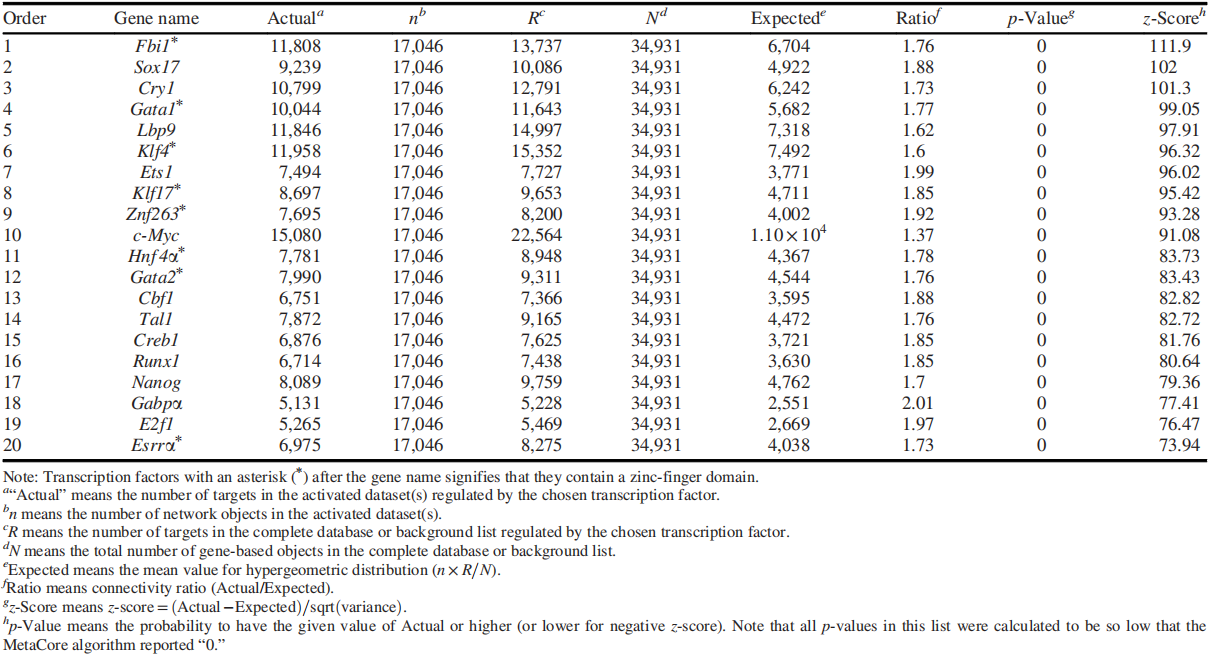
表3 MetaCore分析EF比较组转录因子
为研究环境污染物PCB126对酒精性肝病的影响,研究者通过RNA-seq检测提出了两种假设:
[1]Gripshover TC, Wahlang B, Head KZ, Luo J, Bolatimi OE, Smith ML, Rouchka EC, Chariker JH, Xu J, Cai L, Cummins TD, Merchant ML, Zheng H, Kong M, Cave MC. Multiomics Analysis of PCB126's Effect on a Mouse Chronic-Binge Alcohol Feeding Model. Environ Health Perspect. 2024 Apr;132(4):47007.
[2]McClain C, Vatsalya V, Cave M. Role of Zinc in the Development/Progression of Alcoholic Liver Disease. Curr Treat Options Gastroenterol. 2017 Jun;15(2):285-295.
 技术咨询:
技术咨询: