多组学联合分析揭示ackr1通过调控巨噬细胞迁移参与人类肌腱粘连再生过程
2024-05-20
2024年5月7日,上海交通大学医学院附属上海市第六人民医院骨科、上海交通大学Bio-X研究院、海军医科大学长征医院骨科脊柱外科的几位研究者们联合在《Bone Research》上发表了,题为“Multi-omics analysis of human tendon adhesion reveals that ACKR1-regulated macrophage migration is involved in regeneration”的研究论文,该研究通过单细胞测序和蛋白质组学在内的多组学分析,系统分析了人和小鼠肌腱损伤后不同阶段的肌腱粘连组织,鉴定了参与肌腱粘连形成中的多类细胞(如SPP1+巨噬细胞等),表征了肌腱粘连的纤维化微环境,并揭示了一种新的抗纤维化巨噬细胞簇及其起源。这些结果为人类肌腱粘连提供了潜在的治疗靶点。
前言
肌腱粘连是肌腱损伤后的常见并发症,其形成非常复杂,主要是由各种肌腱周围细胞系(包括免疫细胞、内皮细胞和间充质细胞)之间的相互作用驱动的,这些细胞存在于特殊的纤维化区域,被称为纤维化生态位。肌腱粘连复发与肌腱损伤患者的预后不良直接相关,因此需要有效的抗纤维化治疗。
目前人们对人类肌腱粘连纤维化生态位中涉及的细胞谱系的功能多样性和相互作用的描述相对不足,例如,巨噬细胞被广泛认为是周围粘连形成的纤维化触发因子,然而,不同类型的巨噬细胞具有不同的功能,并受到多种调节,这些都尚未被了解。本文作者们之前也曾发现巨噬细胞会分泌TGFβ1,随后招募干细胞来源的肌成纤维细胞形成粘连,不过,他们无法明确其具体的集群和起源。
为了研究不同细胞系之间的相互作用。他们先用单细胞测序分析了12例病人,包括3例正常肌腱周组织样本和3例损伤后3、10天(dpi)和12周(wpi)病变病理样本。
结果
1.不同临床阶段肌腱粘连组织细胞群特征分析
通过对样本肌腱粘连组织的74350个单细胞的转录组进行聚类分析和注释,他们建立了正常腱膜周围组织和损伤组织中细胞类型图谱(图1)。

图1:人正常腱周组织和肌腱粘连组织单细胞图谱
图1a是该研究的技术路线。图1b中的74350个细胞的UMAP图分别包括3例患者正常腹膜周围组织的10081个细胞、3例3 dpi (d后)患者肌腱粘连组织的18866个细胞、3例10 dpi患者肌腱粘连组织的14953个细胞和3例12 wpi(伤后一周)患者肌腱粘连组织的30450个细胞。随后,研究者们用已知的标记物展现了人肌腱粘连组织的几类细胞群的散点图(图1c)。其中每一个点的大小表示每个簇的基因表达百分比,颜色表示平均基因表达量(红色,高)。通过分析,发现在不同临床阶段肌腱粘连组织中炎症细胞、内皮细胞和内皮细胞的比例随肌腱粘连阶段的不同而不同,其中主要有8种细胞类型,它们的占比见图1d、e的条形图。
可以发现内皮细胞(ECs)是最丰富的细胞类型,占总数的一半以上,通过PECAM1和VWF13、14的高表达水平被鉴定出来(图1c)。在3 dpi(炎症期)时,间充质细胞(MCs)和ECs的比例较低,而炎性细胞包括单核吞噬细胞、T细胞、B细胞和中性粒细胞的比例增加;这一阶段最丰富的细胞类型是单核吞噬细胞(MPs),其次是T细胞和中性粒细胞(图1d)。在10 dpi(增殖期)时,炎症细胞数量减少,同时,ECs和MCs开始大量增殖,在12 wpi(重塑期)3时,成纤维细胞已经迁移到病变处,出现在肉芽组织中,诱导肌腱粘连。MCs和ECs是这一阶段的主要细胞类型,炎症细胞较少(图1d)。12 wpi时主要细胞类型的分布与正常肌腱周组织相似,表明在肌腱粘连的晚期,组织状态已经趋于稳定(具体的占比数据见原文表4),基于这些细胞群的动态,研究者们推测MPs、ECs和MCs在肌腱粘连的发展中起重要作用。
2.纤维化微环境中独特的内皮细胞亚群的分类
为了验证所确定的细胞簇的功能,他们对10例患者的肌腱粘连组织中内皮细胞ECs的不同的EC簇进行聚类分析。进一步又分为4个亚群:包括间隙连接蛋白α 4 (GJA4)、细胞周期调节剂(RGCC)、非典型趋化因子受体1 (ACKR1)和C-C基序趋化因子配体21 (CCL21)(图2a-d)。

图2:人类肌腱粘连组织中存在不同的EC簇
图2b的散点图显示他们通过已知标记展示了内皮细胞的不同细胞簇。图2c是 ECs中各簇所选基因表达的小提琴图。图2c的热图进一步对这些标记基因进行聚类展示,左边即是标记基因。通过图2e柱状图研究者们为10例患者的ECs中每个聚类的比例进行了展示。图2f的UMAP图展示了各时间点的ECs,分为normal, 3 dpi, 10 dpi, 12 wpi四个组,而大量ECs主要在10 dpi和12 wpi时增殖。此外,研究者们分析了肌腱损伤后三个阶段上调的信号通路,发现与正常肌腱周组织相比,肌腱粘连组织中ECs信号通路上调,包括ecm受体相互作用和局灶性粘连的相关信号通路均上调(图2g)。
3.鉴别纤维化的内皮细胞
紧接着,研究者们对单细胞数据进行拟时序分化轨迹开关基因的分析挖掘,通过构建了3个不同的基因表达模块,发现肌腱损伤后,分化轨迹是从ENDO1到ENDO0再到ENDO2的,而ENDO1的起源是内皮祖细胞。
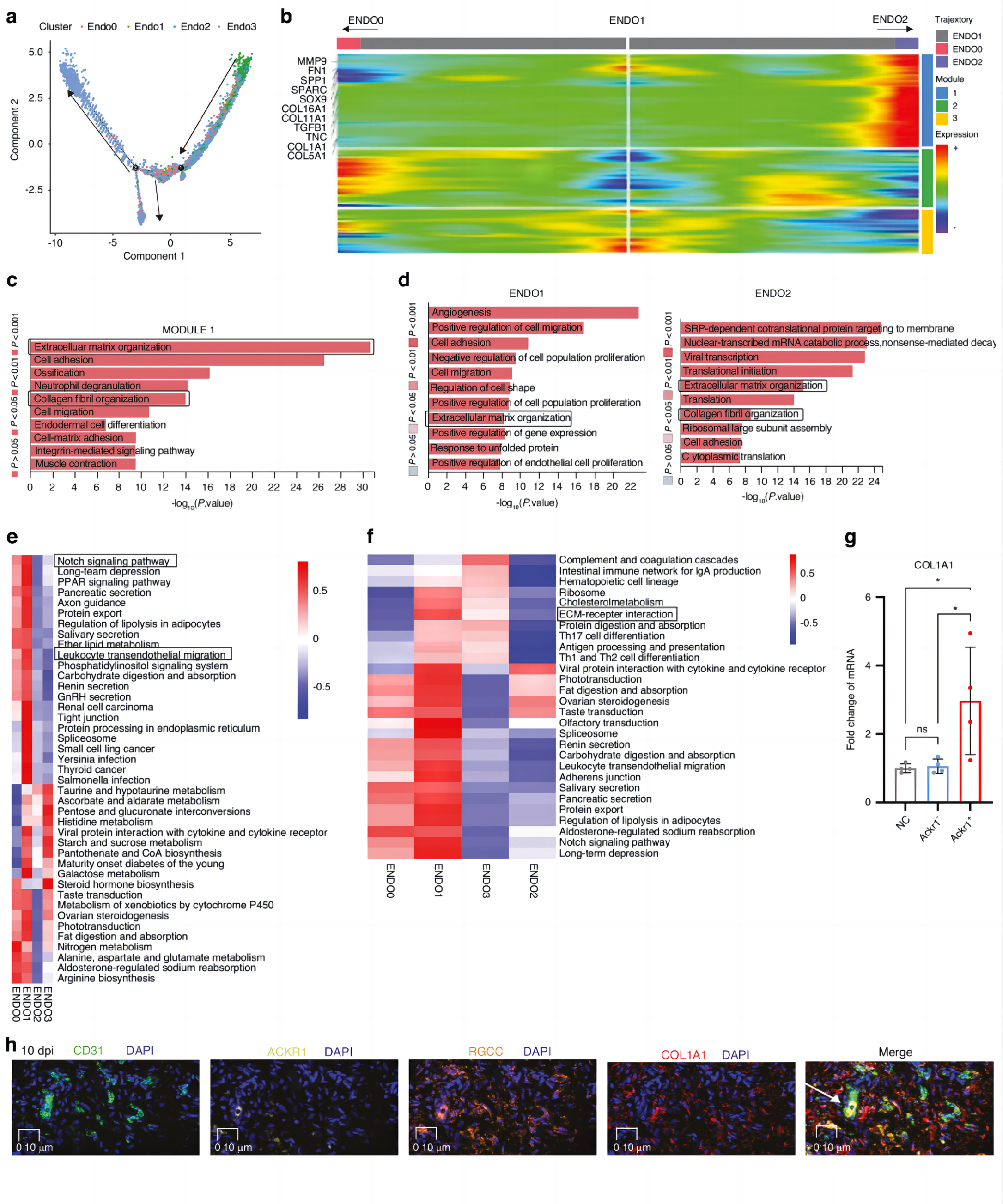
图3:鉴别纤维化的内皮细胞
图3a即他们对纤维化的内皮细胞 ENDO0、ENDO1和ENDO2的拟时序轨迹分析。箭头表示轨迹方向。ENDO1到ENDO2拟时序轨迹的差异基因模块热图表明,纤维化基因包括SPP1、FN1、COL1A1和MMP9,均在这一过程中上调(图3b)。模块1的GO富集分析显示,在此过程中,参与细胞外基质(ECM)组成的基因被上调(图3c)。为了更好地了解ENDO1和ENDO2的表型,他们做了GO富集分析,发现显示ENDO1与血管生成和ECM组织相关,ENDO2与ECM组织和胶原纤维组织相关(图3d)。对ECs富集通路的Qusage分析则表明,包括NOTCH信号通路在内的纤维化相关通路在ENDO1中明显上调(图3e)。KEEG分析则揭示了ECM受体的互作在ENDO1和ENDO2中的富集程度(图3f)。
此前,本文的研究者们曾通过细胞实验表明ACKR1+内皮细胞可以促进纤维化。因此他们从人10 dpi组织中分离培养了ACKR1+内皮细胞,用ENDO2 (ACKR1+ECs) 或ACKR1- ECs培养基处理的原代人成纤维细胞,检测qPCR。体外实验表明,人成纤维细胞中COL1A1的mRNA水平增加(图3g)。接着他们做了免疫荧光实验,得到CD31 (ECs标志物)、ACKR1、RGCC和COL1A1的多色定位图,标记为:CD31(绿色)、RGCC(橙色)、ACKR1(黄色)、COL1A1(红色)、DAPI(蓝色)。此外,CD31、RGCC、ACKR1和GJA4在10 dpi处的共定位表明,GJA4+ ECs和RGCC+ ECs可能在肌腱粘连进展过程中转化为ACKR1+ ECs(图3h)。总的来说,他们确定了人肌腱粘连组织中的ECs亚群,表明ACKR1+ ECs有助于人肌腱粘连的纤维化。
4.出现在肌腱粘连组织中不同的MP细胞簇
研究者们对12例患者进行多组学检测到共16299个细胞,并描述了5个MPs亚群,包括树突状细胞(dc)、单核细胞和巨噬细胞(图4a)。他们将MP4定义为标记CD1c分子(CD1c)和Fc epsilon受体Ia (FCER1A)38的DCs(图4b, e)。MP0定义为富含S100钙结合蛋白A8 (S100A8)和S100钙结合蛋白A12 (S100A12)的单核细胞(图4b, e)。MP1、MP2和MP3定义为标记CD68、载脂蛋白e (APOE)和补体C1q A链(C1QA)的巨噬细胞(图4b)。
其中MP1通过白细胞介素1 β (IL-1 β)和表皮调节素(EREG)富集,(GO)分析显示MP1参与了炎症反应(图5b)。因此,MP1被定义为促炎巨噬细胞。而MP2的特征是纤维化巨噬细胞,由分泌的磷酸蛋白1 (SPP1)和基质金属肽酶9 (MMP9)标记(图4b, c)。通过体外实验,他们将MP3定义为表达叶酸受体β (FLOR2)和淋巴管内皮透明质酸受体1 (LYVE1)的抗纤维化巨噬细胞(图4b, c)。
肌腱损伤导致粘连组织内5个MPs亚群丰度随粘连进展而各有变化。与正常腱鞘周围组织相比,MPs的GO分析显示炎症相对反应上调(图4h),肌腱粘连组织中MPs的信号通路上调包括HIF-1信号通路、TNF信号通路和IL-17信号通路(图4i);与正常肌腱周组织相比,肌腱损伤后MPs信号通路下调,包括MAPK信号通路等(图4j)。

图4:人肌腱粘连组织中存在不同的MP簇
图4b散点图显示已知标记的MPs细胞群,点的大小表示每个簇的基因表达百分比,颜色表示平均基因表达量(红色,高)。图4c 即MPs中各簇所选基因表达的小提琴图。图4d柱状图为12例患者的MPs中每个簇的比例。图4e是各MP簇标记基因聚类热图,左边即标记基因。图4f是各时间点MPs的UMAP图,分为normal, 3 dpi,10 dpi, 12 wpi四组。图4g即 MPs中促炎因子和抗炎因子表达水平的小提琴图,包括促炎因子如IL1、IL8、MIF、TNF和抗炎因子如IL1RN、IL4、IL10。图4h显示肌腱损伤后三个阶段上调基因的GO分析。图4i是肌腱损伤后三个阶段上调的信号通路分析。图4j是肌腱损伤后三个阶段下调的信号通路分析。
5.SPP1+巨噬细胞的纤维化表型
在最近的一项研究中,人类纤维化肝组织中的TREM2+SPP1+巨噬细胞被鉴定为可促进肝纤维化的疤痕相关巨噬细胞,在本研究中,也已经鉴定出MP2标记SPP1,这是在人肌腱粘连组织中髓样细胞2 (TREM2)和MM9上表达的触发受体(图4b, c)。通过图4所示的方法,他们也分析了MP2表达的基因热图,观察到促纤维化基因SPP1、TREM2和CD9分子(CD9)8,45的上调(图4c)。并发现MP2参与了细胞外基质(ECM)形成(图5b)以及ECM受体相互作用(图5d)。对每个MP亚群中富集的通路的Qusage分析显示,包括ECM受体相互作用和糖酵解在内的纤维化相关通路在MP2中上调(图5c)。这些证据表明其具有潜在的促纤维化功能。

图5:鉴定促纤维化巨噬细胞和抗纤维化巨噬细胞
6.FOLR2+巨噬细胞的抗纤维化表型
研究者们发现MP3是参与肌腱粘连的抗纤维化巨噬细胞,在正常肌腱周组织中,MP3占巨噬细胞的比例最大,在3 dpi时,由于肌腱损伤后的早期炎症,MP3的巨噬细胞比例大幅下降(图4d)。
GO分析也表明MP3参与中性粒细胞脱粒(图5b)。对不同MPs亚群中富集通路的Qusage分析显示,MP3中氧化磷酸化上调,这与抗炎巨噬细胞相关,而纤维化相关通路在MP3中很少存在(图5c)。之前曾有研究表明氧化磷酸化可以减少肝纤维化。KEEG分析显示MP3的内吞和产热途径高度富集(图5d)。MP3信号通路分析显示MAPK信号通路上调(图5g)。我们的细胞实验证实,FOLR2+巨噬细胞表现出一定的抗纤维化表型。
随后他们从人10 dpi组织中分离培养了FOLR2+巨噬细胞,进行蛋白质组学分析。
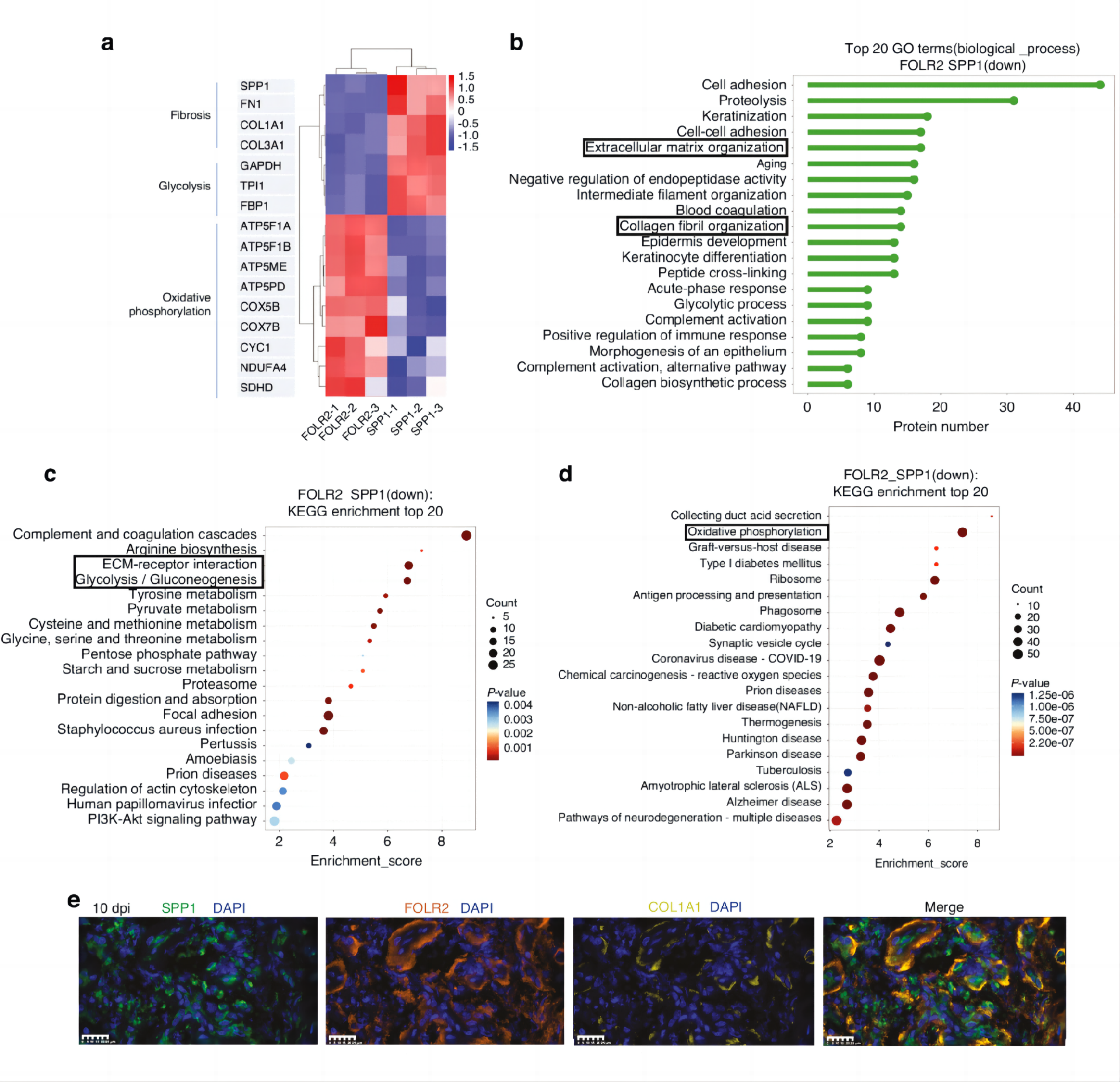
图6 :SPP1+巨噬细胞和FOLR2+巨噬细胞的蛋白质组学和免疫荧光
他们发现,多个氧化磷酸化相关蛋白包括ATP合成酶F1亚基α (ATP5F1A)等,在FOLR2+巨噬细胞中上调(图6a)。且FOLR2+巨噬细胞的氧化磷酸化水平上调(图6d),这些提示我们FOLR2+巨噬细胞的抗纤维化特性可能是通过其高度活跃的氧化磷酸化特性实现的。此外,MP3在正常肌腱周组织中占很大比例,MAPK信号通路在肌腱损伤后三个阶段均下调,而在MP3中上调,这些可能是支持MP3通过MAPK信号通路抗纤维化的另一证据。此外,免疫荧光实验也显示在10 dpi处胶原周围存在人FOLR2+巨噬细胞,标记为SPP1(绿色),FOLR2(橙色),COL1A1(胶原标记物,黄色),DAPI(蓝色)(图6e)。
综上所述,该研究表明,肌腱粘连组织中的FOLR2+巨噬细胞起源于单核细胞,在肌腱粘连过程和肌腱损伤后修复的三个阶段均表现出抗纤维化表型。氧化磷酸化或MAPK信号通路是解释这种抗纤维化表型的潜在途径。我们的研究结果表明,FOLR2+巨噬细胞有助于防止人类肌腱粘连过程中的过度纤维化。
7.ACKR1参与了FOLR2+巨噬细胞的迁移
最近有研究表明ACKR1可以支持单核细胞迁移,因此,他们利用谱系示踪小鼠、诱导型Cre小鼠模型和全基因敲除小鼠的骨髓移植来验证抗纤维化簇与内皮细胞之间的关系。
他们将来自Lysm-Cre的R26RtdTomato小鼠的骨髓移植到致命辐射的Ackr1−/−缺陷小鼠和对照小鼠(WT嵌合体)体内。免疫荧光分析显示,损伤后14天,Ackr1−/−嵌合体中CD68+FOLR2+单核细胞减少(图7a-d)。该结果表明ACKR1参与了FOLR2+巨噬细胞在肌腱粘连中的迁移。
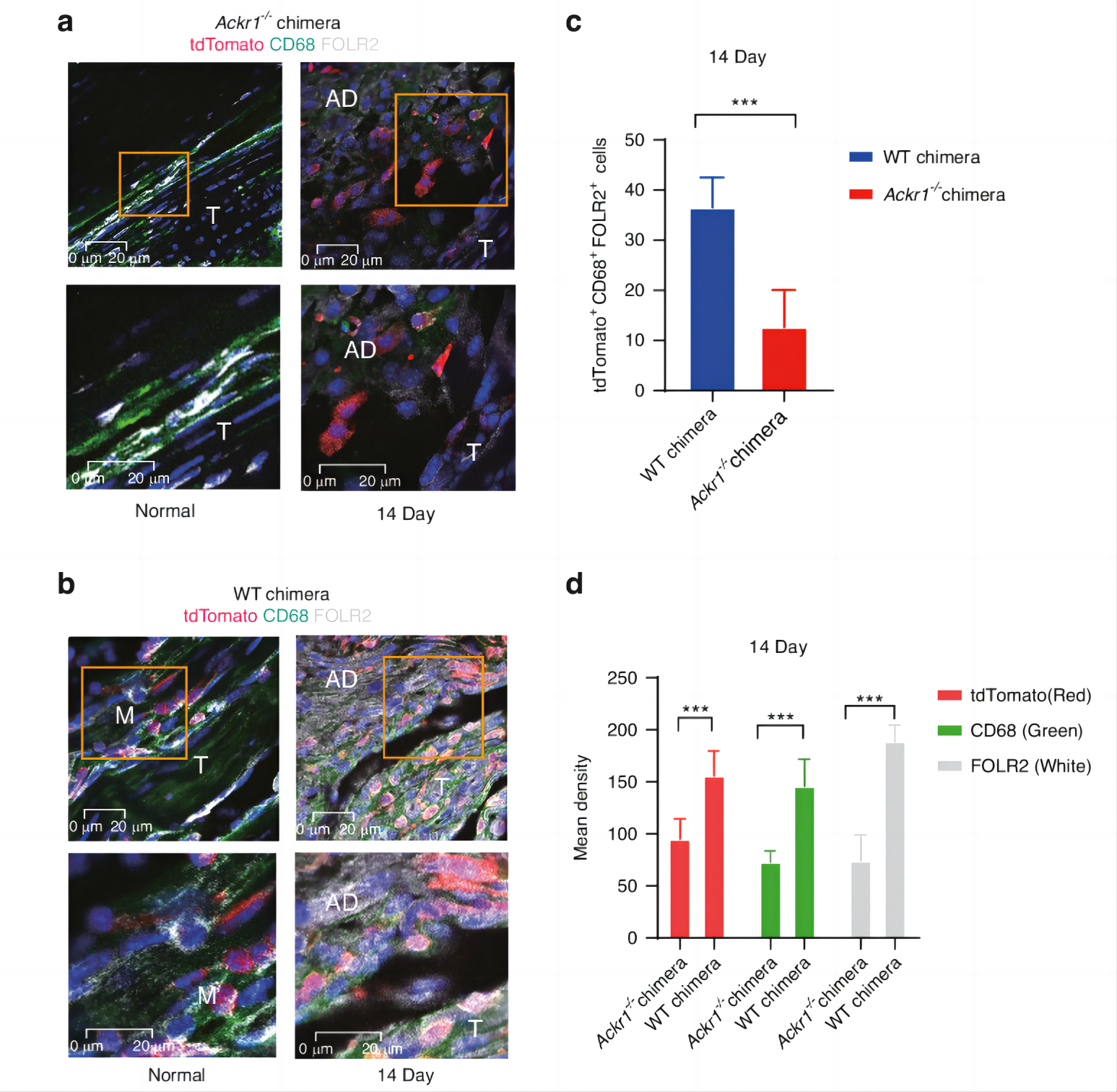
图7:Ackr1−/−和WT嵌合体的免疫荧光图像
其中tdTomato(单核细胞标记物)为红色,CD68(绿色),FOLR2(白色),DAPI(蓝色)。T,肌腱。M,肌肉。AD,粘连组织。图7c展示了细胞数。图7d 展示了平均免疫荧光密度。
8.人肌腱粘连组织中的多细胞系相互作用
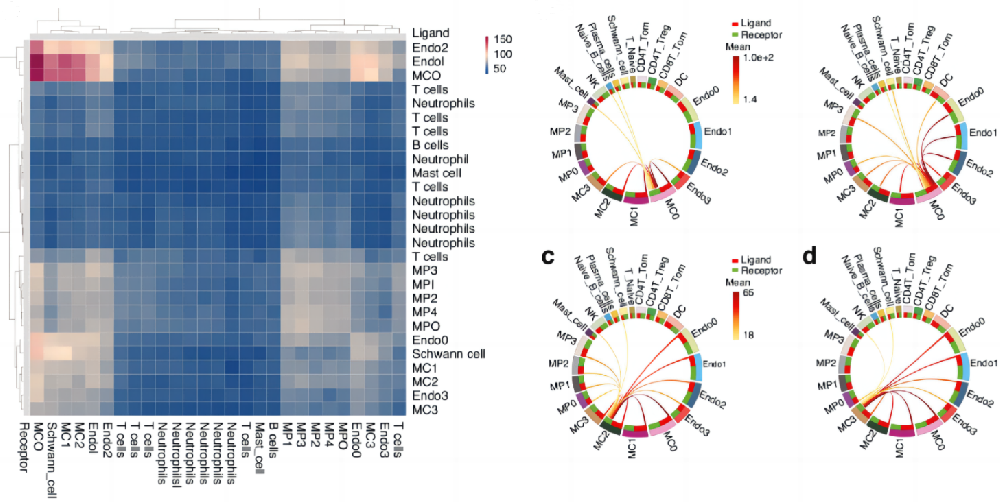
最后,研究者们利用cellphoneDB软件分析了此前的单细胞数据,并发现人类肌腱粘连组织中ENDO1、ENDO2和MCs之间频繁的细胞相互作用(图8a)。
弦图显示,在肌腱粘连的每个阶段,ENDO1、ENDO2和MC0之间存在强烈的细胞相互作用(图8b)。图8c、d也展示了MPs、ECs和MCs在10 dpi阶段与MC2、MC3的相互作用点(图8c)。此外,ENDO1表达高水平配体PDGFB,并与MC0上的受体血小板源性生长因子受体α(PDGFRA)和血小板源性增长因子受体β(PDGFRB)相互作用(图8e)。
结合此前的免疫荧光图像相,研究者们发现PMT可能发生在人类肌腱粘连中,受SPP1+巨噬细胞、RGCC+ ECs和ADAM12+多能基质细胞的调节。
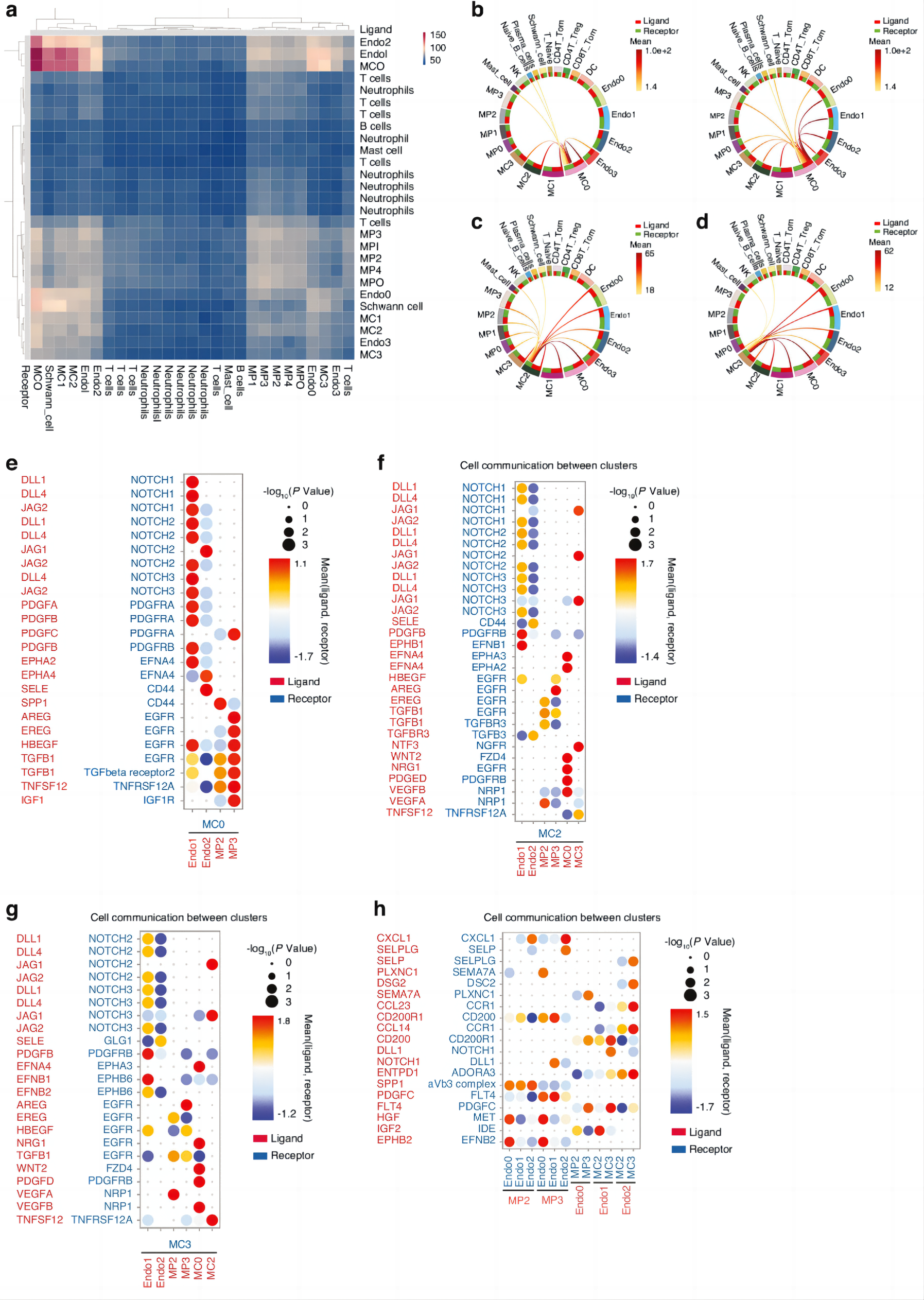
侧边为配体名,底部为受体名。图8b、c、d分别是 10 dpi时MC0、MC2、MC3与其他簇相互作用的弦图(红色,高;黄色,低)。图8e-h中圆圈大小表示P值,点越大,P值越高。
9、总结
ACKR1+ ECs和FOLR2+巨噬细胞分别被鉴定为抗纤维化和纤维化表型。有趣的是,ACKR1+ ECs参与了FOLR2+巨噬细胞在肌腱粘连中的迁移。
虽然存在一些缺陷,比如样本数量有限、还应考虑肌腱损伤后的更多的时间点等。
但总的来说,该研究主要通过鉴定由ACKR1迁移的FOLR2+巨噬细胞为腱周抗纤维化巨噬细胞,展示了人类肌腱粘连组织在不同阶段的的纤维化微环境,揭示了一个清晰的集群和新的人类肌腱粘连机制。它们可作为今后治疗人肌腱粘连的潜在靶点。
 技术咨询:
技术咨询: