多组学联合网络药理学分析揭示石杉碱甲可作为糖尿病肾病的潜在治疗药物
2024-09-23
亮点
1. 结合多组学研究石杉碱甲对糖尿病肾病的保护作用。
2. Apoe可能是多组学和多层次糖尿病模型的潜在靶点。
3. DN患者Apoe水平与肾功能、血脂、炎症相关。
4. 携带si-Apoe基因的足细胞炎症程度低,黏附力强,生存能力强。
5. 综合数据证实HupA在DN中的多通路保护作用。
摘要
糖尿病肾病(DN)是糖尿病(DM)的主要并发症,目前尚无治疗干预措施。石杉碱甲(Hup A)是一种天然生物碱,具有显著的降血糖和抗炎作用。研究者们以链脲佐菌素(Streptozotocin,STZ)诱导的糖尿病大鼠为DN模型,结合转录组、代谢组、微生物组和网络药理学(network pharmacology, NP)进行联合分析。检测石杉碱甲对DN(即尿蛋白、肾组织结构)的总影响,并进一步在糖尿病患者、db/db小鼠和细胞水平上验证差异基因。
最终发现石杉碱甲的干预可减轻DN大鼠肾损伤,实验结果提示通过调节脂质代谢、微生物稳态和细胞凋亡可有效治疗DN。
结果1:Hup A减轻DN大鼠肾损伤
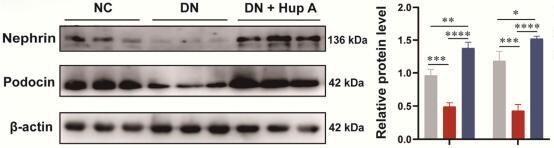
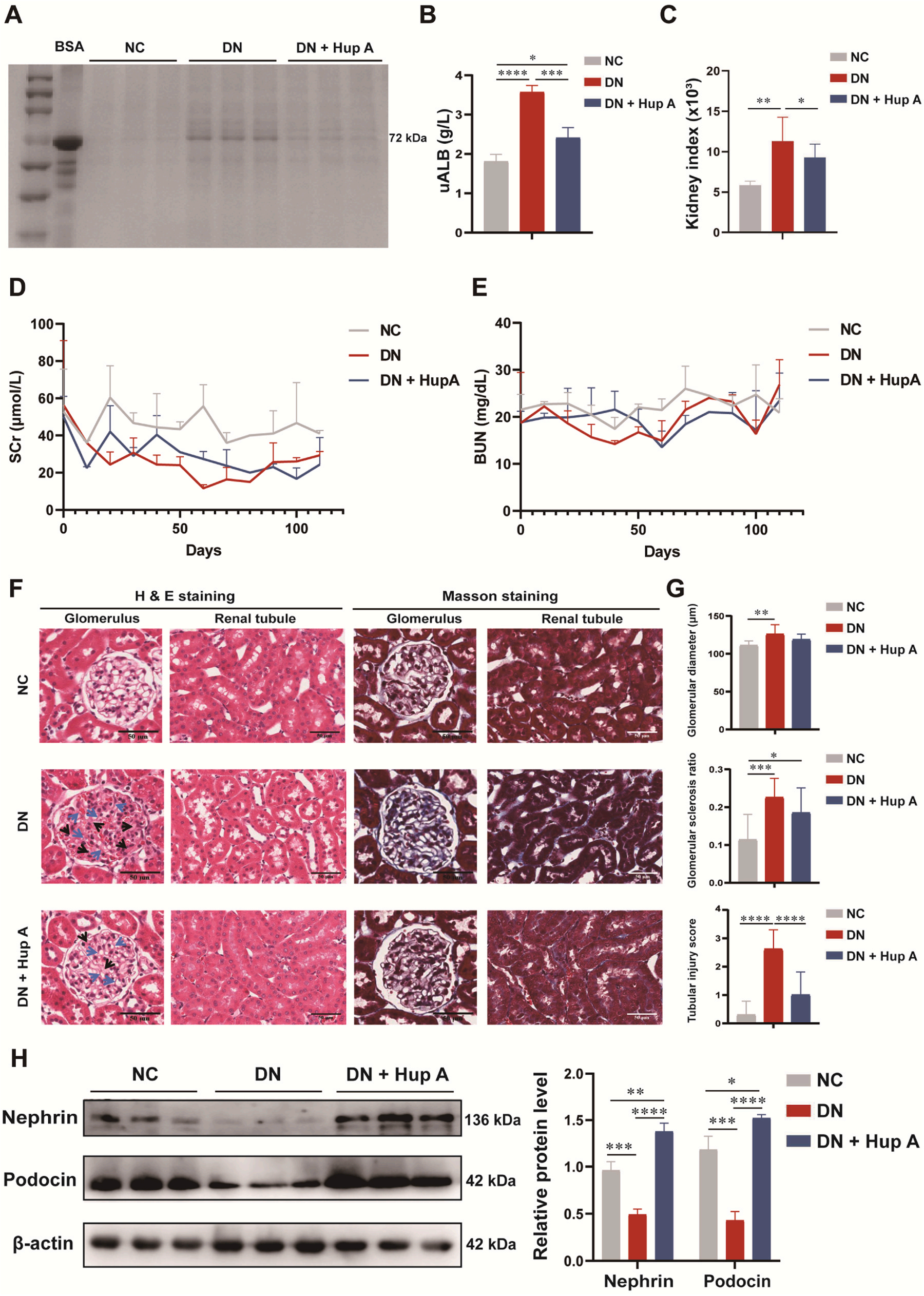
图1A展示了研究者们对各组大鼠肾脏尿蛋白含量测定。结果显示Hup A治疗显著降低尿蛋白含量(图1A-B)。同时,Hup A治疗后肾脏指数明显下降(图1C)。DN组大量蛋白尿导致的高肾小球滤过可能与低Scr水平有关(图1D)。三组间BUN差异无统计学意义(图1E)。对大鼠肾组织进行H&E和Masson染色,评价Hup A处理对DN大鼠的组织学和形态学影响(图1F),H&E染色显示DN组肾小球基底膜增厚,系膜基质增加,肾小管空泡化。马松染色显示DN组肾小球内纤维化病变,小管腔及间质纤维化改变。此外,在肾小球直径、肾小球硬化率和肾小管损伤评分方面,Hup A治疗明显减轻了肾小球和小管的损伤(图1G)。Western blotting进一步测定维持正常肾小球滤过功能所必需的nephrin和podocin蛋白水平。如图1H所示,DN组nephrin和podocin均显著下调(p < 0.05),而Hup A处理逆转了二者的下调。
结果2:Hup A治疗对肾脏转录组的影响
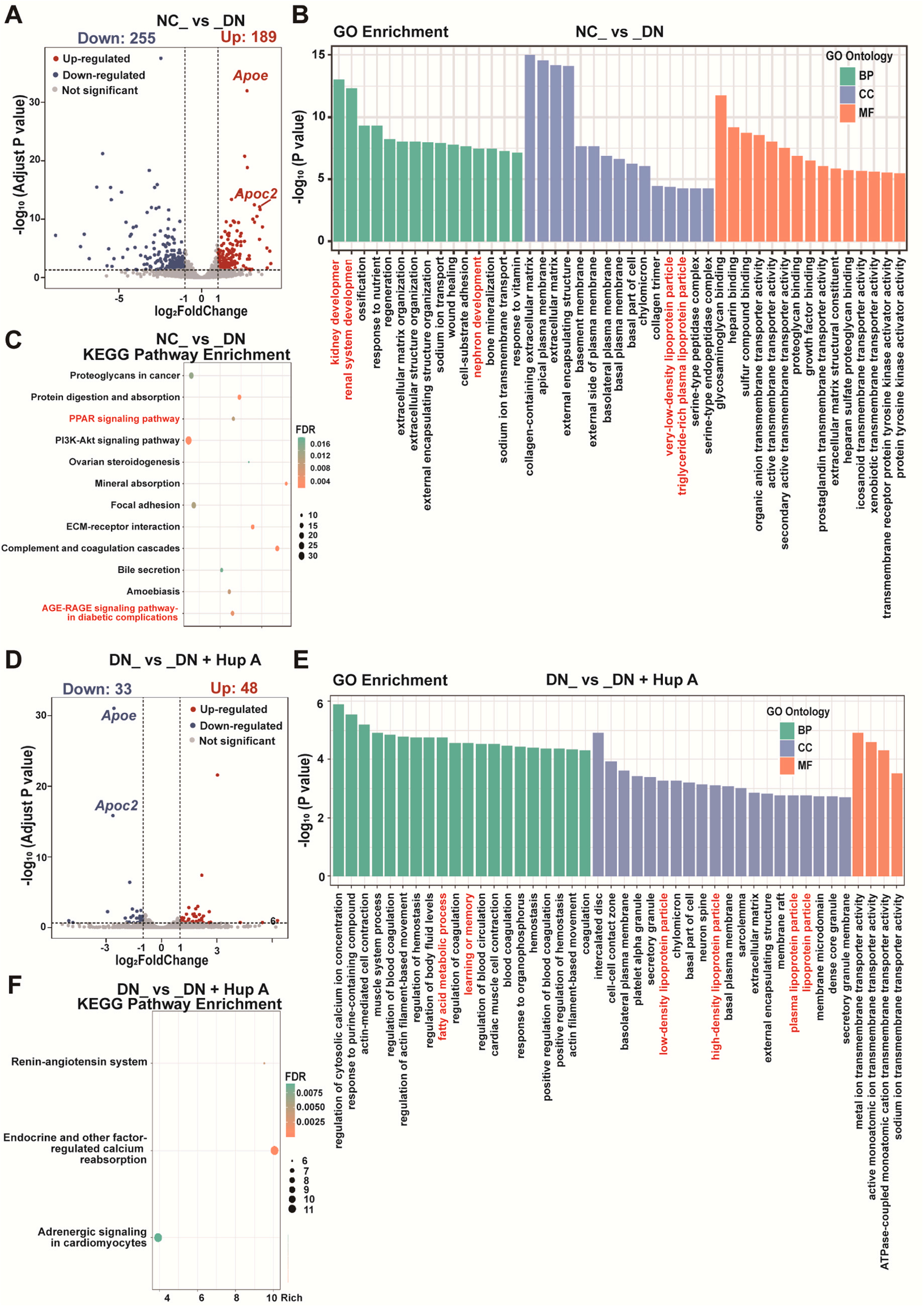
为了深入研究Hup A治疗DN的分子机制,研究者进行了转录组测序并分析其中的差异表达基因(DEGs)。如图2A所示,与DN相比,他们在NC中发现了444个deg,其中255个下调,189个上调。与Hup A + DN组相比,DN组出现了81个deg,包括33个下调基因和48个上调基因(图2D)。值得注意的是,在DN组中观察到Apoe和Apoc2的显著上调,并且在Hup a处理后这种上调显著降低。而图2B则显示了 NC组和DN组之间DEGs的GO富集分析类型,主要富集肾脏发育、肾系统发育、肾元发育和脂质代谢过程(包括极低密度脂蛋白颗粒和富甘油三酯血浆脂蛋白颗粒)。NC组和DN组之间KEGG通路富集分析结果如图2C所示,与DN组相比,NC组糖尿病并发症的PPAR信号通路和AGE-RAGE信号通路明显富集。其中,在NC与DN和DN与DN + Hup A的比较中,脂质代谢过程被富集,表明Hup A处理对DN大鼠脂质代谢有显著影响(图2E-F)。
结果3. Hup A治疗对肾脏代谢组的影响
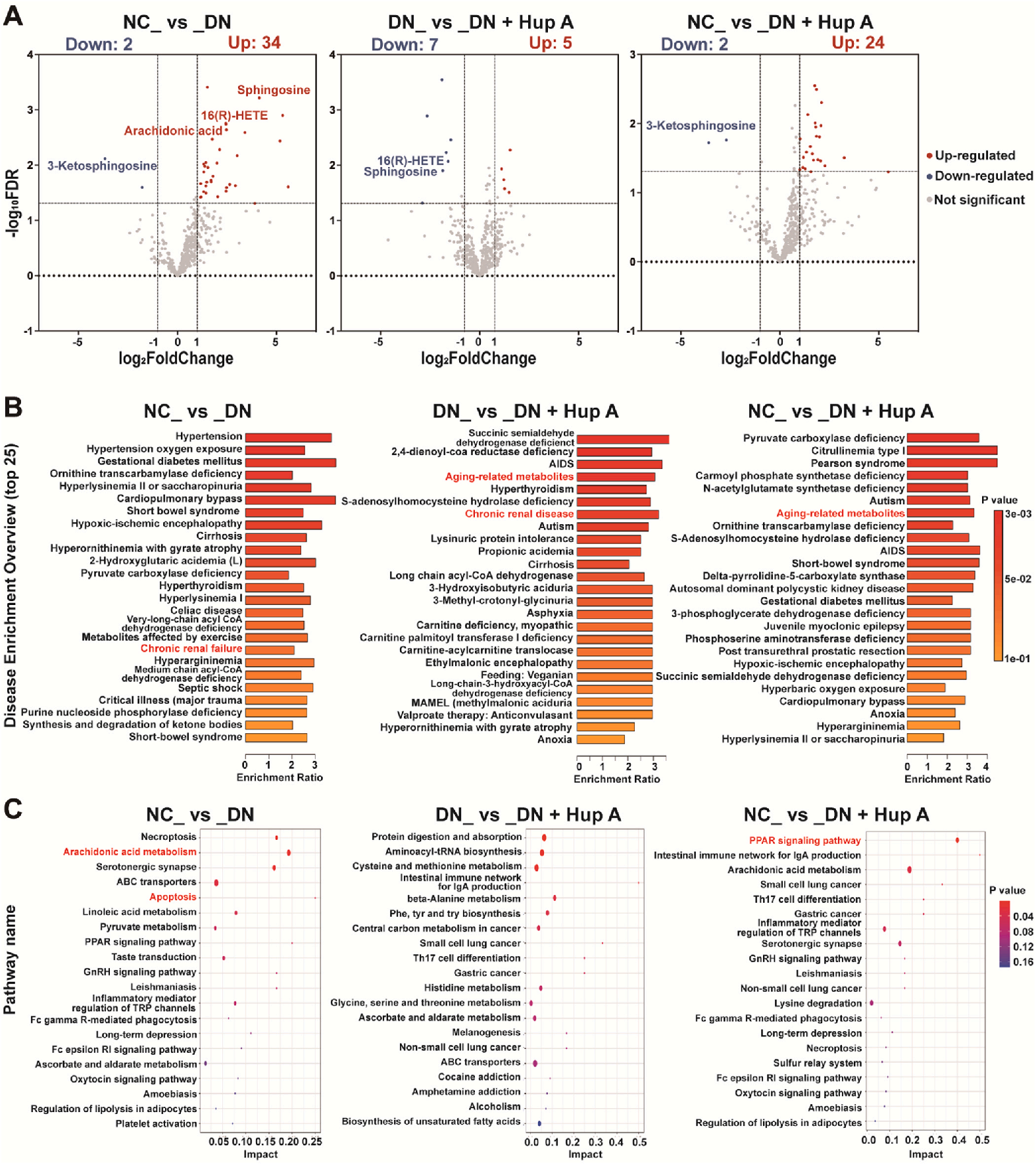
接着,研究者们采用非靶向代谢组学分析Hup A治疗对肾脏代谢组的影响,通过主成分分析(PCA)和偏最小二乘判别分析(PLS-DA)分析研究肾脏代谢变化。发现NC组和DN组的样品具有明显的分散性,而DN + Hup A的分布更接近NC组。这提示了Hup A治疗能恢复DN大鼠的代谢。通过比较NC组和DN组之间的36种差异代谢物,发现有34种代谢物上调,2种代谢物下调。其中,鞘氨醇、16(R)-HETE和花生四烯酸(AA)在DN组中显著上调,而Hup A处理后,鞘氨醇和16(R)-HETE又显著下调,说明这些物质可能参与了Hup A治疗DN的机制(图3A)。
随后通过对比KEGG通路数据库,研究者们确定了相关的疾病通路、代谢通路和信号通路。图3B显示了前25个富集的疾病通路,包括慢性肾功能衰竭、慢性肾脏疾病和衰老相关代谢物,这表明Hup a在DN中具有保护作用。图3C显示了前20个富集的代谢途径和信号通路,主要是AA代谢、凋亡和PPAR信号通路。因此,Hup A对DN的缓解作用可能与这些途径有关。

结果4. Hup A治疗对肠道微生物组的影响
为了评估Hup A处理对肠道菌群的影响,研究者们采用16S rRNA测序,通过在多个时间点(第0天,第50天和第100天)收集粪便样本,以跟踪肠道微生物群在DN进展过程中的动态变化。其中,第100天的发现最为关键,如上图4A中, Shannon多样性指数在DN组降低,而在DN + Hup A组升高,说明Hup A处理促进了微生物群多样性。图4B显示了部分优势菌群(门水平)。如图所示图4C所示,Hup A处理使Ruminococcus和Colidexibacter属的丰度增加,在DN组中减少,而使链球菌、Phascolarctobacterium、肠球菌、Blautia和Escherichia-Shigella属的丰度减少,在DN组中增加。
此外,研究者们构建了优势种网络来阐明不同微生物之间的相互作用(前50个OTUs),红线表示正相关,绿线表示负相关(图4D)。在NC组中,乳酸杆菌的丰度非常高。相比之下,葡萄球菌和Phascolarctobacterium的丰度极低。有趣的是,葡萄球菌和Phascolarctobacterium与乳酸杆菌呈负相关。在NC组中,Blautia的丰度也极低,但与乳酸菌呈正相关。此外,研究者们将16S测序结果与KEGG和MetaCyc数据库相结合进行功能预测。图4E显示了KEGG预测的二级功能通路,其中氨基酸、碳水化合物和脂质代谢显著富集。图4F显示了MetaCyc预测的二级功能通路,其中氨基酸生物合成、脂肪酸和脂质生物合成以及糖酵解的富集显著。这些结果表明,Hup A可能通过调节肠道菌群组成和涉及碳水化合物、脂质和氨基酸的关键代谢过程来发挥DN保护作用如图S2E所示,随着时间的推移,NC组Shannon指数呈上升趋势,DN和DN + Hup A组呈下降趋势,但差异无统计学意义。
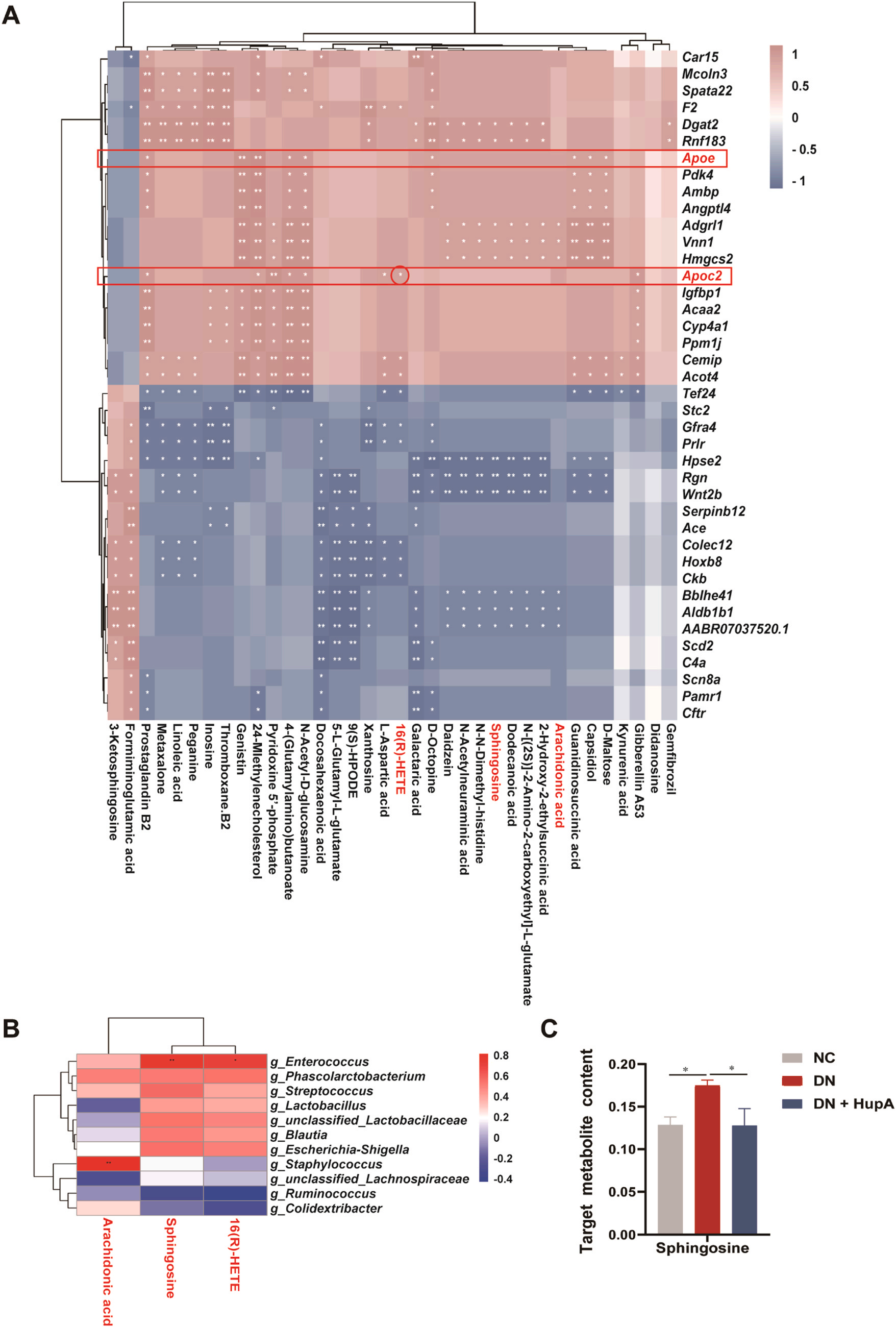
结果5. 微生物组、代谢组和转录组的综合分析
为了阐明deg和代谢物之间的联系,研究者们对代谢组和转录组进行了Spearman相关分析(图5A)。其中,他们特别关注Hup A治疗后显著下调的关键基因(Apoe和Apoc2)与脂质代谢生物标志物(鞘氨醇、16(R)- HETE和AA)之间的相关性。结果表明,Apoe、Apoc2、AA和鞘氨醇与16(R)-HETE呈显著正相关,而Apoe、Apoc2和鞘氨醇之间无显著相关。
通过对代谢组和微生物群进行Spearman相关分析,以确定代谢物与微生物群组成(属水平)之间的关系。他们注意到鞘氨醇、16(R)-HETE、AA和不同微生物群之间的相关性。如图5B所示,AA与葡萄球菌呈显著正相关。鞘氨醇和16(R)-HETE与肠球菌呈显著正相关,与链球菌、Phascolarctobacterium、Blautia和Escherichia-Shigella呈显著正相关,与Ruminococcus和Colidexribacter呈负相关。通过针对鞘氨醇的质谱检测,他们发现经Hup A处理后,DN中鞘氨醇含量升高,恢复到对照水平(图5C)。

结果6. 生物医学实验验证
为了进一步探究在更多样本中的情况,研究者们在大鼠和小鼠疾病模型、临床DN样本和高血糖细胞模型中均进行了验证。首先他们通过qRT-PCR验证了Apoe和Apoc2的mRNA水平,并通过WB验证了糖尿病大鼠肾组织中Apoe的蛋白水平,结果与转录组学数据一致(图6A-B)。此外,Apoe和Apoc2的免疫荧光染色在糖尿病大鼠、db/db小鼠组、糖尿病肾病患者肾小球和肾小管中均表现为高信号(图6C、E、F)。Hup a处理后,大鼠肾组织切片荧光信号减弱(图6C),高糖肾细胞模型中也出现同样的趋势(图6D)。
QP和WB对si RNA效率的验证见图7E-F。此外,细胞模型中的si-Apoe可以改善高糖引起的炎症状态(图7G)。此外,在补充材料中,研究者们也提供了Hup A可以改善糖尿病大鼠的高甘油三酯血症的证据。
综上所述,这些实验数据证明了Apoe作用于Hup A对DN的保护。由于他们的目标是进一步探索Apoe作为临床治疗靶点的潜力,接下来研究者们进行一些列临床方面的评估。
摘结果7. 临床评估
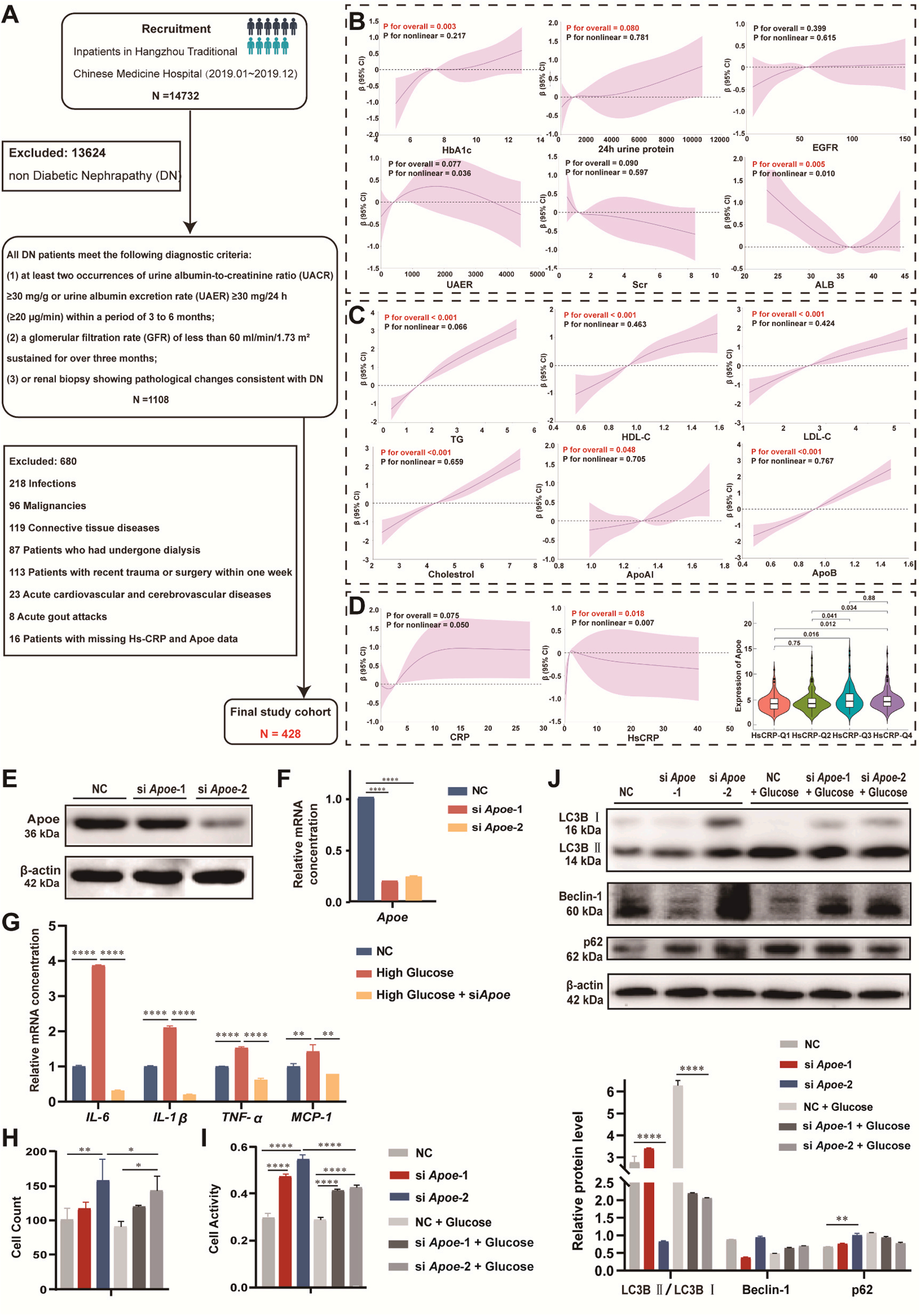
对于本项研究,如何去评估Apoe在临床实践中的适用性以及评估Hup A作为治疗方案的可行性是非至关重要的,因此首先需要了解Apoe与DN相关生物标志物的临床相关性。为了弥补这一空白,研究者们分析了Apoe表达与DN患者各种临床生物标志物之间的关系。共纳入428例DN患者并进行进一步分析(图7A)。原文中表2提供了临床生物标志物与Apoe表达水平之间的关系数据。
作为血糖控制水平的指标,HbA1c与Apoe呈正相关,说明Apoe的表达随着HbA1c水平的升高而升高。在肾功能方面,高蛋白尿时Apoe表达与24 h尿蛋白水平呈强正相关,提示随着蛋白尿的升高,Apoe表达也随之升高。Apoe与EGFR、UAER、Scr的相关性较弱,无统计学意义。ALB与Apoe呈显著的非线性相关(图7B)。
由于Apoe是脂质代谢的关键角色,研究者们也研究了Apoe表达与脂质谱的关系。研究结果显示,Apoe的表达与脂质相关的生物标志物,包括TG、HDL-C、LDL-C、胆固醇、ApoAI和ApoB之间存在显著的正相关(图7C),其中大多数关系具有统计学意义(p < 0.001)。
此外Apoe和炎症标志物之间也存在相关性。结果表明,Apoe表达与HsCRP水平之间存在显著的整体相关性(p为总体= 0.018),并存在显著的非线性关系(p为非线性= 0.007)。通过小提琴图来可视化四组HsCRP中Apoe的表达(图7D)。可以看到Apoe的表达从最低到最高HsCRP组逐渐增加,部分组间差异显著。这些发现充分展示了不同炎症水平下Apoe表达的动态变化。
为了研究Apoe在DN中的作用,研究者们使用si-Apoe转染HPC(图7E-F)。发现Apoe的敲低导致炎症减少,细胞粘附增加,细胞活性升高(图7G - I)。Western blot结果显示,与NC组相比,si-Apoe组自噬体标志物LC3B II/LC3B I蛋白表达明显降低,说明葡萄糖诱导了更高的自噬水平,而si-Apoe降低了自噬水平。另一种自噬maker Beclin-1也表现出葡萄糖处理后较低,而siApoe处理后较高的趋势。此外,由于LC3B I螯合p62聚集体,自噬受损时p62会发生聚集。而实验结果显示si-Apoe后足细胞中的p62聚集体增多。这些实验结果一致表明APoe敲低后HPC自噬水平降低(图7J),故而可推测Hup A是通过调节Apoe表达来防止过度自噬和细胞凋亡来减轻这些影响的。
在原文的补充结果部分,研究者们也进行更多生信联合分析和分子水平的实验验证其中的药物-疾病靶点,探讨Hup A治疗DN的潜在分子机制,证实了Hup A处理通过控制细胞凋亡来改善。
总结
综上所述,Hup A通过调节转录组、代谢组和微生物群,在减轻DM引起的肾损害、脂质代谢紊乱和炎症方面显示出良好的治疗效果(图1)。结合肾脏转录组和代谢组分析进一步发现,Hup A主要改变脂质代谢关键基因Apoe和Apoc2的转录水平,并调节脂质代谢标志物sphingosine、16(R)-HETE和AA的丰度。此外,Hup A有效改善了DN引起的肠道菌群失调。Spearman的相关分析显示,脂质代谢标志物与肠道微生物群相关。本研究首先详细评估了多种模型(糖尿病大鼠、糖尿病小鼠、糖尿病患者、高血糖细胞模型)中Apoe和Apoc2在DN中的表达,提示Hup a可能通过调节Apoe表达参与DN的保护。临床数据显示Apoe作为DN的生物标志物和潜在靶点的潜力。细胞水平的研究进一步阐明了Apoe基因敲低对足细胞的保护作用。
展望未来,类似本文这类通过多组学和基础医学实验相结合,开展纵向研究监测患者临床生物标志物的动态变化将是至关重要的。武汉灵思生物致力于助力基础科研,公司秉承“求真、严谨、勤奋、创新”的科研理念,助力生命科学研究领域新的突破,为生物技术发展持续创造价值。
文章来源
Huperzine A targets Apolipoprotein E: A potential therapeutic drug for diabetic nephropathy based on omics analysis - ScienceDirect
浙江大学医学院附属儿童医院肾内科 胡丽丹研究员
 技术咨询:
技术咨询: