肠道健康新发现:神经免疫的关键作用
2024-09-30
在上一篇推文中,我们深入探讨了肠道微生物的神奇力量,揭示了微生物群-肠-脑轴如何影响我们的情绪和健康。今天,我们将延续这一话题,进一步探索神经免疫领域的奥秘。正如我们所知,肠道微生物通过复杂的微生物群-肠-脑轴与我们的神经系统相互作用,但这只是冰山一角,让我们揭开神经免疫相互作用的神秘面纱,深入了解这一领域的最新研究进展。从神经免疫的背景知识到肠道的神经免疫构成,再到神经元与免疫细胞之间的分子机制,我们将一一解读这些复杂的相互作用如何影响我们的健康。
关键词:神经免疫相互作用,肠道免疫调节,肠道屏障功能,微生物-肠-脑轴
1.背景知识
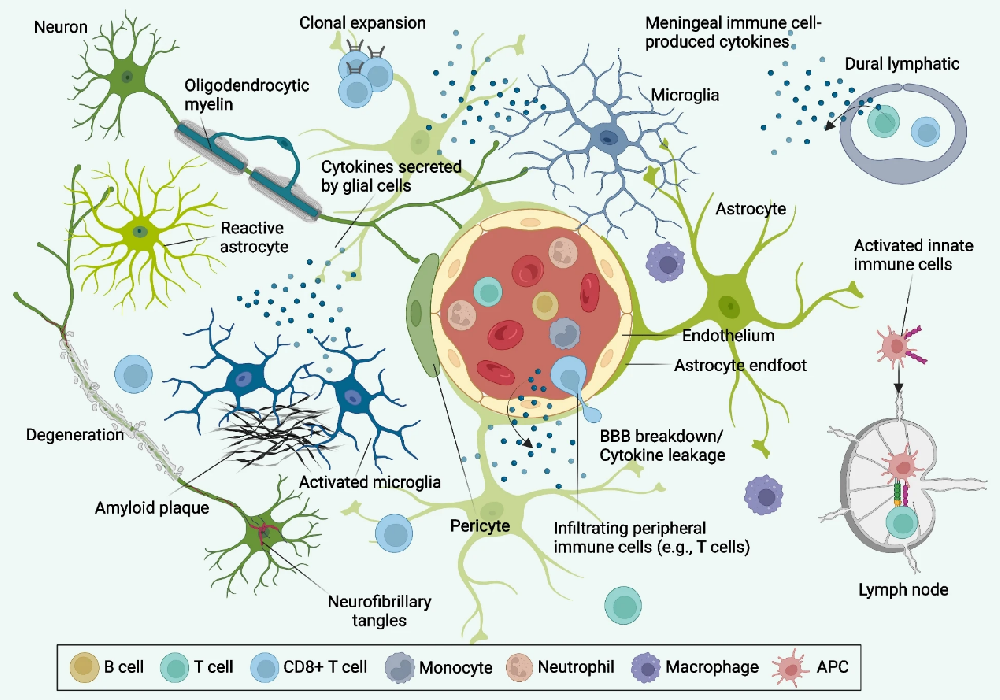
图1:神经免疫概览
神经免疫是近年来生物医学研究中最为活跃和创新的领域之一。其核心在于探索神经系统和免疫系统之间的复杂相互作用及其在健康和疾病中的作用。神经系统,由大脑、脊髓以及广泛分布的神经网络组成,负责处理和传递身体内外环境的信息。免疫系统则是机体的防御系统,保护身体免受病原体侵害,并参与损伤修复和维持内部平衡。传统上,这两个系统被认为是独立运作的,但现代研究发现它们之间存在着密切的交流和调节机制。
神经系统通过多种方式影响免疫反应。神经递质,如乙酰胆碱、多巴胺和去甲肾上腺素等可以直接作用于免疫细胞上的相应受体,调节免疫细胞的活性。此外,神经系统通过产生和释放神经肽如P物质、神经生长因子和脑源性神经营养因子等,对免疫细胞进行调控。反过来,免疫系统也能通过分泌细胞因子,如白细胞介素、肿瘤坏死因子和干扰素等,影响神经系统的功能,这些细胞因子作用于神经细胞,改变神经信号的传递,甚至影响神经细胞的生存和死亡。在某些情况下,免疫细胞还能直接与神经细胞接触,形成局部的免疫-神经相互作用网络。
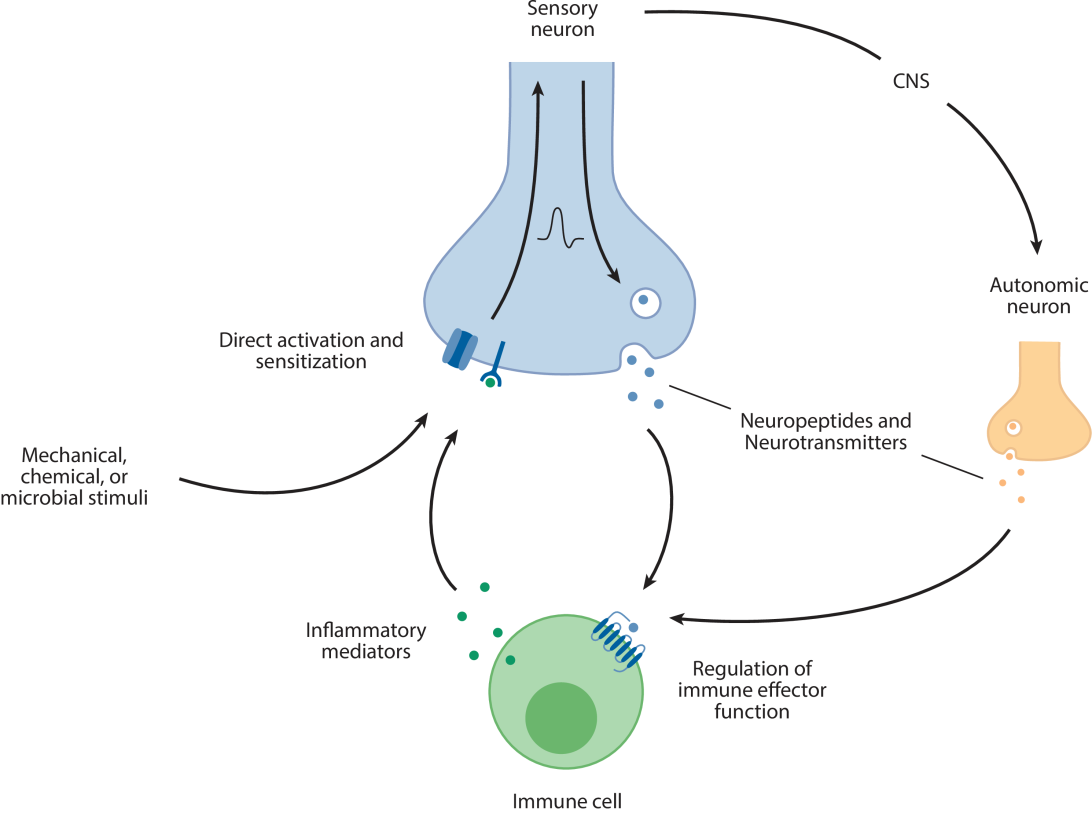
图2:神经免疫作用机制
在这些复杂的相互作用中,肠道内的神经免疫调节尤其引人注目。肠道作为人体最大的免疫器官,包含大量的免疫细胞,并且与大量的肠道微生物共生。这些微生物通过与肠道神经系统的相互作用,影响肠道免疫细胞的活动,进而影响全身的免疫状态。例如,肠道微生物能够通过产生代谢产物,来影响肠道内神经细胞的功能,进而调节肠道免疫细胞的活性。这种微生物-肠-脑轴的相互作用对于维持肠道免疫稳态和预防肠道相关疾病具有重要作用。此外,肠道内的神经免疫调节还涉及到肠道屏障功能的维护。肠道屏障不仅阻止病原体和有害物质的侵入,还调节营养物质的吸收和免疫细胞的迁移。神经系统通过调节肠道屏障功能,影响肠道内环境的稳定,进而影响全身的免疫状态和健康。
2.肠道的神经免疫构成
肠道由小肠和大肠组成,包含上皮层、固有层、粘膜下层和肌层等不同层次结构。这些层次由内在和外在神经元类型所支配,其中内在神经元的细胞体位于粘膜下神经丛和肌间神经丛。粘膜下神经丛包含内在初级感觉神经元(IPANs)以及分泌运动神经元/血管扩张神经元,它们支配粘膜,调节分泌和血管舒张;肌间神经丛包含IPANs、中间神经元以及兴奋性和抑制性肌肉运动神经元,这些神经元支配肌层以协调肠道运动(图3a)。

图3:肠道的内在和外在神经支配
肠道还受到多种外在感觉和运动神经元的支配,其细胞体位于肠道外部。迷走神经感觉传入神经元的细胞体位于结状神经节和颈神经节,通过迷走神经投射到小肠和近端结肠。脊髓感觉传入神经元的细胞体位于背根神经节(DRGs),投射到小肠和结肠或远端结肠和直肠。交感神经传出神经元起源于胸腰髓,投射到椎旁和腹前神经节,在那里它们与支配小肠和结肠的神经元形成突触。副交感神经传出神经元起源于迷走神经背侧运动核(DMV)和疑核(NA)或骶髓。DMV和NA神经元通过迷走神经支配小肠和近端结肠,而骶髓神经元支配结肠(图3b)。
3.神经元调控免疫细胞的分子机制
神经元通过调节免疫细胞的功能来调控肠道疾病和肠道感染。肠道内分布着多种免疫细胞,它们位于不同的区域,如上皮内淋巴细胞位于上皮层,而固有层则包含天然淋巴样细胞(ILCs)、嗜酸性粒细胞、肥大细胞、巨噬细胞、树突状细胞(DCs)、T细胞和IgA产生浆细胞。这些免疫细胞表达特异性受体,能够识别神经递质和神经肽,从而响应不同神经元亚型产生的介质。
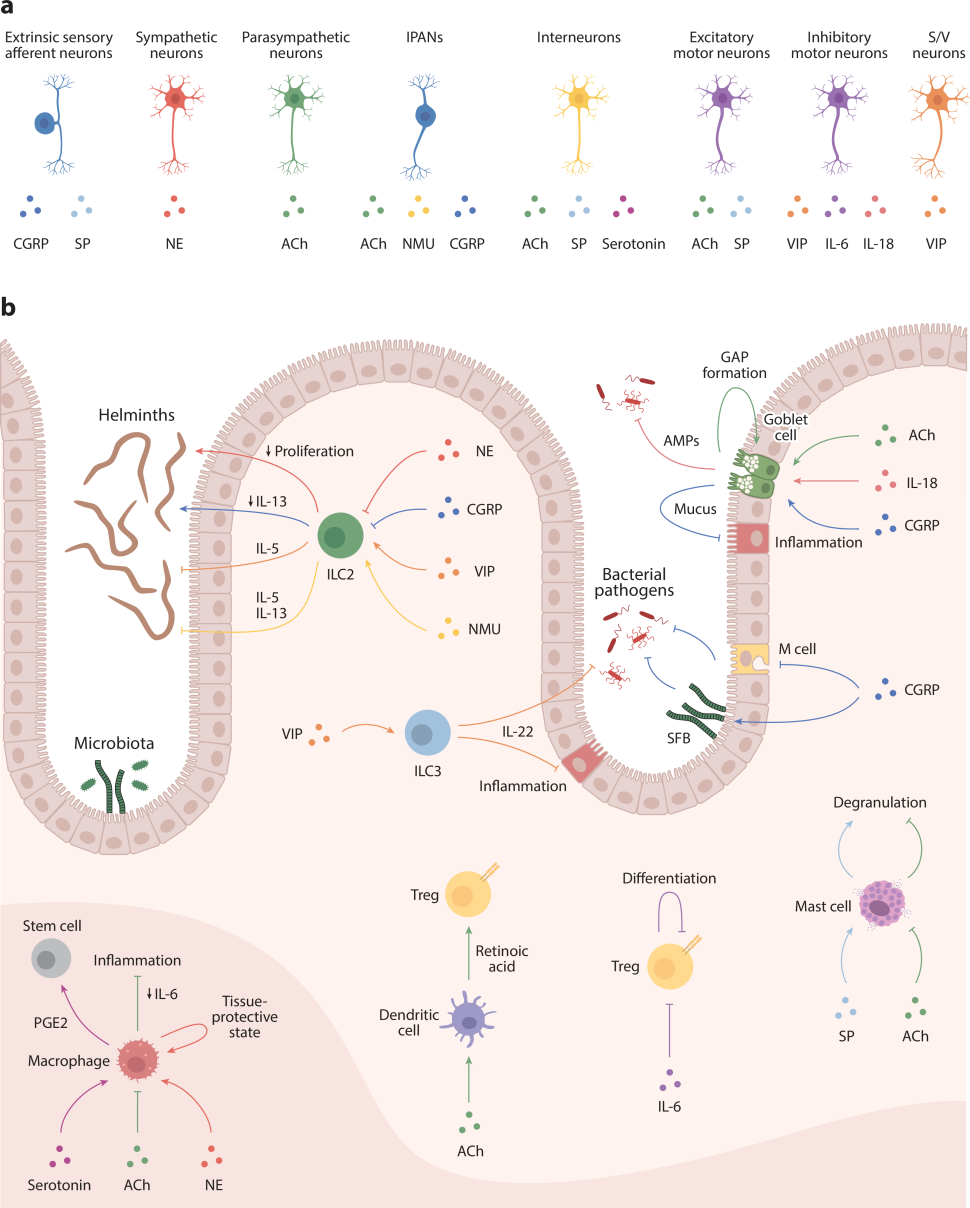
图4:神经元对免疫细胞功能的调控
背根神经节的感觉神经元表达降钙素基因相关肽(CGRP)和P物质(SP),交感神经节后神经元释放去甲肾上腺素(NE),而副交感神经节后神经元释放乙酰胆碱(Ach);肠神经系统内的IPANs表达胆碱乙酰转移酶(ChAT),参与ACh、神经介素U(NMU)和CGRP的合成;肠内中间神经元和运动神经元分别表达ChAT、SP或5-羟色胺,兴奋性运动神经元表达ChAT和SP,抑制性运动神经元则表达血管活性肠肽(VIP)和IL-6;此外,VIP也表达于分泌运动/血管扩张神经元,而IL-6和IL-18则由不同类型的肠神经元表达(图4a)。
NMU和VIP促进2型天然淋巴细胞(ILC2)细胞因子产生,有助于蠕虫的排出;CGRP负向调节IL-13表达,NE抑制细胞增殖,减弱抗蠕虫反应;VIP促进3型天然淋巴细胞(ILC3)产生IL-22,减少细菌感染和肠道炎症;NE诱导组织保护性巨噬细胞,而ACh抑制巨噬细胞产生IL-6,减轻肠道炎症;5-羟色胺促进巨噬细胞释放前列腺素E2(PGE2),促进干细胞更新;ACh则促进树突状细胞产生视黄酸,有助于调节性T细胞(Treg)的生成,而神经元产生的IL-6抑制Treg细胞的分化;SP和ACh分别促进和抑制肥大细胞脱颗粒;神经肽和神经递质还调节上皮细胞功能,CGRP减少M细胞密度,并促进分段丝状细菌(SFB)增殖,抵抗细菌感染,促进杯状细胞粘液释放,限制结肠炎期间的肠道炎症;肠神经元产生的IL-18促进杯状细胞产生抗菌蛋白(AMPs),限制细菌感染,ACh诱导形成杯状细胞相关抗原通道(GAPs)(图4b)。
4.免疫细胞调节神经元的分子机制
在肠道炎症期间,免疫细胞通过不同的机制使肠道感觉神经元敏感化。
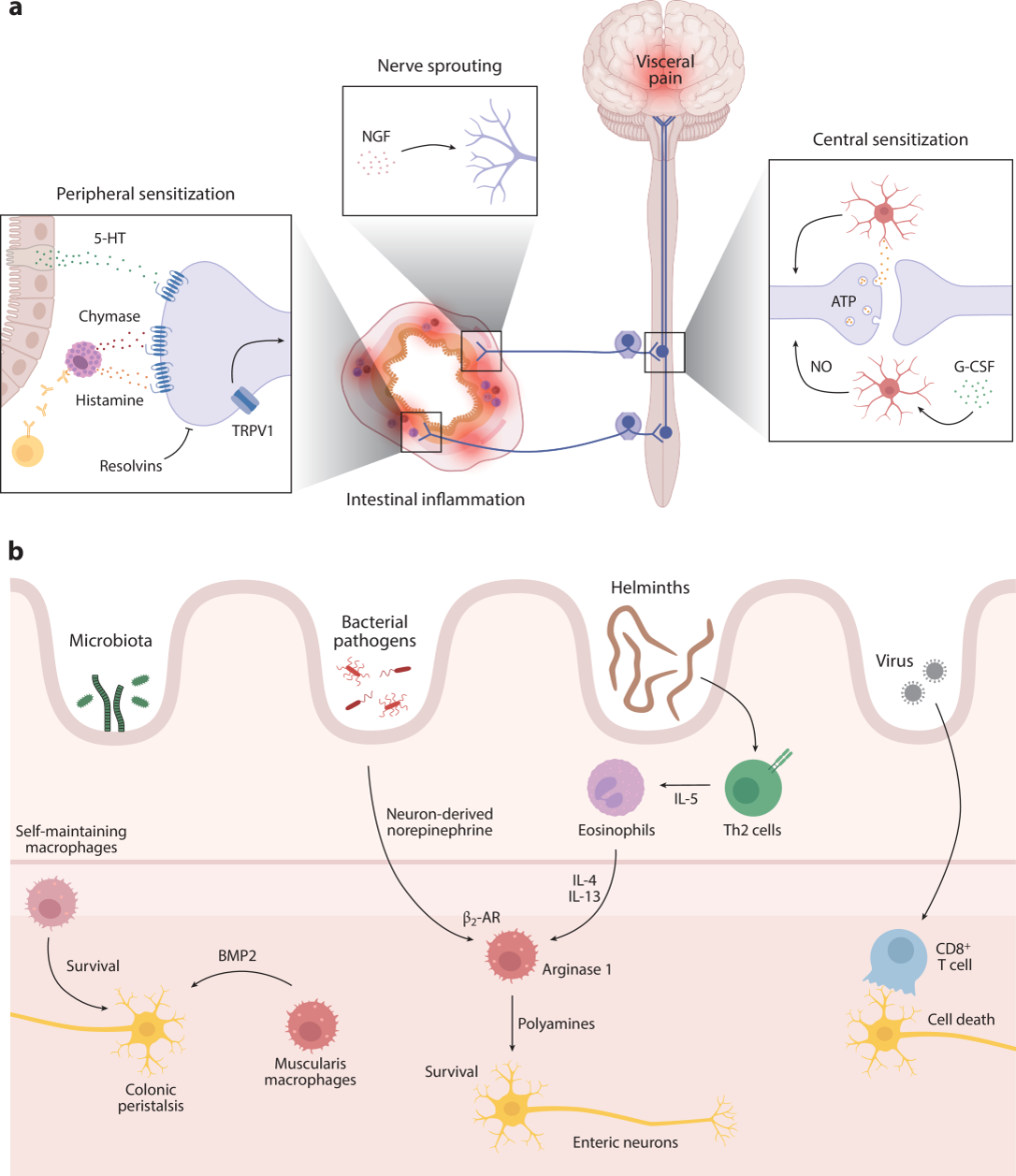
图5:免疫细胞对神经元的调控
肠道炎症通过不同机制引发内脏痛觉敏感化,包括外周敏化、神经芽生和中枢敏化。感觉神经元的外周敏化是由肠嗜铬细胞释放的5-羟色胺(5-HT)以及肥大细胞释放的胰蛋白酶、组胺和其他介质引起的;消退素抑制组胺诱导的瞬时受体电位阳离子通道亚家族V成员1(TRPV1)的敏化;另一种机制是神经芽生,这与神经生长因子(NGF)水平的增加有关;中枢敏化是由小胶质细胞引起的,它们在ATP释放和P2RY12在小胶质细胞上的激活后敏化TRPV1阳性神经元;小胶质细胞还通过一氧化氮(NO)敏化感觉神经元,由粒细胞集落刺激因子(G-CSF)与小胶质细胞上的G-CSFR结合所诱导(图5a)。
自我维持的巨噬细胞支持肠神经元的存活,而肌层巨噬细胞通过分泌骨形态发生蛋白2(BMP2)促进结肠蠕动;在细菌性肠道感染期间,神经元衍生的去甲肾上腺素与肌层巨噬细胞上的β2-肾上腺素能受体(β2-AR)结合,促进精氨酸酶1的表达和多胺的产生,以保护肠神经元;在蠕虫感染期间,辅助性T细胞2型(Th2)衍生的IL-5招募嗜酸性粒细胞,这些细胞通过IL-4和IL-13促进肌层巨噬细胞精氨酸酶1的表达;在病毒感染期间,特异性CD8+ T细胞参与肠神经元的死亡(图5b)。
5.神经免疫领域热点与挑战
(1)通过单细胞RNA测序技术,已在稳态条件下对肠神经元和支配结肠的感觉神经元进行了转录水平的特征分析。然而,这些神经元群体在个体一生中是如何变化,以及它们对炎症或感染刺激有何响应亟待研究;
(2)神经元与免疫细胞之间相互作用是否在不同组织间保守;
(3)神经肽和神经递质对不同类型免疫细胞具有不同的效应。这些不同介质的释放机制仍待研究;
(4)肠-脑轴在不同肠道疾病中扮演何种角色,是否存在连接肠道与中枢神经系统之外的其他器官的神经回路仍待发现;
(5)神经免疫相互作用如何成为治疗的靶点。
参考文献
1. Wallrapp A, Chiu IM. Neuroimmune Interactions in the Intestine. Annu Rev Immunol. 2024;42(1):489-519. DOI: 10.1146/annurev-immunol-101921-042929
2. Yang D, Almanzar N, Chiu IM. The role of cellular and molecular neuroimmune crosstalk in gut immunity. Cell Mol Immunol. 2023;20(11):1259-1269. DOI: 10.1038/s41423-023-01054-5
3. Yu LW, Agirman G, Hsiao EY. The Gut Microbiome as a Regulator of the Neuroimmune Landscape. Annu Rev Immunol. 2022;40:143-167. DOI: 10.1146/annurev-immunol-101320-014237
 技术咨询:
技术咨询: