癌症类器官2.0:体外模拟肿瘤免疫微环境
2024-10-24
肿瘤的发展涉及恶性转化细胞与肿瘤微环境(TME)之间复杂而持续的相互作用。针对免疫TME的癌症免疫疗法在临床试验中得到了越来越多的验证,但不同肿瘤组织学的反应率差异很大,而且往往是短暂的、特异性的,并与耐药性相混淆。模拟患者特异性肿瘤免疫微环境的实验模型,能够探索肿瘤生物学机制和评价免疫治疗效果,将极大地改善患者免疫肿瘤治疗的选择、靶点识别和耐药机制的定义。我们讨论了目前可用的和快速发展的3D肿瘤类器官模型,这些模型模拟了TME的重要免疫特征,并且最终强调基于肿瘤免疫、药物开发和精准医学的类器官研究的各种机会。
1、肿瘤免疫类器官系统定义
类器官是3D干细胞衍生的组织培养物,可以自我组织成离体“微型器官”,并概括了它们在体内对应的许多结构和功能方面。类器官可以由诱导多能干细胞或成体干细胞生成。类器官可以有效地从正常组织和上皮性肿瘤和非上皮性肿瘤(如胶质母细胞瘤、肉瘤或神经内分泌肿瘤)中获得。患者来源的肿瘤类器官允许肿瘤生物学的功能和动态研究和建模,而不是静态的、固定样本的单时间点表征。与2D细胞系相比,类器官细胞系的优势包括更高的衍生率,产生与患者匹配的正常和肿瘤对,更好地保留原始肿瘤特征和患者间变异性,长期培养伴随着结构和遗传完整性,以及生物银行。与患者来源的异种移植模型相比,肿瘤类器官模型更加快速和经济,弥合了细胞系和体内模型之间的差距,有可能减少对动物研究的依赖。
2、重建基质和免疫类器官模型
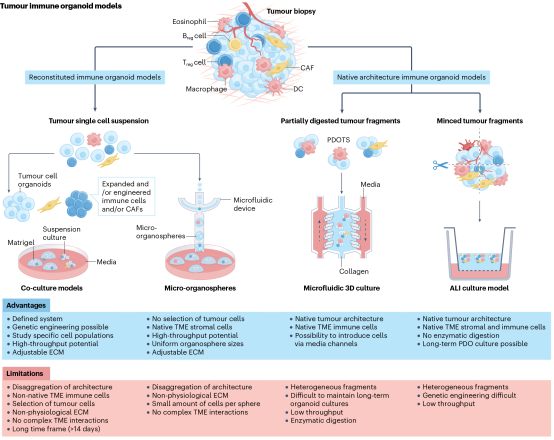
通过重建分离的上皮、基质和免疫成分构建的类器官促进了研究人员对TME的生物学功能的了解。为了研究肿瘤免疫微环境,目前已用不同的免疫细胞亚群外源性重建了已建立的各种常规肿瘤类器官。例如,促瘤性肿瘤相关巨噬细胞(TAM)与小鼠乳腺肿瘤病毒-多瘤中间肿瘤抗原(MMTV-PyMT)癌类器官共培养增加了类器官侵袭行为,而表达IL-4的CD4+ T细胞进一步增强了这一行为。非纯化的患者来源的肿瘤单细胞悬液已被用于肿瘤细胞和匹配的浸润基质和免疫细胞的短期共培养。这些方法在酶促肿瘤消化后直接启动共培养,因此与其他重建模型不同,这些模型首先建立传统的患者来源的器官型肿瘤球体,然后添加各种免疫成分(图1)。

图1 肿瘤免疫类器官模型及其相关优势和局限性综述
3、构建原生免疫类器官方法
为了研究TME在其天然结构和细胞外基质中的所有天然免疫和非免疫成分,已经开发了更全面的类器官方法。研究TME的方法包括气液界面(ALI)类器官模型和患者源性器官型肿瘤球体(PDOTS)(图2)。
3.1、ALI类器官模型
在ALI培养中,肿瘤类器官是从物理上切碎的原代组织片段中生长出来的,这些原代组织片段嵌入在胶原凝胶或内部Transwell中的其他细胞外基质中。组织片段的ALI培养允许产生天然免疫类器官,其中肿瘤细胞与内源性基质和免疫群体一起生长。因此,该模型保留了原发肿瘤的异质性、突变负担和结构而不进行重构。
3.2 器官型肿瘤球体
另一种替代的整体类器官方法是产生小鼠来源的器官型肿瘤球体(MDOTS)和PDOTS。因此,小肿瘤碎片(直径40-100 μm)在微流控装置中心通道的胶原凝胶中培养。DOTS除了保留肿瘤细胞外,还保留了自体淋巴细胞(B细胞和T细胞)和骨髓细胞(单核细胞、DC、MDSCs和TAM)。此外,这些系统成功地评估了免疫治疗反应。总之,天然类器官方法不仅可以保存原始肿瘤的基质和免疫成分,还可以保存肿瘤- TME相互作用中重要的天然空间关系。
4、肿瘤免疫类器官的实验检测方法
4.1 肿瘤免疫类器官成像
光学显微镜成像技术的进步已经彻底改变了免疫系统内细胞相互作用和串扰的分析。将这些技术应用于复杂的免疫类器官成像,不仅可以全面了解这些模型,而且可以增强对TME和免疫治疗效果的理解。例如,光片扫描显微成像技术(Light-sheet Microscopy)能够快速和温和的实时图像采集复杂的动态过程,而不会改变成像标本的生理。
4.2 肿瘤免疫类器官单细胞分析
单细胞转录组学可以对TME细胞成分进行更深入的分析。荧光激活细胞分选结合单细胞RNA测序和V(D)J测序表明,天然免疫类器官模型准确地保留同源新鲜肿瘤活检的免疫多样性和肿瘤浸润T细胞克隆型。织切片,单细胞RNA测序与细胞计数技术相结合,以确定B细胞和TLSs在ICB中的潜在作用。
4.3 类器官的基因改造
基因工程极大地促进了类器官在癌症生物学中的应用。利用病毒转导、Cre-lox和CRISPR-Cas9方法,可以将缺乏免疫元件的常规类器官稳健地修饰为单细胞悬浮液或小细胞簇。通过这种方式,类器官的基因工程现在被常规地用于评估确定的遗传事件对肿瘤发展和瘤前病变选择的贡献。
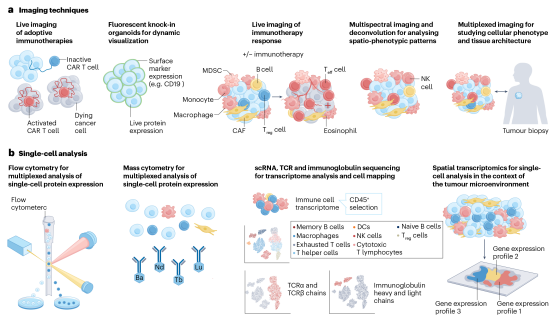
图2 肿瘤免疫类器官分析及免疫治疗作用
5、类器官的发展进程
5.1、肺癌类器官
2015年成功培养了多能干细胞(hPSCs)诱导的肺类器官。2017年,Pauli等人为769名患者创建了56个患者来源的类器官培养物,用于高通量药物筛选。这一事件标志着肺癌类器官(LCOs)在文献中的首次出现,为肺癌的个性化治疗奠定了基础。迄今为止,肺癌类器官生物库已经从原发性活检或手术的多种亚型肺癌组织中建立,包括肺腺癌、肺鳞状细胞癌和小细胞肺癌。
5.2、原发性肝癌类器官
手术切除的原发性肝癌组织已被成功地用于建立类器官,即使在体外长期扩增后,这些类器官也部分保留了亲代肿瘤组织的组织学特征、致瘤性和转移性以及基因组和转录组学图谱。但是利用肝癌类器官进行药物筛选和耐药研究指导临床治疗尚处于早期阶段,许多局限性仍有待解决,需要完成大量的临床研究来证实其可靠性和安全性。
5.3、乳腺癌类器官
2018年,Sachs等人从患者身上提取乳腺癌细胞,并在Matrigel中培养,利用类器官通用培养基开始研究乳腺癌类器官培养条件。他们在乳腺癌类器官培养基中添加神经调节素1,促进了乳腺癌类器官的高效生成,并使其长期扩增超过20代。随后他们对150多例患者的乳腺癌类器官培养条件进行了研究,建立乳腺癌类器官的成功率超过80%。然而,由于乳腺癌类器官研究开始较晚,相对于其它癌症类器官,乳腺癌类器官还需要进一步深入研究。
6、总结
肿瘤细胞及其免疫微环境之间复杂的功能相互作用调节了癌症的进展,代表一个新的治疗策略。虽然肿瘤免疫相互作用的体外建模历史上仅限于使用癌细胞系的重建方法,但近年来,使用类器官技术、肿瘤外植体和微流体方法取得了巨大进展。总之,这些系统已经朝着精准模拟体内肿瘤免疫微环境的体外建模迈进。总的来说,类器官技术在当前的癌症研究革命中占有一席之地,其特点是肿瘤模型的快速进步和治疗方案的不断改进。
参考文献:
[1] Polak R, Zhang ET, Kuo CJ. Cancer organoids 2.0: modelling the complexity of the tumour immune microenvironment. Nat Rev Cancer. 2024;24(8):523-539.doi: 10.1038/s41568-024-00706-6.
[2] Li H, Chen Z, Chen N, et al. Applications of lung cancer organoids in precision medicine: from bench to bedside. Cell Commun Signal. 2023 Dec 6;21(1):350.doi: 10.1186/s12964-023-01332-9.
[3] Zhu X, Trehan R, Xie C. Primary liver cancer organoids and their application to research and therapy. J Natl Cancer Cent. 2024;4(3):195-202.doi: 10.1016/j.jncc.2024.06.002.
[4] Tzeng YT, Hsiao JH, Tseng LM, et al. Breast cancer organoids derived from patients: A platform for tailored drug screening. Biochem Pharmacol. 2023;217:115803.doi: 10.1016/j.bcp.2023.115803.
 技术咨询:
技术咨询: