PI3K-AKT-mTORC1轴对线粒体自噬及能量代谢的影响:探索在m.3243A>G相关疾病中的治疗潜力
2025-04-28
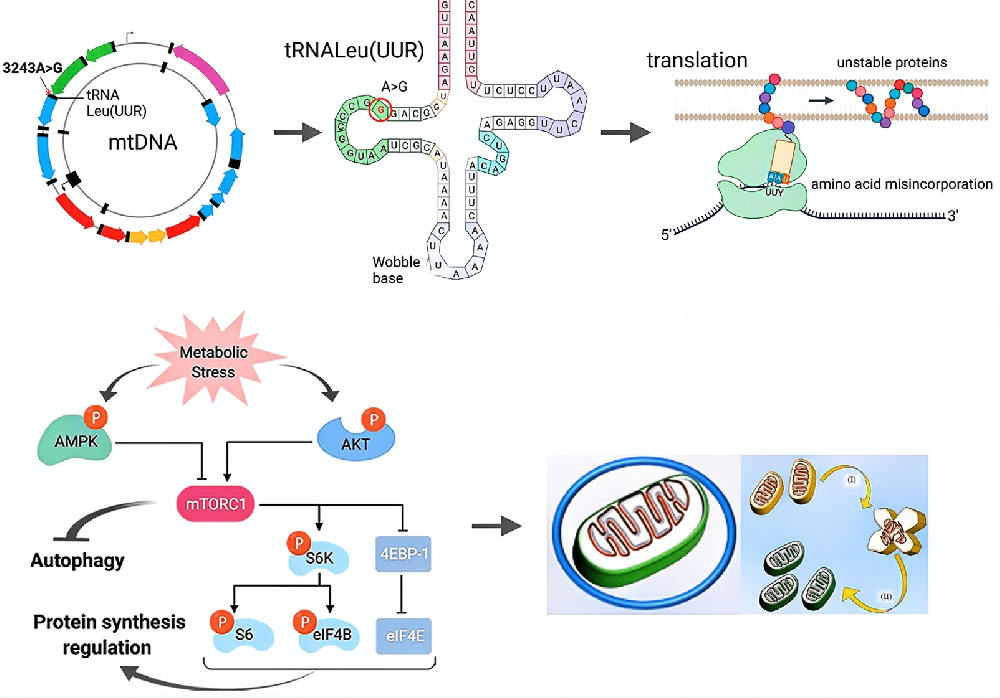
本期分享的是一篇“如何对线粒体DNA致病性突变背后的机制进行探索”的文章,如果有老师也在进行类似研究的,或者对线粒体遗传性疾病、线粒体自噬感兴趣的,可以参考一下本文的设计思路。
介绍:
人类线粒体DNA (mtDNA)编码13种作为电子传递链复合物亚基的肽和24种执行线粒体翻译的RNAs。然而线粒体DNA发生致病性突变是导致原发性线粒体疾病的主要原因。其中,在3243位发生的m.3243A >g点突变是最常见的mtDNA突变之一,会影响线粒体编码tRNA- leu [UUA/G] 1基因(tRNA识别亮氨酸的密码子UUA/G)。
该突变不仅影响约3.7 - 5.3万人,并与多系统疾病有关——如线粒体脑肌病、乳酸酸中毒和卒中样发作(MELAS),或一些母系遗传性糖尿病和耳聋/MIDD等较轻综合征。大多数患者表现出异质性,携带正常和突变的mtDNA,较高的突变通常与更严重的疾病相关。
此前来自英国伦敦大学学院细胞与发育生物学系的研究者们已从患者体内分离了携带异质m.3243A>G突变的成纤维细胞和细胞质杂交/杂交细胞,并发现细胞代谢重塑和细胞信号传导的改变,即在突变细胞中发现了PI3K-AKT-MTORC1信号的组成性激活,并与代谢产物谱的改变、氧化还原失衡、氧化应激和葡萄糖依赖密切相关。而抑制该途径的任何一步都可以显著减少突变体负荷,让细胞自主地恢复线粒体的能量代谢功能。这些发现表明,对这一信号通路进行药物干预可能是这类患者的潜在治疗靶点。于是,他们继续在这篇文章中对PI3K-AKT-MTORC1轴选择抑制突变mtDNA的下游机制进行了探索。
文章链接:https://doi.org/10.1080/15548627.2024.2437908
结果:
1. 携带m.3243A>G突变的细胞,其自噬损伤与PI3K-AKT-MTORC1轴的组成性激活有关
m.3243A>G突变细胞的RNA-seq数据显示携带m.3243A>G mtDNA突变的患者源性成纤维细胞中PI3K-AKT和MTOR通路强烈富集,这与MELAS患者肌肉活检的免疫荧光和已发表过的RNA-seq数据集的重新分析结果一致,属于体内和体外的共同特征。而自噬也是其中富集到的重要细胞过程。因此,他们探索了突变细胞中与PI3K-AKT-MTORC1轴激活相关的自噬通量状态(图1A)。
他们发现在患者成纤维细胞中,参与自噬的基因RNA表达高度上调(图1A)。在基础、饥饿(EBSS)或百菲霉素A1(Baf A1,100nM)干预条件下,患者成纤维细胞(i)中LC3B和SQSTM1的免疫印迹也显示LC3B-II在患者细胞中积累,但自噬通量(即LC3B-I向LC3B-II的转化)总体上没有增加一倍(图1B)。这表明突变细胞中LC3B-II的积累是由于自噬体-溶酶体融合减少和/或溶酶体功能障碍,而不是自噬通量增加。转染自噬报告基因mCherry-GFP-LC3B的细胞中,活细胞共聚焦成像展示了,突变细胞中自噬体的积累和自噬通量的抑制(图1C)。透射电子显微镜(TEM)成像分析显示,携带m.3243A>G突变的细胞中,自噬体的平均面积和每平方微米的自噬体数量显著增加,表明自噬体向自噬酶体的成熟受损(图1D)。因此他们推测携带m.3243A b> G突变的细胞的自噬通量受损,可能是由突变细胞中PI3K-AKT-MTORC1轴的激活引起的。
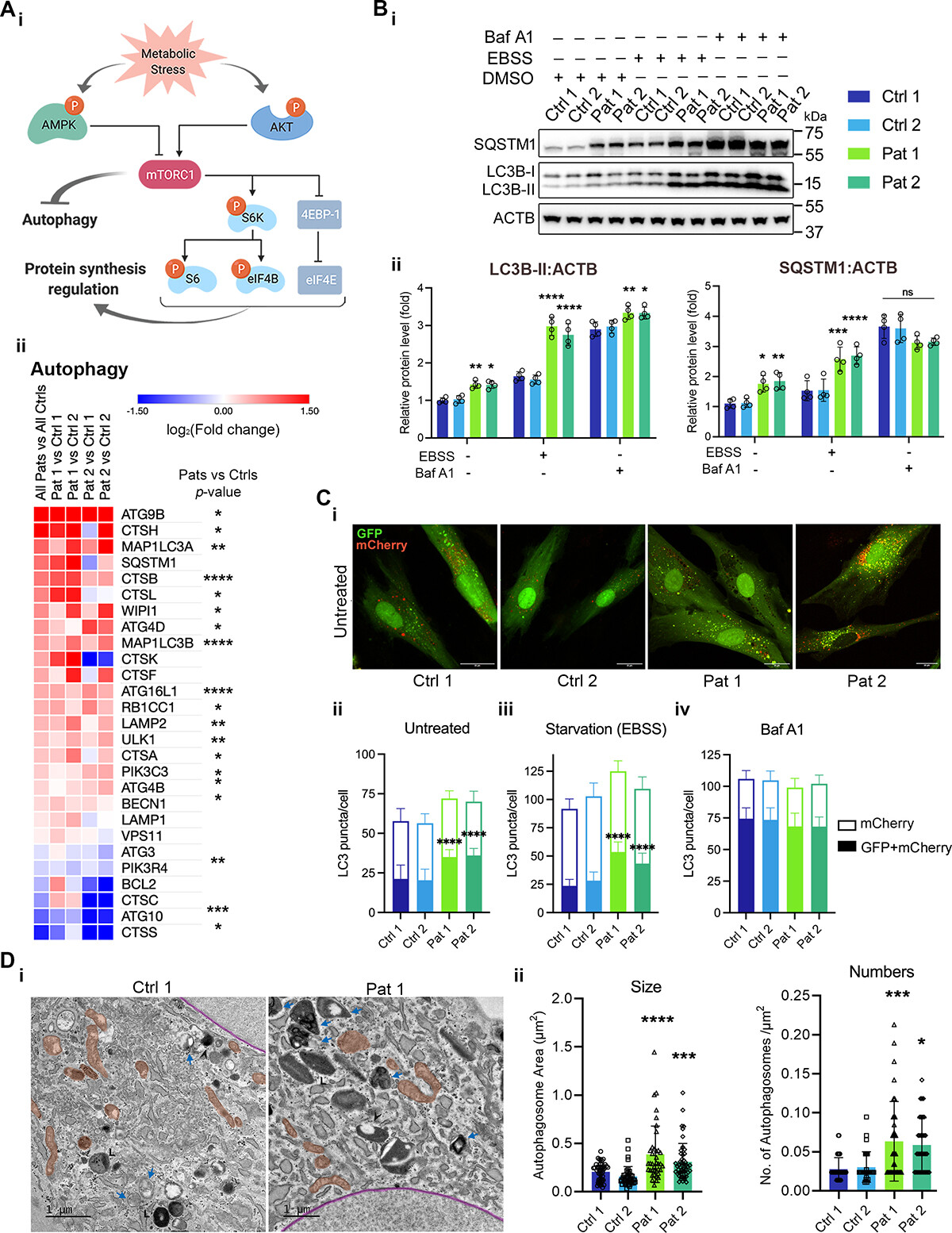
图1
2. 在m.3243A >g突变的细胞中,内吞摄取和溶酶体降解的改变情况
酸性的腔内环境和自噬体的活性水解酶对自噬降解至关重要。前面的结果显示,携带m.3243A >g突变的细胞中自噬体的积累可能改变了溶酶体的功能。这促使研究者们研究突变细胞中的溶酶体形态和功能。使用LysoTracker Green来标记酸性细胞器(图2A-B)。发现与WT对照相比,携带m.3243A>G突变的A549杂交细胞中溶酶体的平均数量(而不是大小)显著增加(图2A)。
同样,Pat 1成纤维细胞中溶酶体的平均数量(突变负荷为86.2±2.3%)显著高于Ctrl 1(图2B),而Pat 2成纤维细胞中溶酶体的平均大小(突变负荷为30.3±3.5%)显著高于对照组(图2B)。Western blot检测了主要组织蛋白酶之一CTSD/组织蛋白酶D的前体和成熟形态(图2D)。
结果显示患者成纤维细胞中CTSD前体/成熟形式的比例没有明显变化,显示正常的CTSD激活(图2D)。
这些数据表明,自噬通量和自噬体积累受损可能间接影响溶酶体功能,导致m.3243A >g突变细胞的溶酶体形态和蛋白水解活性异常(图2C)。
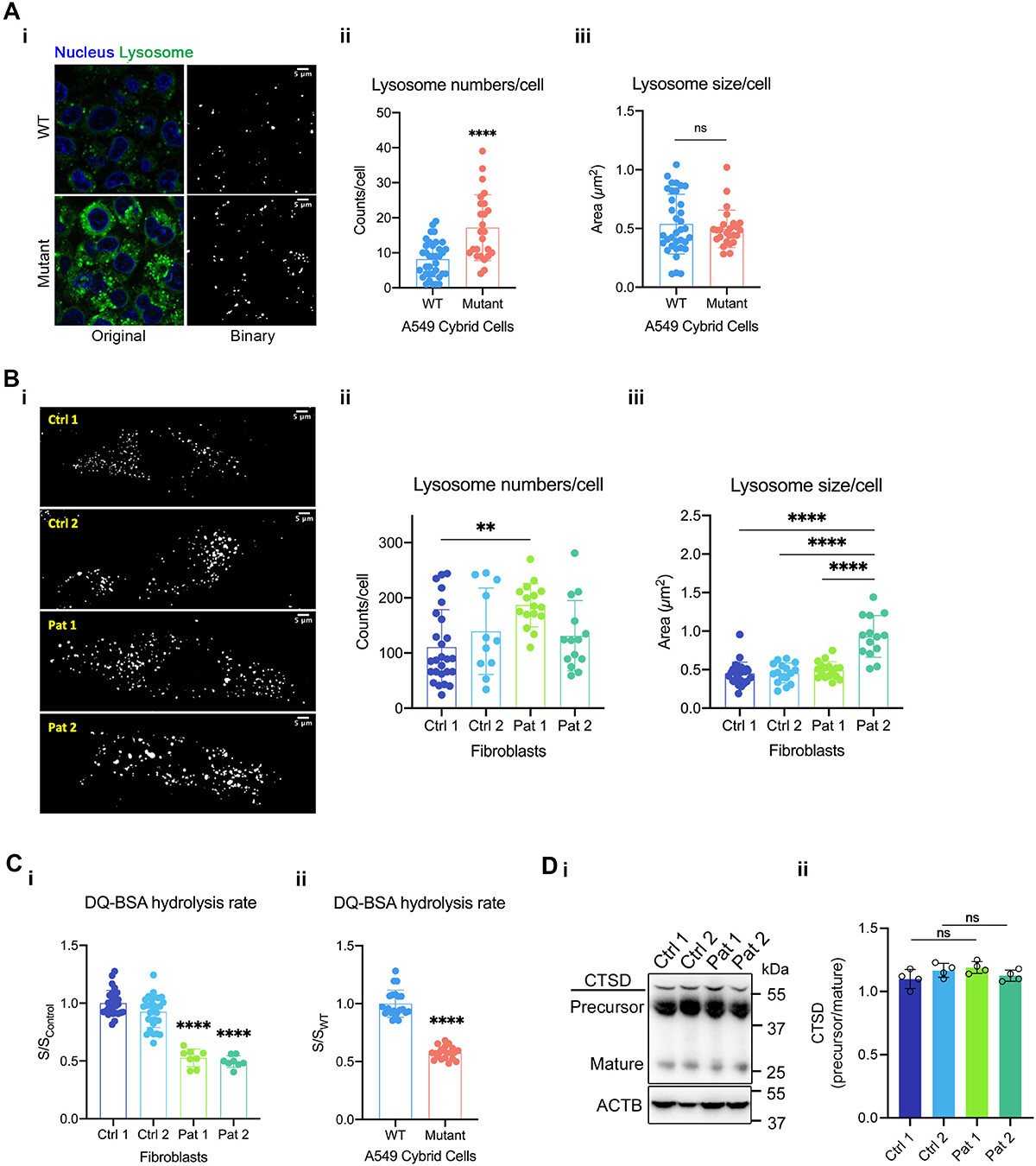
图2
3. 携带m.3243A>G突变的细胞中有丝分裂被抑制
鉴于m.3243A >g突变细胞的自噬通量受损和溶酶体活性异常,研究者们也做了另一个细胞器-线粒体的检测,探究是否存在选择性自噬去除线粒体。为了可视化受损线粒体向溶酶体的传递,他们用线粒体靶向的mKeima/mt-Keima 转染成纤维细胞,若酸性溶酶体中激发谱发生变化,则表明自噬体向自溶酶体的转化。并用线粒体碎片计数(MFC)对线粒体形态进行量化。用543 nm和458nm处激发的信号之比(F543:F458)作为线粒体自噬活性的定量读数(图3A)。
结果显示,相比之下,患者成纤维细胞表现出碎片化的线粒体网络(更高的MFC),在458nm处显示出强荧光,但在543nm处显示出减弱的mt-Keima信号(图3A)。
具有高比率F543:F458信号的线粒体亚群在突变细胞中显著减少,这与患者成纤维细胞中自溶酶体成熟缺陷一致。接下来,他们使用cox-8-EGFP-mCherry报告因子靶向线粒体基质,同时使用红色荧光阈值(P2门)选择有丝分裂细胞群,流式细胞术数据显示,在寡霉素和抗霉素A(OA)诱导的对照细胞线粒体去极化下,P2群体增加,而当对照细胞与Baf A1共处理时,P2群体受到抑制。
然而,在突变的杂交细胞中,当细胞被OA或OA+Baf A1处理时,线粒体自噬群体没有显著改变,这表明含有线粒体的自噬体的积累或它们的成熟受损。
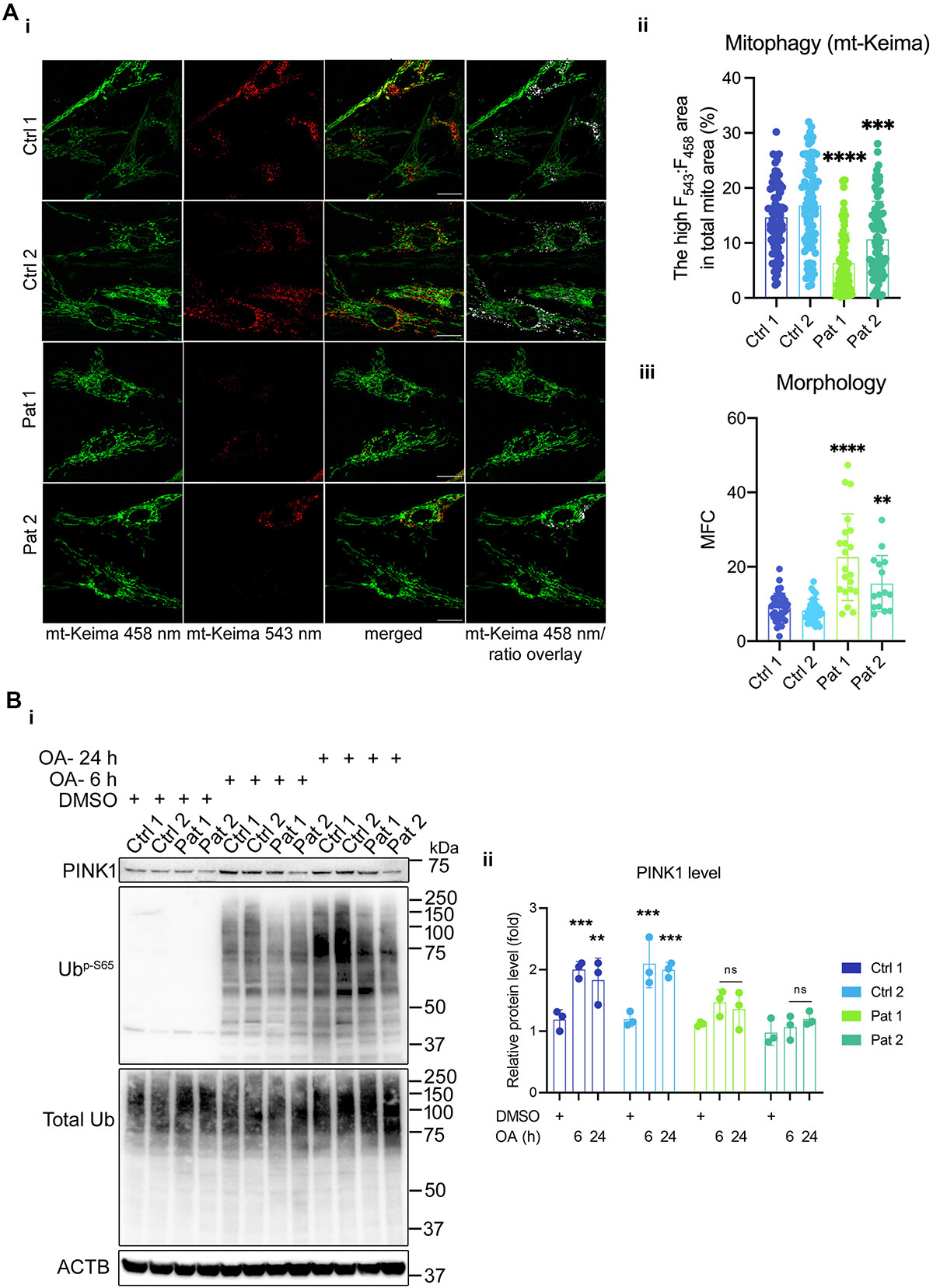
图3
4. 抑制PI3K-AKT-MTORC1轴通过增加自噬通量来减少m.3243A>G突变体负荷
在研究者此前的研究中,用PI3K-AKT-MTORC1轴抑制剂(包括雷帕霉素(RP)和LY294002 (LY))长期治疗(超过6周)突变细胞,可以减少突变负荷,并自主逆转突变细胞的生化/生物能量后果。于是,他们接下来探究了在药物治疗后对抗mtDNA突变的具体机制。
他们用mt-Keima转染了患者成纤维细胞,并测量了F543:F458比率。药物治疗24小时后(图4A),患者成纤维细胞中F543:F458 mt-Keima比值显著升高,红点(吞噬线粒体)显著增加。同样,用COX8-mCherry-EGFP转染杂交细胞。RP和LY长期药物治疗显著增加了低GFP强度细胞的比例,提示有丝分裂恢复(图4B)。
这些发现证实,抑制PI3K-AKT-MTORC1通路可恢复m.3243A>G突变细胞的自噬通量并促进自噬。而使用抑制剂RP和LY一起培养细胞、与CQ (10 μM)联合培养细胞的实验也表明CQ可以完全阻止了PI3K-AKT-MTORC1途径抑制的突变体负荷的减少(图4C)。而停药后,8周后,细胞的突变负荷逆转回与未处理时相当的水平(图4D)。
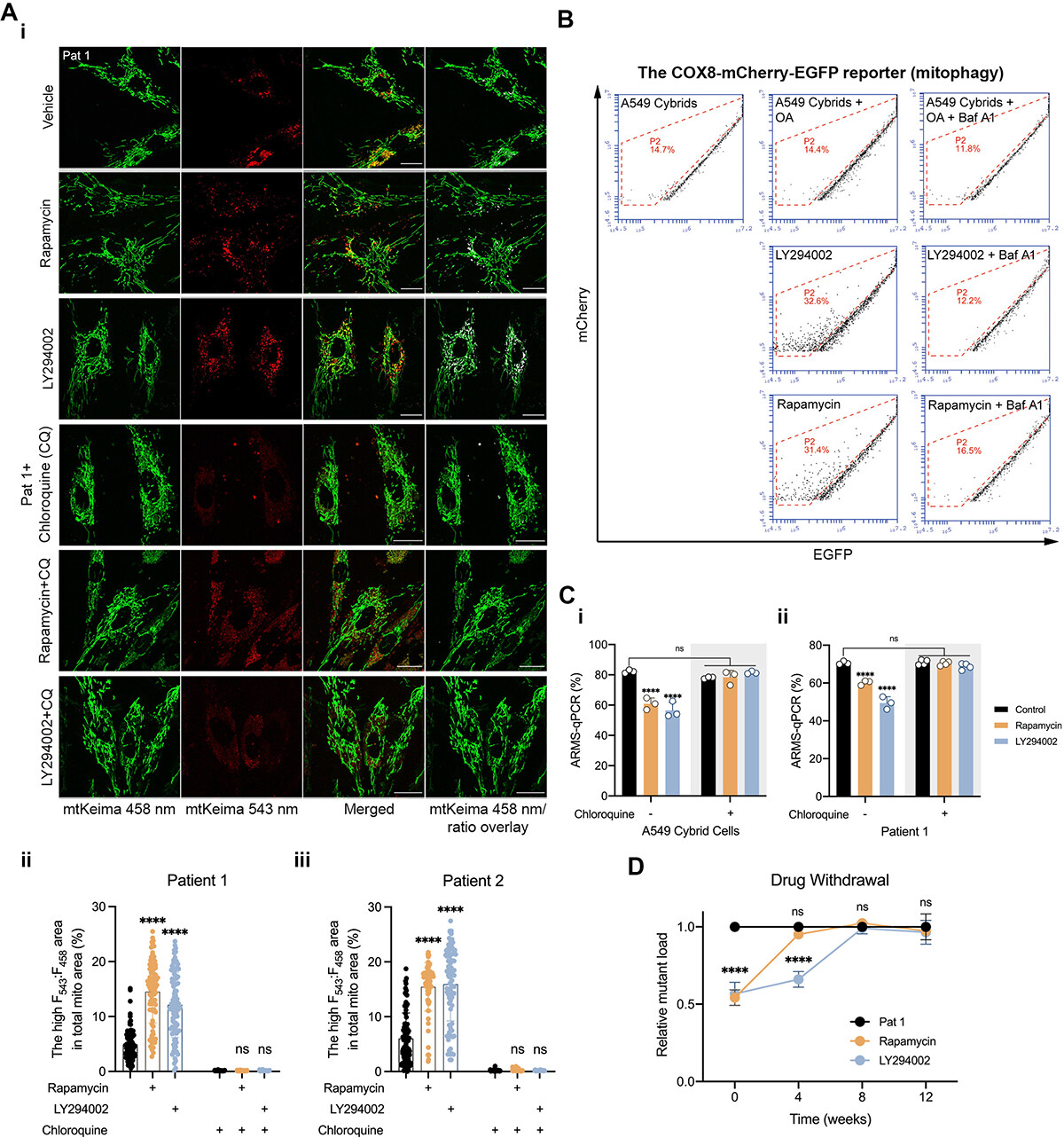
图4
5. 抑制PI3K-AKT-MTORC1信号传导是促进线粒体氧化磷酸化和减少携带m.3243A>G突变负荷所必需的
接下来,研究者们推测抑制PI3K-AKT-MTORC1轴后,突变mtDNA的去除也可能涉及代谢重塑,即线粒体自噬选择性地去除突变mtDNA。
为了证实这个推测,他们在抑制剂处理24小时后就测量了突变细胞的线粒体功能。随后发现,与未处理的细胞相比,暴露于RP或LY后,所有细胞系(A549杂交细胞和Pat 1成纤维细胞)中的ΔΨm显著增加(图5A-B)。药物治疗后,观察到线粒体形态的变化(图5B)。RP-或ly -处理的A549杂交细胞的线粒体呼吸也显示出短期处理后基础耗氧量(OCR)显著增加(图5C)。
为了确定ΔΨm的减少是否标志着突变线粒体发生了线粒体自噬,他们用寡霉素(5 nM)处理细胞,因为寡霉素可以阻断质子通过F1Fo-ATP合成酶的通量,从而增加ΔΨm。但研究者们发现,使用PI3K-AKT-MTORC1轴抑制剂,RP, LY或MK的处理可增加ΔΨm,但寡霉素的处理无法达到预期的效果,无论是单独使用还是与RP、LY或MK共处理,对ΔΨm都没有明显的影响(图5Dii)。
为了探究突变细胞中观察到的线粒体断裂是否是突变mtDNA的线粒体自噬所必需的,他们用靶向DRP1的Mdivi-1(25μM)处理突变体A549杂交细胞,从而抑制线粒体分裂。Mdivi-1与PI3K-AKT-MTORC1轴抑制剂,RP,LY,可阻止抑制剂对突变体负荷的降低、细胞ΔΨm显著升高(图5Di),证实了裂变对这些处理的重要性。
此外,他们还用了二氯乙酸(DCA),一种丙酮酸脱氢酶激酶抑制剂,通过激活PDH(丙酮酸脱氢酶)促进线粒体氧化磷酸化。结果表明,DCA处理(6周1 mM)显著降低了杂交细胞中的突变体负荷(图5Ei)。当混合细胞与2-脱氧-d -葡萄糖(2DG, 10 mM)共处理时,这种作用被逆转,因为2DG可以阻断丙酮酸的糖酵解生成,从而逆转了DCA对OxPhos的作用。同样,在Pat 1成纤维细胞中也观察到突变负荷的显著减少(图5Eii)。
总之,这些数据表明m.3243A >g突变细胞的能量缺陷不仅是由突变直接引起的,在PI3K-AKT-MTORC1细胞信号通路改变并对代谢途径有影响时就已经发生。即在携带m.3243A >g突变的细胞中,氧化磷酸化功能在线粒体自噬的激活和突变体负荷的减少中起着关键性的作用。
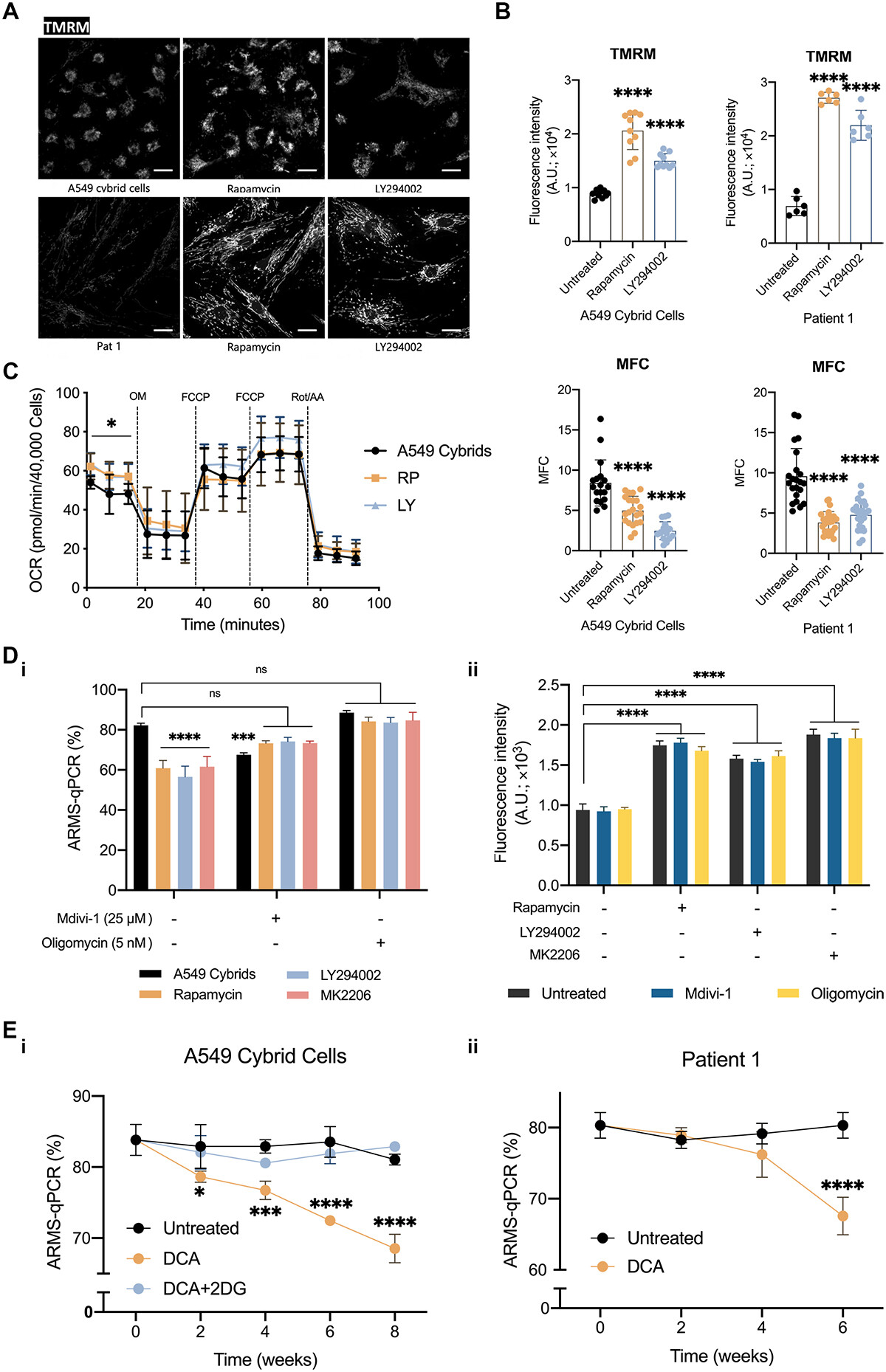
图5
 技术咨询:
技术咨询: