大数据时代下的慢性病研究:利用蛋白质组学和代谢组学分析代谢功能障碍和酒精相关肝病(MetALD)
2025-06-18

本期分享的文章来自来自诺和诺德牛津研究中心,于2025年6月4日在Journal of Hepatology上发表的题为Dissecting metabolic dysfunction- and alcohol-associated liver disease (MetALD) using proteomic and metabolomic profiles的文章,IF:26.8。
文章主要亮点就是仅通过蛋白组捕获临床因素和代谢物就能进行ALD和MASLD的分型。而利用蛋白质组对MetALD进行分型就可以改善MetALD患者的预后,尤其是肝硬化和死亡率。因此,像咱们一些样本资源不太足够的研究者们也可以学习这篇文章的思路,利用大规模人群健康数据如UK biobank等进行挖掘,来确定导致各类疾病的风险因素,对于慢性病前瞻性研究和发病机制的研究都有一定助益。下面小编给大家简单介绍一下这篇文章具体的思路和方法。
研究目的:
代谢功能障碍相关和酒精相关性肝病(MetALD)是一种鲜为人知的疾病,它连接了心脏代谢和酒精相关的病理特征,作为2023年新定义的疾病类别,目前各方面的研究也存在很多局限性,也缺乏明确的区分标准,而且与MASLD相比,饮酒多少决定MetALD的病理和预后也不确定。此外,没有充分验证的客观工具来评估MASLD和ALD的贡献,导致依赖于患者自我报告的酒精摄入量也非常不可靠,一旦将ALD和MetALD错误分类为MASLD,就很有可能无法识别肝脏病程恶化(如肝硬化)的发生风险。因此,研究者们希望能区分在酒精相关肝病(ALD)和代谢功能障碍相关脂肪变性肝病(MASLD)中具有相似分子特征的MetALD患者,并评估其并发症和死亡率的预后风险。
研究方法:
选择来自UK Biobank的443,453名欧洲参与者,其中34147名患有MetALD,11,220名患有ALD,124,034名患有MASLD。研究者们采用弹性网络回归算法对涉及249种血浆代谢物和/或2941种血浆蛋白的ALD和MASLD进行分类,并进行各种敏感性分析。然后在MetALD患者中使用选定的简明模型来确定酒精优势组(分类为ALD)和心脏代谢优势组(分类为MASLD)。最后使用Cox回归分析了他们15年主要结局(即心力衰竭、心肌梗死、中风、肝硬化、肝细胞癌和死亡率)的风险。
研究结果:
1. 进行MetALD与ALD、MASLD的临床比较
研究者们统计了34147例(7.7%)MetALD患者,124034例(28.0%)MASLD患者和11220例(2.5%)ALD患者(图1)。非SLD对照组包括217,740名参与者(49.1%)。与非SLD组相比,SLD患者表现出明显更高的心脏代谢危险因素,不良的生活习惯,肝酶和肝脂肪变性水平升高(详见原文表1和补充图1)。而MetALD患者则表现出介于MASLD和ALD患者之间的特征。与MASLD患者相比,ALD患者有更高的hdl -胆固醇、肝酶、血压、更高的吸烟率和肝脏脂肪变性。然而,他们更年轻,受教育程度较低,体重指数、腰围也较低,患2型糖尿病的风险也较低。

图1:队列模式与研究流程
*慢性肝病的其他病因包括病毒性肝炎、自身免疫性肝病、遗传性肝病、胆汁性肝硬化和结节病。
此外,研究者们调查了不同SLD亚型患者的主要结局风险,即3种心血管结局、2种肝脏结局和死亡率。发现与非SLD的患者相比,SLD患者心血管事件、肝脏事件和死亡率的风险明显更高(p<2.8×10-3)。与MetALD患者相比,ALD患者死亡率、肝硬化、肝细胞癌、中风和心力衰竭的风险更高;MASLD患者的死亡率、心力衰竭和心肌梗死的风险更高。基于pdff的方法在卒中、肝硬化和死亡率方面也显示出类似的模式。MetALD联合ALD治疗心肌梗死,MetALD联合MASLD治疗肝硬化、肝细胞癌和脑卒中无显著差异。
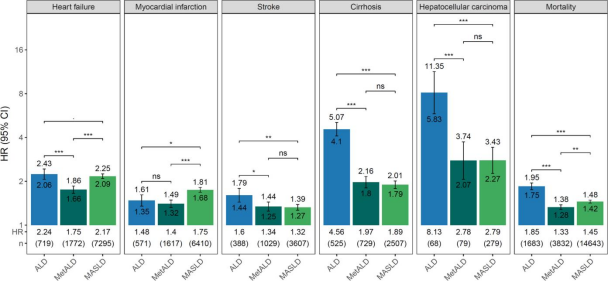
图2:与非SLD对照组相比,ALD、MetALD和MASLD患者主要结局的HR。
2. 进行ALD和MASLD的分子分类
研究者们使用简明蛋白模型将MetALD患者分为酒精驱动亚组和心脏代谢驱动亚组。然后评估了这些亚组的临床进展,并分别分析了10种靶标蛋白的作用。
与MASLD相比,ALD患者有136种代谢物水平显著升高(54.6%)。而蛋白组数据显示有319个蛋白(10.8%)在ALD患者中显著增加,554个蛋白(18.8%)在MASLD患者中显著增加。
通过上述选择的代谢物和/或蛋白质的显著不同来区分ALD和MASLD,他们建立分类模型。通过比较各种模型的分类性能。包括包含年龄、性别、BMI和肝酶(ALT、AST、GGT和AST/ALT比值)的传统危险因素模型(模型1)、分子单独模型(模型2)以及传统危险因素和分子联合模型(模型3),研究者得到图3A所展示的结果,仅代谢物模型的AUC [95%CI]为0.86[0.85,0.87]。纳入传统危险因素后,该指标增加至0.90[0.89,0.91]。当仅代谢物模型的特异性设置为0.95时,敏感性仅为0.51。当纳入传统风险因素时,这一比例增加到0.59。此外,仅蛋白模型的AUC为0.96[0.95,0.97],最佳特异性为0.88,敏感性为0.94。其敏感性高达0.84,特异性为0.95。在加入额外的传统危险因素或代谢组数据后,模型性能没有明显改善(图3B-C)。

图3 模型区分ALD和MASLD的分类性能。
A) 代谢组相关模型;B)蛋白质组相关模型;C)蛋白质组和代谢组相关模型;D)10种蛋白模型。模型1的变量包括年龄、性别、BMI、肝酶。模型2包括代谢物和/或蛋白质。模型3结合了模型1和模型2中的变量。图中显示了每个模型的两个阈值:一个用于最佳特异性和敏感性,另一个用于特异性设置为0.95,然后是相应的特异性和敏感性值。
3. 通过分类模型对MetALD进行子分组
研究者们利用10蛋白模型进一步用于确定MetALD患者是否分为主要受心脏代谢因素影响的MASLD组(n= 2268, 68.8%)或主要受酒精影响的ALD组(n= 1030, 31.2%)。
与非SLD对照组相比,任何一个亚组的MetALD患者发生心力衰竭、肝硬化和肝细胞癌的风险都明显更高。与心脏代谢为主的MetALD患者相比,酒精为主的患者死亡率和肝硬化的风险明显更高。两个MetALD亚组在心力衰竭和肝细胞癌方面的差异无统计学意义。心肌梗死和卒中在亚组之间或亚组与非SLD对照组之间均无显著差异。
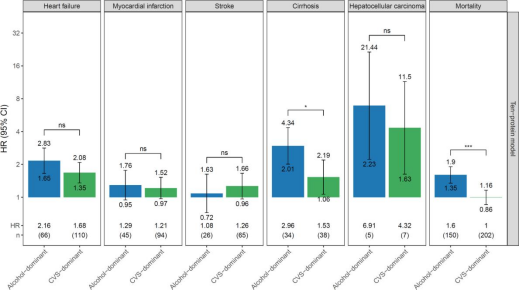
图4 与非sld对照组相比,MetALD亚组主要结局的HR。*CVS:代谢疾病。
由于肝纤维化状态是MASLD患者主要预后的一个公认预测指标,因此他们比较了两个MetALD亚组之间FIB-4、NFS水平和纤维化分期。结果发现,酒精为主组的MetALD患者FIB-4水平明显更高(OR [95%CI]: 1.48 [1.27, 1.73], p=5.0×10-7),即使在调整更多的高级模型中,ii期纤维化发生率也更高。在两个MetALD亚组之间,NFS和纤维化1期患病率没有显著差异。进一步比较肝硬化和死亡率的风险,结果显示MetALD亚组之间在亚组内的纤维化阶段存在显著差异。尽管每组的事件样本量都很小,但无论是否进行了高级调整,酒精为主组与心脏代谢为主组相比,肝硬化和死亡率的风险均明显更高。纤维化2期和纤维化1期也是如此。只有在纤维化0期人群中无显著差异。
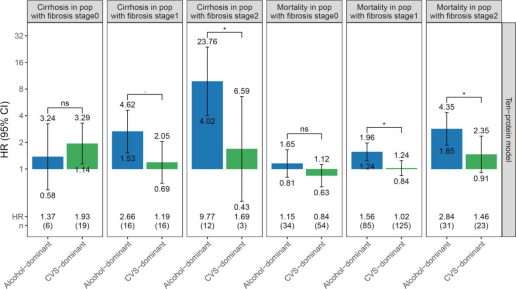
图5 与非sld对照组相比,MetALD亚组肝硬化和死亡率的HR按纤维化分期分层。
总之,在这项研究中,研究者们使用一种基于ALD和MASLD之间蛋白质谱显著差异的分类模型,区分由酒精相关因素驱动的MetALD患者和由心脏代谢特征驱动的MetALD患者。与以心脏代谢为主的组相比,由10个蛋白(MAMDC4、SSC4D、CEACAM16、CHI3L1、GGT1、C4BPB、CDHR5、OXT、FCAMR和ADAM22)鉴定的以酒精为主的MetALD组具有明显更高的死亡率和肝硬化风险,同时FIB-4水平升高和纤维化分期升高。这突出了蛋白质数据在疾病分层中的价值及其捕获酒精对MetALD结果影响的潜力。
 技术咨询:
技术咨询: