肿瘤微生物组:癌症发展的“幕后推手”与治疗新策略
2025-08-04
人体内居住着约38万亿微生物,包括细菌、真菌和病毒,其数量与人体细胞相当。它们不仅存在于肠道、皮肤、口腔、阴道等开放腔道,随着技术进步,人们发现曾被视作无菌的肺、乳腺、肝脏、胰腺、前列腺、肾脏等组织器官,其实也定植着低生物量的微生物群落。其中,“肿瘤内微生物组”的概念应运而生,这些微生物已在至少33种主要癌症类型中被发现(图1)。
肿瘤内微生物是肿瘤微环境不可或缺的一部分,主要混杂在癌细胞和免疫细胞中。它们能显著改变不同细胞区室的生物学特性,影响肿瘤的发生、发展、转移以及抗肿瘤免疫。相关研究由来已久:19世纪中期就有微生物学家在肿瘤中发现微生物;1885年Doyen从肿瘤中分离出细菌并证实其致瘤性;20世纪初Rouse首次证明劳氏肉瘤病毒能诱发癌症;1964年EB病毒在伯基特淋巴瘤中被发现;1983年幽门螺杆菌被确认为胃癌病因;2020年Nejman等人对七种人类肿瘤样本的严谨调查揭示了不同癌种的细菌差异,随后Narunsky-Haziza和Dohlman又分别表征了多种癌症样本中的真菌。
基于微生物干预的癌症治疗方法也在探索中。1866年Busch用丹毒感染患者并观察到肿瘤消退;1893年Coley发明了抗癌微生物疫苗“Coley毒素”;1940年Bloch发现噬菌体可与恶性细胞相互作用并抑制肿瘤生长;1981年乙肝疫苗作为首个抗癌疫苗获批,有效预防肝癌。如今,研究焦点已从天然微生物转向工程改造的菌和病毒来对抗癌症。
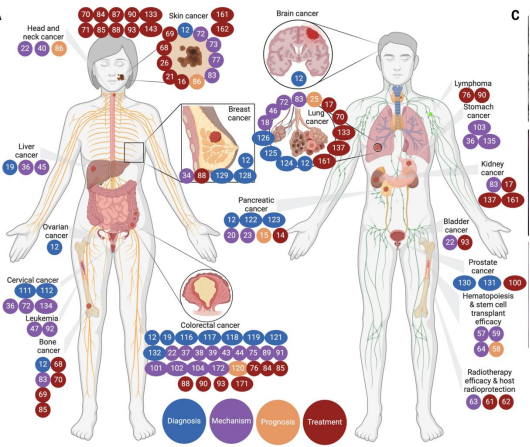
图1 目前已知与肿瘤内微生物有关的癌症[1]
肿瘤微生物从哪来?粘膜、邻近组织与血液三大途径
肿瘤内部也存在着复杂的微生物群落,它们的来源主要有三种途径(图2)。第一种是粘膜屏障入侵:定植在粘膜(如肠道)的微生物,可以通过受损的粘膜侵入肿瘤。例如,“驱动”细菌如拟杆菌属、肠杆菌科可能先引发肿瘤发生,随后被“乘客”细菌取代。研究发现,不仅食管、肺等粘膜器官肿瘤中存在微生物,胰腺等非粘膜器官肿瘤中的微生物也可能从肠道易位而来,重塑肿瘤微环境(TME)。
第二种是邻近组织入侵。肿瘤与邻近正常组织的微生物群落往往高度相似。像幽门螺杆菌引起的慢性胃炎最终可能发展为胃癌,这提示特定微生物介导的炎症是肿瘤形成的途径之一。不过,许多器官正常组织的微生物起源尚不明确,它们也可能来自肿瘤,需要更多研究确认。
第三种是血源性入侵。口腔、肠道等处的微生物可能通过破损的血管被携带至肿瘤部位定植。实验发现,静脉注射的具核梭杆菌能依赖其凝集素Fap2识别宿主多糖,定位到小鼠结肠腺癌和乳腺肿瘤组织中,这证明了血行途径的存在。值得注意的是,肿瘤独特的免疫抑制、缺氧和营养富集的微环境可能更利于微生物定植,但这些推测需通过宏基因组测序和遗传鉴定来证实。
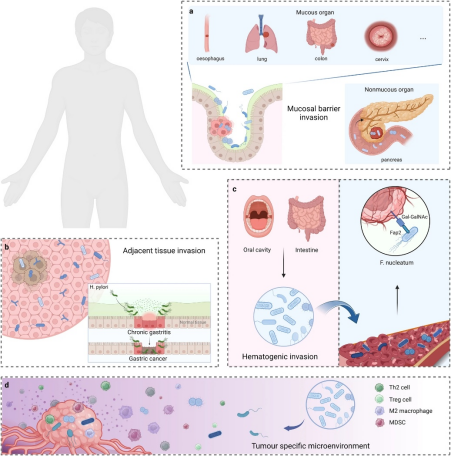
图2 肿瘤内微生物组的潜在起源[2]
肿瘤内微生物组在癌症发展中的作用
肿瘤内微生物组在癌症发展中扮演着关键角色。癌细胞通过维持增殖、逃避生长抑制、抵抗细胞死亡、实现复制永生、诱导血管生成以及激活侵袭和转移来推动疾病进展(图3)。尽管微生物群在癌症起始和进展中的具体作用尚不清楚,但它可能与调节恶性细胞和非恶性细胞间最相关的肿瘤促进功能有关。理解这些机制对癌症的预测和治疗至关重要。
1. 微生物组通过基因组不稳定驱动癌症——微生物组在癌症发生中扮演关键角色,其核心机制之一是诱导基因组不稳定和突变。超过10%的人类恶性肿瘤主要由致癌病毒引起,如HPV在宫颈癌和头颈癌、HBV在肝癌中,通过病毒基因组整合到宿主染色体触发基因突变,并产生病毒癌蛋白干扰宿主信号通路。例如,HPV E7蛋白抑制cGAS-STING通路,减少I型干扰素表达,促进免疫逃逸;EBV和KSHV癌蛋白上调致癌蛋白和microRNA,激活NF-κB通路驱动细胞增殖;HTLV-1通过Tax蛋白抑制DNA修复,导致突变积累。同时,致癌细菌如pks+ 大肠杆菌和ETBF分泌毒素诱导DNA损伤,加速肿瘤发生。具核梭杆菌的FadA蛋白激活E-cadherin/β-catenin上调CHK2,造成DNA双链断裂;幽门螺杆菌等细菌干扰DNA错配修复,加剧基因组不稳定。微生物活动还产生活性氧(ROS)等物质,例如ETBF毒素增加SMO表达促进ROS生成;微生物代谢物如β-葡萄糖醛酸酶释放反应中间体导致DNA损伤,而链球菌和牙龈卟啉单胞菌将乙醇转化为乙醛形成DNA加合物,促进口腔癌。这些机制共同形成促炎微环境,但细菌毒力因子的直接致癌作用仍需更多研究。
2.表观遗传调控的幕后推手——定植于肿瘤内部的微生物可通过直接或间接途径深刻影响宿主细胞的表观遗传修饰,进而参与癌症的发生发展。一方面,微生物可直接调控宿主表观遗传:如幽门螺杆菌通过激活NF-κB上调TET1诱导GNB4基因去甲基化;具核梭杆菌通过SP1上调lncRNA ENO1-IT1,进而招募KAT7改变组蛋白修饰模式,促进结直肠癌糖酵解和发生;具核梭杆菌和哈氏哈特氏菌还能上调DNA甲基转移酶,介导CRC中抑癌基因(TSG)启动子高甲基化。另一方面,微生物合成的代谢物可作为表观遗传底物或调节因子间接发挥作用:如微生物衍生的叶酸、B族维生素是DNA和组蛋白甲基化的关键底物;短链脂肪酸(SCFAs)通过影响组蛋白乙酰化酶/去乙酰化酶活性改变基因组表观遗传状态;某些细菌产生的甲硫氨酸是重要的甲基供体。此外,微生物还可能通过产生ROS等途径间接诱导表观遗传改变。病毒同样可通过诱导宿主细胞表观遗传变化(如HBV诱导RNA m6A修饰)促进致癌。研究已在胃癌、甲状腺癌、肝细胞癌、结直肠癌等多种癌症中观察到瘤内微生物与特定基因异常甲基化等表观遗传事件的显著关联,影响肿瘤发生、转移及预后。然而,瘤内微生物诱导宿主表观遗传改变的具体分子机制仍有待深入阐明。
3. 微生物组通过慢性炎症驱动癌症——肿瘤微环境中的微生物正被揭示为驱动癌症进展的关键“纵火犯”。它们通过激活Toll样受体(TLR)等模式识别受体,持续点燃慢性炎症之火,重塑免疫微环境并促进肿瘤发展。例如,具核梭杆菌经TLR4识别后,增强IL-6/p-STAT3/c-MYC信号,诱导促瘤的M2样巨噬细胞极化,推动结直肠癌进展;胰腺导管腺癌(PDAC)微生物则通过TLR抑制CD4+ T细胞的Th1极化和M1巨噬细胞分化,建立免疫耐受程序。微生物产物如脂多糖(LPS)/TLR4轴还能介导单核样巨噬细胞募集,促进IL-1β产生和Th17细胞扩增,形成增强肠通透性、招募免疫抑制细胞的正反馈循环。肿瘤上皮屏障破坏后,微生物产物激活的炎性树突细胞可诱导γδT17细胞极化,释放IL-17、IL-8、TNF-α等因子,吸引多形核髓系来源抑制细胞(PMN-MDSCs),将炎症微环境转化为免疫抑制微环境。此外,脆弱拟杆菌毒素(ETBF)触发STAT3–NF-κB炎症级联释放IL-17/IL-23,招募促瘤髓系细胞;具核梭杆菌等菌通过TLR2/4激活巨噬细胞NF-κB通路刺激IL-6产生;某些弯曲菌感染则上调干扰素诱导蛋白16炎性体,可能与食管癌相关。具核梭杆菌还能抑制癌细胞自噬,促进ROS积累及IL-8、IL-1β、TNF-α等释放。微生物亦可诱导巨胞饮作用激活炎症,并与中性粒细胞(PMNs)互作:中性粒细胞缺失促进阿克曼菌富集,进而提升IL-17水平和B细胞浸润以促瘤。持续的微生物感染引发组织损伤和应激,招募免疫细胞并释放促炎因子,最终使慢性炎症微环境转变为免疫抑制状态,同时炎症细胞产生的ROS可诱导DNA损伤,而DNA损伤又放大炎症反应,形成恶性循环,共同推动癌症发展。
4. 免疫调控的双面刃与潜在治疗靶点——肿瘤内微生物与宿主免疫系统的相互作用深刻影响着免疫稳态和肿瘤发生。这些微生物可通过塑造免疫抑制微环境和使免疫细胞失活来逃避免疫清除。例如,具核梭杆菌选择性地聚集多种髓系免疫细胞,营造促瘤环境;某些共生菌则通过Myd88通路驱动γδ T细胞活化,释放IL-17等因子促进肺部肿瘤生长;巴氏杆菌与柯里杆菌科被发现分别与抗肿瘤的CD8+ T细胞和促瘤的M2型巨噬细胞呈正/负相关。此外,金黄色葡萄球菌、HBV、HCV等通过诱导调节性T细胞(Tregs)介导的免疫抑制促进前列腺癌、肝癌进展;HPV在宫颈病变中诱导的Tregs水平与疾病严重程度相关,干扰抗病毒免疫。胰腺癌组织中的真菌群落则通过刺激癌细胞产生IL-33,招募Th2细胞等促进肿瘤。微生物还直接使免疫细胞失活:肺内厌氧菌代谢物SCFA抑制T细胞IFN-γ产生;HPV下调抗原呈递抑制CTL和NK细胞功能;具核梭杆菌蛋白结合TIGIT/CEACAM1受体抑制NK等细胞抗肿瘤活性;幽门螺杆菌HopQ蛋白通过CEACAM1失活免疫细胞并介导CagA毒素入胞,CagA还能刺激PD-L1表达促进胃癌;EBV则下调IDO导致T细胞监视失活。然而,微生物群也能激活抗肿瘤免疫:HPV阳性头颈癌中伴随大量活化CD8+ T细胞浸润,可能解释其对免疫治疗反应更佳;肠道双歧杆菌增强肿瘤内DC的STING/IFN-I信号,促进T细胞抗肿瘤反应;肝螺杆菌在小鼠CRC模型中增加免疫细胞浸润减轻瘤负荷;植物乳杆菌代谢物通过表观遗传修饰增强DC的IL-12a产生,激活CD8+ T细胞;罗伊氏乳杆菌代谢物促进IFN-γ+ CD8+ T细胞增强免疫检查点抑制剂效果;梭菌目代谢物TMAO通过PERK激酶诱导肿瘤细胞焦亡并促进抗肿瘤免疫;假长双歧杆菌代谢物肌苷诱导CD4+ T细胞表达Th1调控基因。综上,肿瘤内微生物群及其代谢物是免疫系统的“双面刃”,既能抑制也能激活抗肿瘤免疫,其作为免疫治疗辅助靶点的潜力高度依赖于具体情境,需深入研究以明确其临床转化价值。
5. 肿瘤代谢重编程——微生物组通过改变人体代谢,可能引发代谢性疾病和多种癌症。研究发现,良性乳腺疾病组织中的微生物组与半胱氨酸、甲硫氨酸代谢、糖基转移酶及脂肪酸生物合成增加相关;而乳腺癌组织中的梭杆菌属、阿托波菌属等菌群则降低了肌醇磷酸代谢。宫颈癌中,以加德纳菌属、普雷沃菌属等为主的非乳杆菌群落影响氨基酸和核苷酸代谢。胃癌肿瘤组织通过非靶向代谢组学分析显示,碳水化合物、氨基酸、甘油磷脂和核苷水平高于正常组织,其中螺杆菌属与这些差异代谢物呈负相关,乳杆菌属呈正相关。口腔鳞癌(OSCC)患者的微生物组关联铁离子运输相关酶、色氨酸酶、谷氨酸脱氢酶等活性上调;具核梭杆菌通过GalNAc-Autophagy-TBC1D5信号通路促进葡萄糖转运蛋白GLUT1上调和乳酸积累,推动OSCC进展。体外实验证实,Merkel细胞多瘤病毒(MCPyV)致癌蛋白增加糖酵解基因(如乳酸转运蛋白MCT1)表达,诱导有氧糖酵解;KSHV感染通过上调HIF1α和激活PI3K/Akt/mTOR通路稳定糖酵解;人巨细胞病毒(HCMV)显著上调糖酵解、三羧酸循环和脂肪酸合成途径;HPV E7蛋白则与低活性M2型丙酮酸激酶(M2PK)相互作用并积累其二聚体形式。其他致癌病毒如EBV、HBV和HCV通过靶向转录因子、癌基因及肿瘤抑制因子来调控代谢酶和通路。然而,许多非致癌病毒感染也出现类似代谢变化,这表明病毒诱导的代谢重编程可能不足以单独致癌,但在缺氧、炎症和免疫抑制的微环境中,这些促肿瘤代谢倾向可能协同促进病毒相关的癌变过程。
6. 驱动癌症转移进程——肿瘤内微生物通过直接调控癌细胞特性及其外部微环境,驱动癌症转移进程。一方面,微生物可诱导癌细胞发生上皮-间质转化(EMT),赋予其侵袭性:具核梭杆菌的毒力蛋白Fn-Dps通过上调CCL2/CCL7趋化因子促进小鼠结直肠癌细胞EMT;膀胱癌中大肠杆菌、产丁酸菌SM4/1等微生物与E-钙黏蛋白、波形蛋白等EMT基因表达相关;牙龈卟啉单胞菌能上调Slug、Snail、Zeb1等转录因子表达,增强口腔上皮细胞迁移能力;晚期转移性结肠肿瘤中的念珠菌则通过下调PTK2B等黏附基因促进转移。另一方面,微生物可增强癌细胞干性:幽门螺杆菌CagA阳性菌株感染可触发EMT样改变并上调干细胞标志物CD44,增强细胞迁移能力;产肠毒素脆弱拟杆菌(ETBF)毒素通过切割E-钙黏蛋白激活β-连环蛋白核转位,提升肿瘤干细胞潜能。微生物还协助癌细胞抵御血流剪切力:小鼠乳腺癌模型中葡萄球菌、乳杆菌等通过抑制RhoA-ROCK通路重塑细胞骨架,增强癌细胞抗血流应力能力;具核梭菌则通过激活ALPK1/NF-κB信号通路上调ICAM1,促进结直肠癌细胞黏附血管内皮。此外,微生物通过破坏血管屏障、抑制T细胞浸润或借助胞外囊泡(EVs)激活免疫抑制信号,营造利于转移的微环境。微生物来源EVs在转移前微环境形成中的作用机制,仍是未来研究的重要方向。
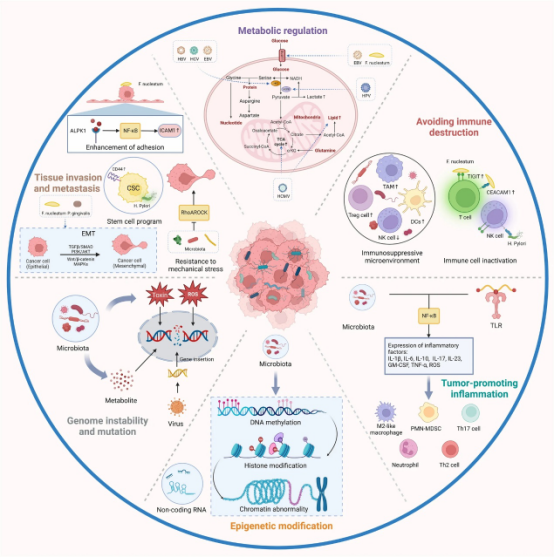
图3 肿瘤内微生物组在癌症发展中的作用[2]
微生物组与癌症的复杂纠葛及治疗新契机
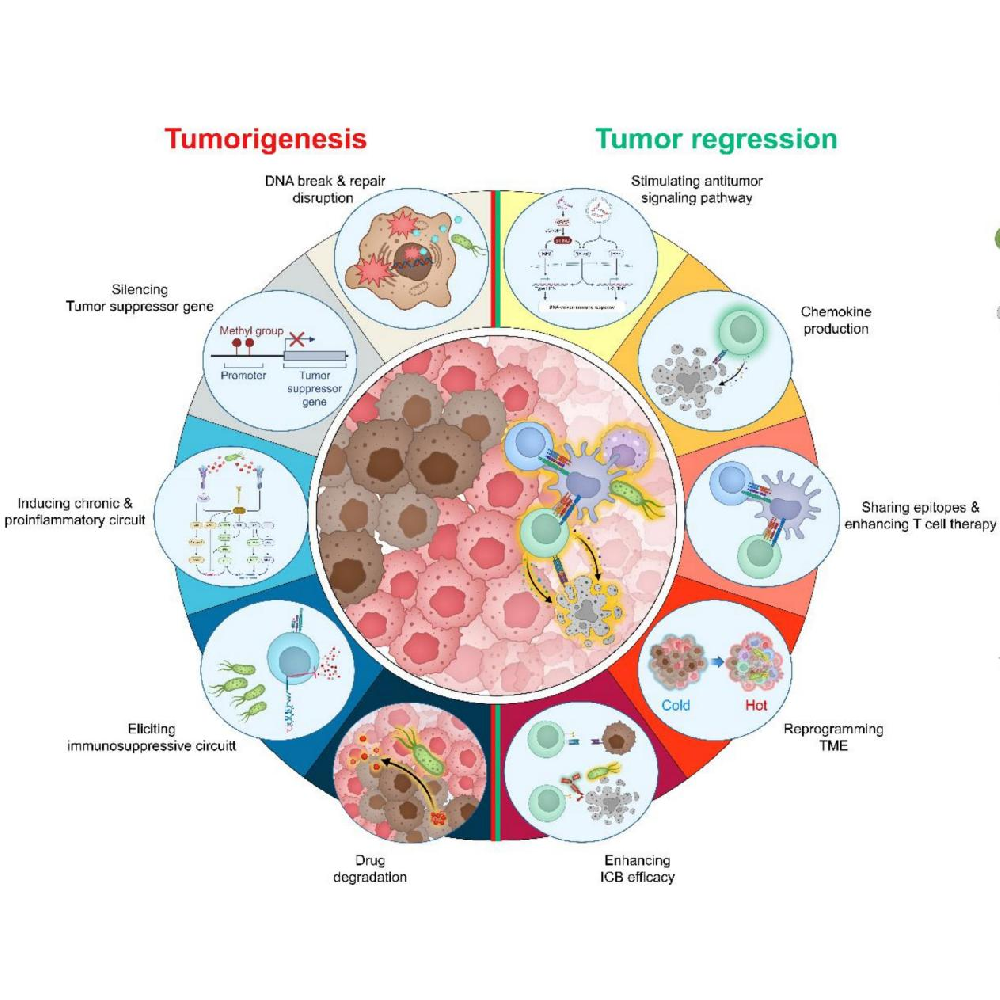
肿瘤微生物组作为肿瘤微环境的关键成分,其调控肿瘤发展并影响癌症治疗的作用日益引发关注。研究表明,多种肿瘤内部存在独特的微生物群落,它们可能通过多种机制促进癌症进展,包括诱发基因组不稳定与突变、介导表观遗传修饰、驱动促肿瘤炎症、协助免疫逃逸、调控代谢以及激活侵袭转移通路。深入理解微生物与肿瘤间这种复杂关系,有望为现有及潜在的癌症治疗方案提供独特视角。在临床前研究中,经过改造减毒并能精准靶向肿瘤组织的工程菌已展现出显著的抗肿瘤效果[3]。此外,微生物联合化疗或免疫治疗可能有助于克服耐药性并提升抗癌疗效(图4)。
然而,描述微生物与肿瘤关系的研究结论常存在矛盾。这提示我们需要建立并广泛采用标准化的肿瘤内微生物研究流程。目前多数研究是基于微生物层面的横断面分析,难以确立肿瘤内微生物与肿瘤发生之间的因果关系。尽管许多研究认为肿瘤内微生物是致癌因素,但无法排除微生物变化是某些癌症发展的结果。因此,开展大样本量的纵向前瞻性研究,并深入探索肿瘤内微生物群对不同表型癌细胞及免疫细胞的影响至关重要。Bullman近期提出,癌细胞与肿瘤内微生物可能存在互利共生关系,即双方都需要逃避免疫系统,并具备迁移扩散至新适宜生态位的能力。这表明,尽管微生物群与肿瘤的互作复杂,但通过修饰或操控肿瘤内微生物群来治疗肿瘤是可行的方向。
肿瘤内微生物群在肿瘤发生发展中的研究方兴未艾。未来需要更精密的动物模型来追踪受微生物影响的肿瘤细胞,提供更多临床前证据。同时,需采用跨学科方法定量解析肿瘤内微生物与肿瘤形成发展的关系。研究还应关注肿瘤内微生物与已知癌症风险因素的联系,探究这些因素是否额外影响肿瘤内微生物的组成。此外,将健康人群与高危人群的组织微生物差异与癌症发展相关联,可能有助于建立更有效的癌症预防与诊断方法,尽管获取正常人体组织存在伦理和可及性挑战。在治疗方面,将特定的微生物特征与肿瘤反应调控联系起来的研究可能识别出新的临床干预靶点。探索基于微生物干预的联合治疗策略以提升临床疗效,是另一个充满前景的研究方向。
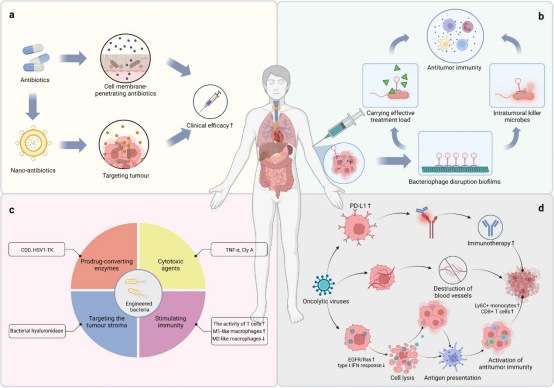
图4 肿瘤内微生物组在癌症治疗中的应用[2]
参考文献:
[1] Sepich-Poore GD, Zitvogel L, Straussman R, et al. The microbiome and human cancer [J]. Science, 2021, 371(6536).
[2] Cao Y, Xia H, Tan X, et al. Intratumoural microbiota: A new frontier in cancer development and therapy [J]. Signal Transduct Target Ther, 2024, 9(1): 15.
[3] Kwon SY, Thi-Thu Ngo H, Son J, et al. Exploiting bacteria for cancer immunotherapy [J]. Nat Rev Clin Oncol, 2024, 21(8): 569-589.
 技术咨询:
技术咨询: