【文献分享】肿瘤内真菌群异质性影响肾癌微环境及免疫治疗
2025-08-05
研究背景
近年来,肿瘤内菌群(包括细菌和真菌)在肿瘤发生、发展和治疗中的作用逐渐成为研究热点。而肾细胞癌(RCC)是一种常见的泌尿系统恶性肿瘤,免疫治疗对其效果有限,仅10%-20%的患者受益。研究表明,肿瘤内菌群可能通过调节免疫微环境和代谢活动影响肿瘤进展和治疗反应。研究纳入来自21个国家的1044例RCC患者(含466例免疫治疗患者),对各患者肿瘤组织中菌群进行检测分析,探索肿瘤内真菌群的异质性及其在RCC中的作用机制。
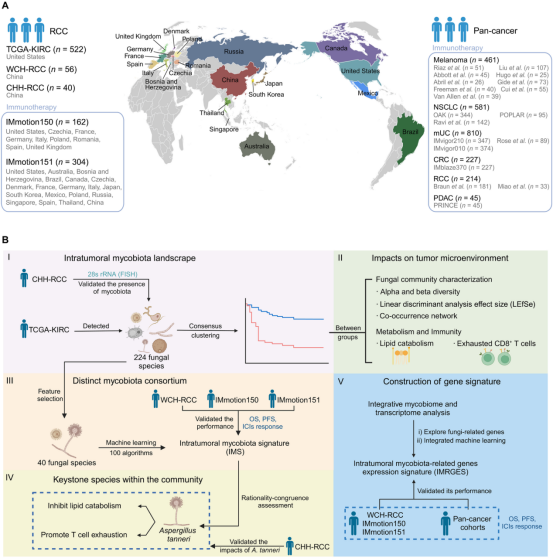
肿瘤内真菌群的异质性与预后关联
研究利用RNA测序数据对肿瘤内驻留菌群进行了分析,发现RCC肿瘤组织中广泛存在真菌,且真菌群落具有显著的异质性。根据真菌丰度,可将患者分为真菌生态贫乏组(MED)和真菌生态富集组(MEF)。通过比较两组患者发现,MEF组患者预后较差,表现为更高的真菌多样性和更复杂的真菌互作网络。
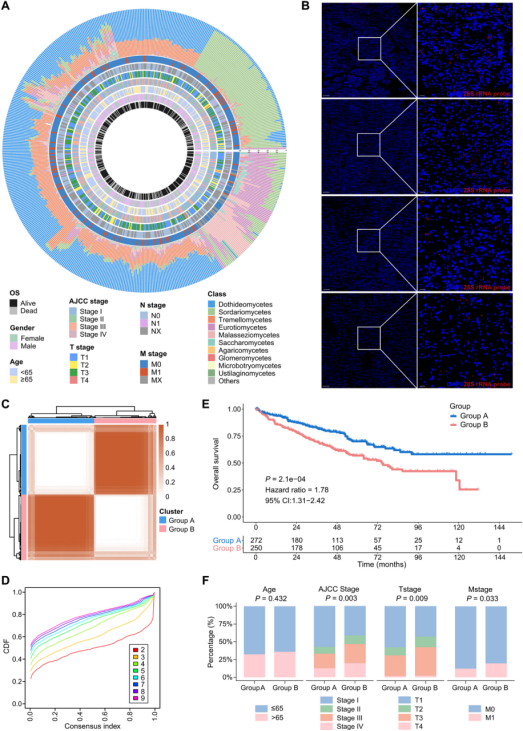
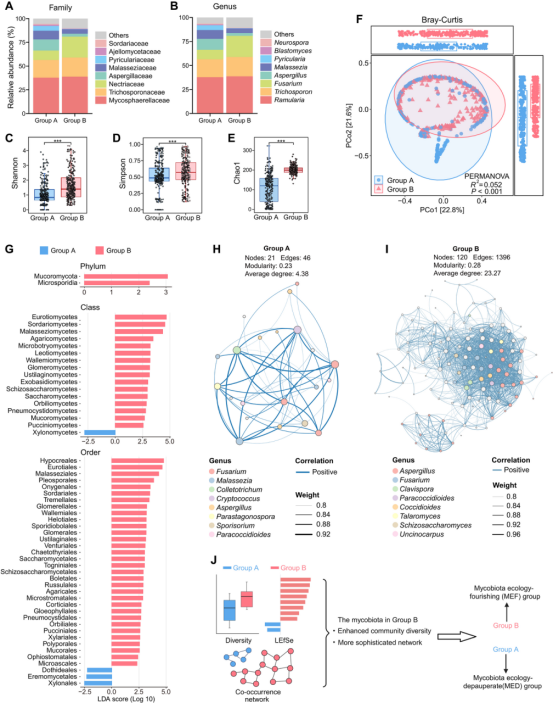
MEF组真菌多样性及网络复杂性升高
MEF组真菌α多样性(Shannon、Chao1指数)显著高于MED组,且β多样性显示,两组间在菌群表现出显著差异。在门水平上,发现MEF组中Mucoromycota和Microsporidia显著富集。在纲水平上,包括Eurotiomycetes、Sordariomycetes和Malasseziomycetes在内的16个类群在B组中表现出较高的丰度,而Xylonomycetes在MED组中富集更多。真菌共生网络分析表明,MEF组互作节点和边数显著增加,以曲霉属(Aspergillus)为关键菌。这些特征提示MEF组真菌群落结构更复杂。
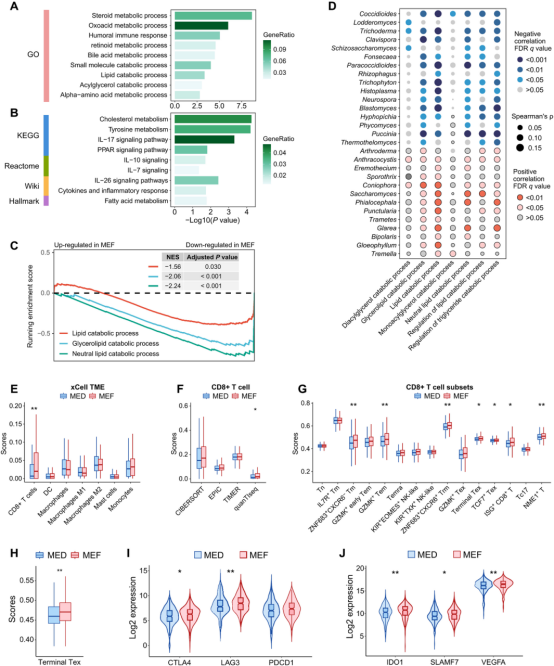
脂质代谢抑制与CD8+T细胞耗竭驱动MEF组不良预后
基因集富集分析(GSEA)显示MEF组脂质分解代谢通路(如PPAR信号)显著下调,导致脂质累积(已知RCC不良预后因子)。免疫浸润分析结果(CIBERSORT、xCell等)发现MEF组CD8+T细胞比例升高但终末耗竭Tex、TCF7+ Tex等细胞显著富集(P < 0.01)。此外,免疫抑制基因(如IDO1、SLAMF7和VEGFA)在MEF组中表达上调,实验结果表明TME呈免疫抑制状态。
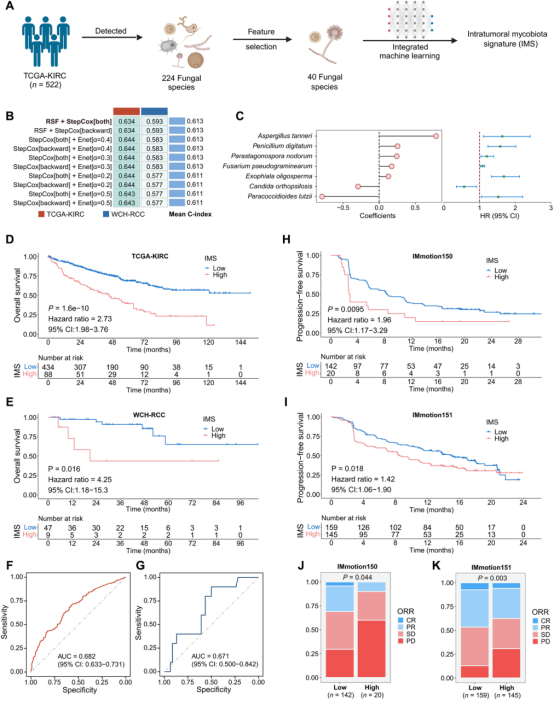
肿瘤内真菌标志(IMS)预测预后及免疫治疗响应
研究者通过机器学习方法构建了肿瘤内真菌特征(IMS),包含7种真菌物种。IMS能够有效预测患者的总体生存率(OS)和免疫治疗反应。在验证队列中,IMS高分组的患者预后较差,且对免疫治疗的反应率显著降低。此外,研究者还通过“合理性-一致性评估”(RCA)框架,将真菌群落特征与转录组数据关联,构建了真菌相关基因表达特征(IMRGES),进一步验证了真菌群在多种癌症中的预测价值。
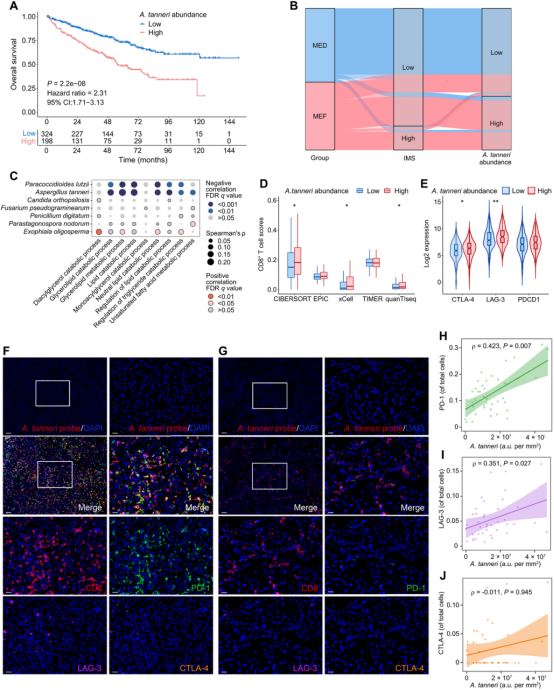
关键真菌物种的鉴定
通过理性一致性评估(RCA)框架,研究筛选了真菌群落中的关键物种——Aspergillus tanneri。该真菌在MEF组中富集,且与脂质代谢通路的下调及CD8+ T细胞耗竭显著相关。通过定量PCR和FISH实验,研究者证实了A. tanneri在肿瘤组织中的存在,并发现其丰度与免疫抑制标志物的表达呈正相关。
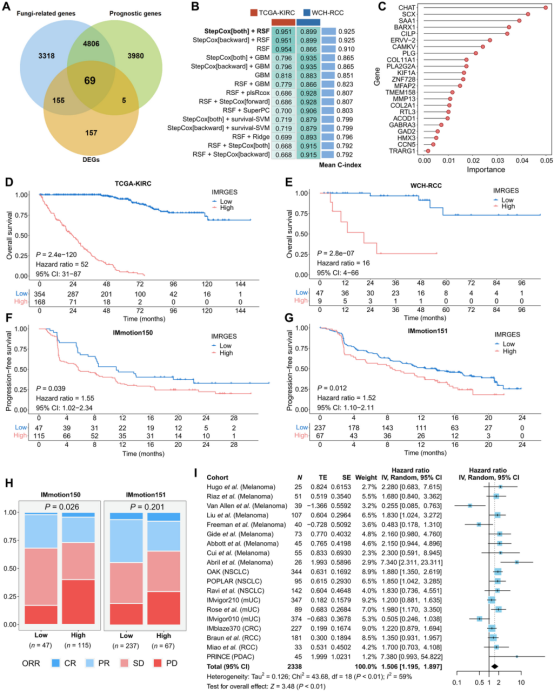
真菌相关基因标志(IMRGES)的泛癌应用
研究中发现,在肾细胞癌患者中,肿瘤内的微生物群与患者预后之间存在显著关联。考虑到真菌与宿主的相互作用通常反映在基因表达模式上,通过分析与肿瘤内微生物群相关的基因表达特征。基于这些特征,研究构建了一个机器学习(ML)预后模型,整合真菌相关基因、差异表达基因和预后基因,构建真菌相关基因标志(IMRGES)。IMRGES高分患者OS显著缩短(TCGA队列:HR=52;WCH队列:HR=16),且在泛癌免疫治疗队列(含2338例患者)中预测不良OS(汇总HR=1.506)。
总结
本研究揭示了肿瘤内真菌群的异质性对RCC患者预后和免疫治疗反应的显著影响,特别是通过调节脂质代谢和诱导T细胞耗竭。构建的IMS和IMRGES特征为预测患者结局提供了新工具,为未来靶向干预提供了潜在方向。这些成果为理解肿瘤微生物-免疫互作机制及优化免疫治疗策略提供了重要依据。
参考文献:Mou W, Deng Z, Zhu L, et al. Intratumoral mycobiome heterogeneity influences the tumor microenvironment and immunotherapy outcomes in renal cell carcinoma [J]. Sci Adv, 2025, 11(15): eadu1727.
影响因子:12.5
 技术咨询:
技术咨询: