慢性炎症鼻上皮的多尺度转录组学揭示了鼻息肉形成过程中的免疫上皮动力学和组织重塑
2025-10-22
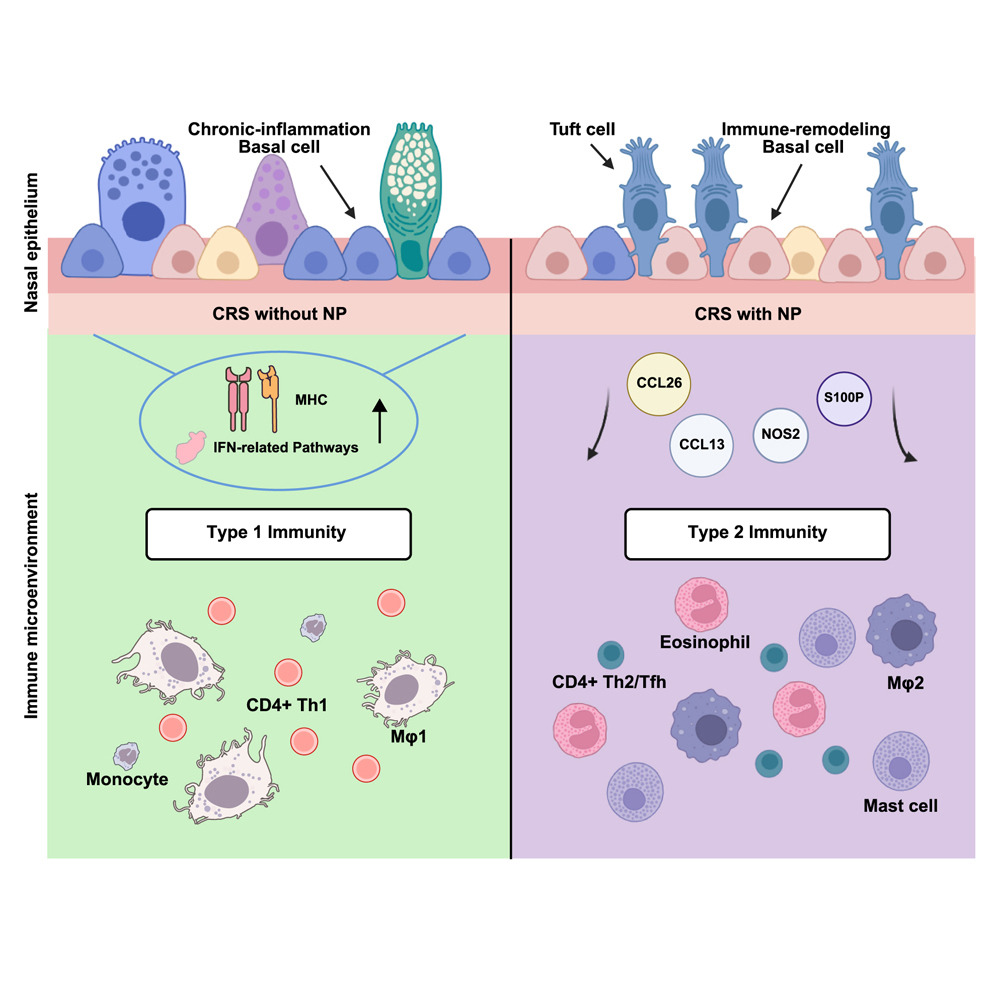
今天分享一篇2025年9月15日在线发表于国际权威学术期刊《Immunity》(免疫学研究领域高影响力学术期刊)上名为Multi-scaled transcriptomics of chronically inflamed nasal epithelium reveals immune-epithelial dynamics and tissue remodeling in nasal polyp formation的文章, IF: 26.3。
慢性鼻窦炎(CRS)是一种常见的鼻腔和鼻窦腔的异质性炎症性疾病,症状严重程度与心脏病和慢性背痛相当,小编本人也深受其扰。CRS根据有无鼻息肉(NPs)分为两种亚型:20%-25%为伴有鼻息肉的CRS (CRSwNP)、75%-80%为无鼻息肉的CRS (CRSsNP)。免疫(IMM)和上皮(EPI)串扰在许多疾病的发病机制和再生中起关键作用,包括CRS。为了理解CRS组织重塑的主要障碍和IMM-EPI串扰的双向互作机制,研究者们使用来自北美和亚洲的两个大型多中心队列的病例进行单细胞转录组和空间转录组学分析,深度揭示了慢性鼻窦炎鼻息肉形成过程中的免疫上皮动力学和组织重塑特征,将免疫-上皮相互作用作为慢性炎症的潜在治疗靶点,也为剖析免疫疾病机制提供了参考。
结果
1. CRS微环境单细胞转录组学分析
首先,研究者们利用单细胞转录组学对初始发现队列(n = 5个健康对照,n = 5个CRSsNP, n = 6个CRSwNP,包括NP和邻近的非息肉筛窦粘膜)的CRS EPI和IMM进行了深入分析。该结果均支持一个模型,即与CRSsNP相比,抑制和调节性T细胞(包括参与2型IMM反应的参与者)反映了CRSwNP的慢性炎症特征。
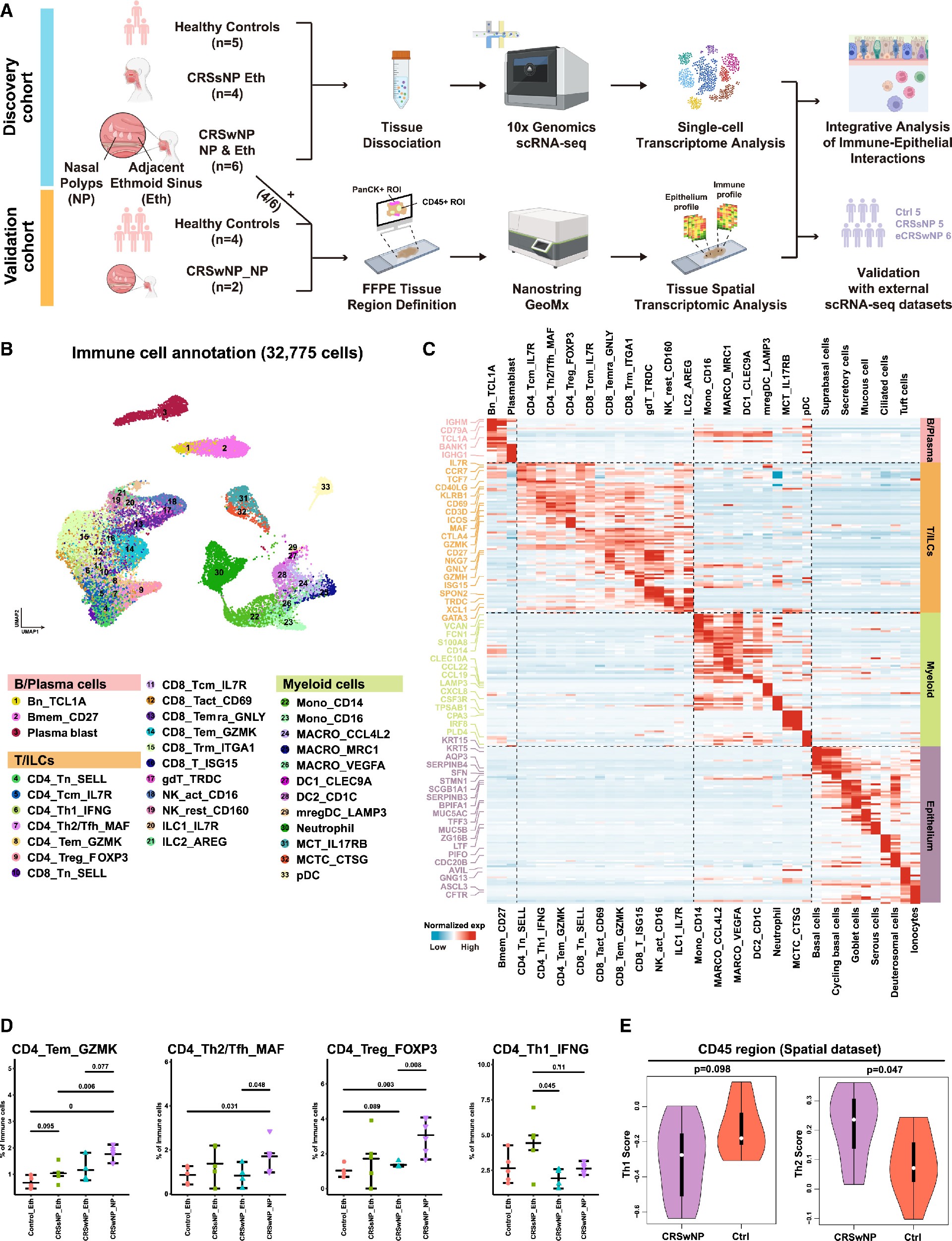
Figure1
2. 巨噬细胞在CRS NPs中的细胞状态适应
在之前的研究中,伴鼻息肉慢性鼻窦炎(CRSwNP)疾病中的炎症是由巨噬细胞及上皮细胞引起的2型炎症,将MLC集群进一步细分亚型,包括巨噬细胞、单核细胞和 树突状细胞(DCs)(图2A)。图2B是CRSsNP和CRSwNP组织中巨噬细胞中的差异基因(DEGs),其中包括与抗原呈递、补体通路激活相关的基因,以及与IMM细胞募集和激活相关的趋化因子。对scRNA-seq数据中的M1和M2的评分也证实了免疫调节性巨噬细胞在息肉组织中的频率增加(图2C),而促炎巨噬细胞的频率相反(图S2B)。
通过空间转录组(图2D)、组织的代表性免疫荧光图像(图2F)和H&E染色及(图2H)评分证实了巨噬细胞通过CCL13和CCL18轴在CRSwNP中募集嗜酸性粒细胞。
为了了解MCs与T细胞中2型IMM反应之间的复杂关系及作用,研究者们观察了两种主要的MCs亚型,并分为高表达IL-17受体B的MCT (IL-17RB;MCT_IL-17RB)和高表达蛋白酶胰蛋白酶(MCTC)以及组织蛋白酶G和切酶(CTSG;MCTC_CTSG)的MCs(图2I)。通过配体受体(L-R)分析了与IMM、组织重塑和CD4+ T细胞相关的几种途径,如IL2、OX40、CCL、EPHB、PROS、IL4/IL13、PARs、CD22、ICAM、SEMA7、LIFR、CLEC和OSM(图2J)。图2K展示了2型炎症的关键介质:IL4和IL13,主要由MCs表达,并且在CRSwNP中涉及MC和CD4+ T细胞的相互作用,而在CRSsNP中不涉及。因此,可以说MC富集促进了NPs的2型炎症反应。
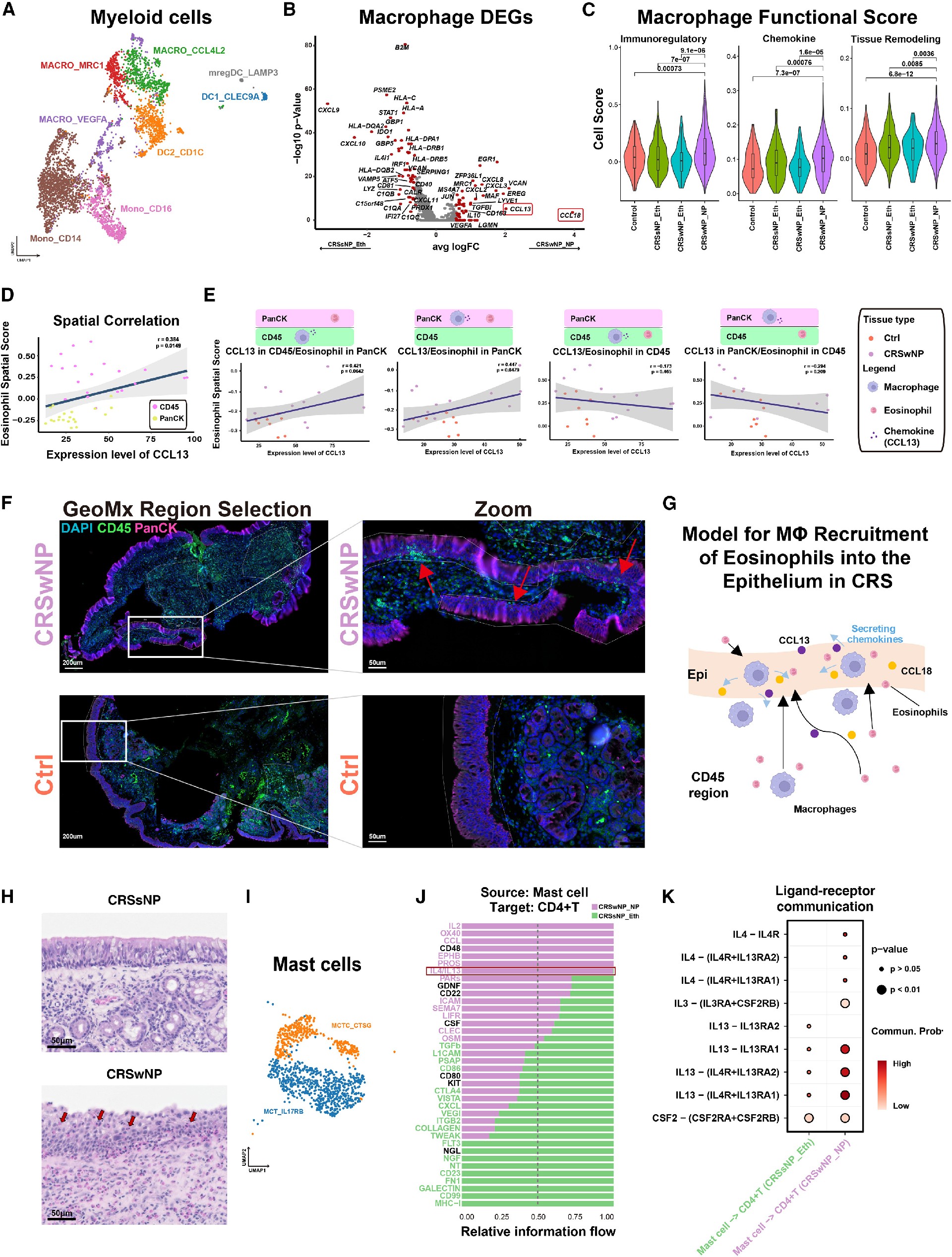
Figure 2
3. IMM-EPI串扰和CRSwNP重构的关键参与者鉴定
在非CRS和CRS样本中,研究者们确定了11种EPI细胞类型(共21,833个细胞),包括分泌型、纤毛型、基底型、杯状型、簇状和其他类型(图3A),量化了IMM和EPI亚群之间的细胞丰度相关性(图3B;黑箱),进一步揭示了CRS组织中复杂的细胞组成和状态(图1D)。图3C、3D展示的相关度趋势表明,簇状细胞和基底细胞可能驱动IMM- EPI相互作用,并在慢性炎症和NP形成中吸引IMM浸润。对不同疾病类型的簇状细胞进行DEG分析后发现了多种信号通路和关键基因在CRSwNP中上调(图3E、3F、3G),L-R分析显示簇状细胞与Th2 CD4+ T细胞相互作用,CRSwNP中原始记忆和中枢记忆CD4+ T细胞耗竭(图3H),与丰度相关性一致(图3B)。空间转录组学证实,CRSwNP上皮原位簇状细胞密度增加(图3I), pank +区域的簇状细胞与CRSwNP组织CD45+区域的Th2 CD4+ T细胞之间存在正空间相关性(r = 0.405, p = 0.078)(图3J)。总之,这些发现暗示化学感觉簇细胞作为IMM细胞募集的介质,包括Th2 CD4+ T细胞,进入CRSwNP微环境,可能导致2型炎症。
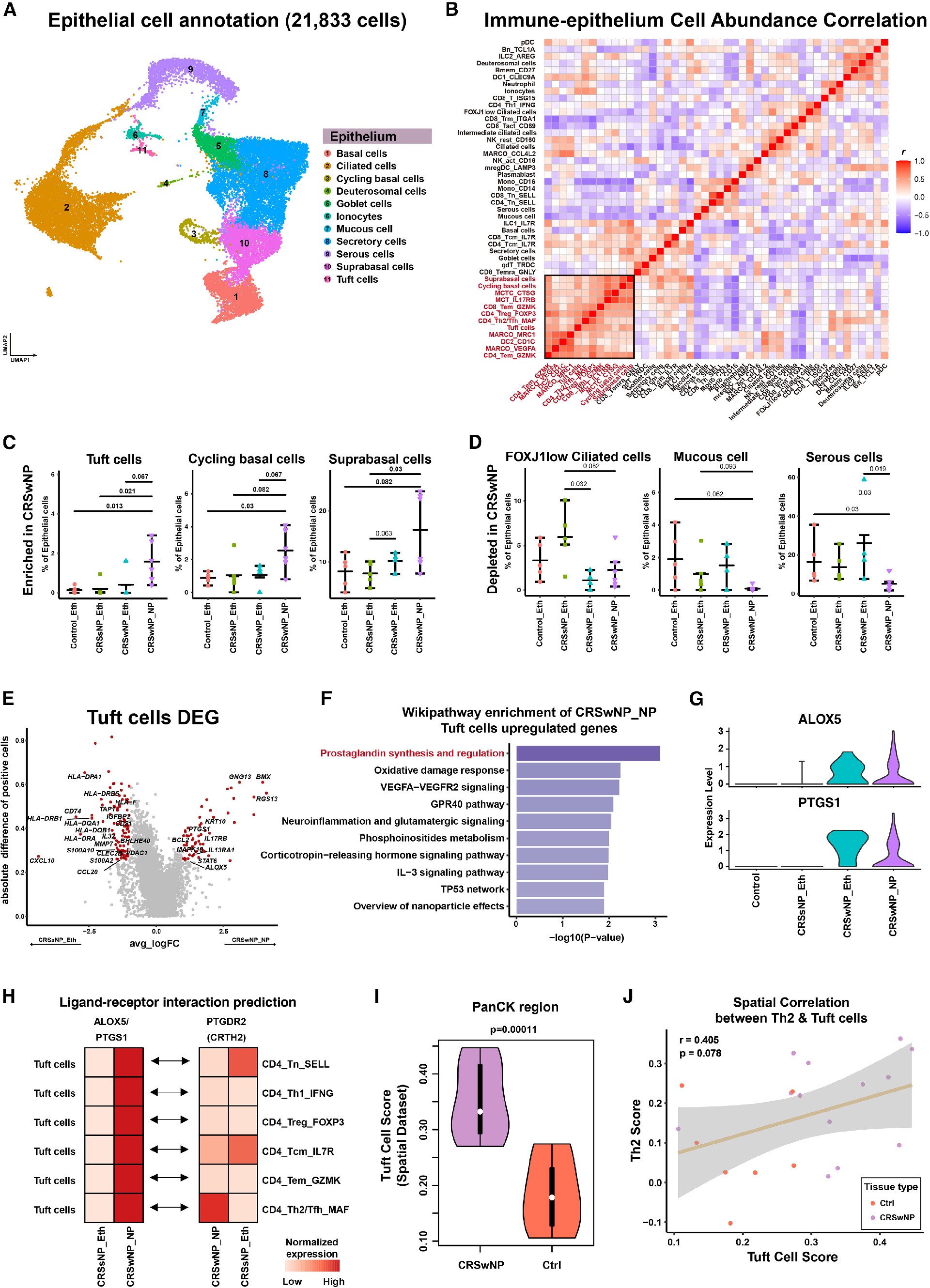
Figure 3
4. 基底细胞轨迹驱动EPI-IMM在NP形成过程中的重塑
接下来,他们研究了基底细胞的作用,观察到基底上细胞和循环基底细胞之间的差异表达(图4A),伪时序分析证实,未分化的基底细胞出现得更早,随后出现了一个分叉点,最初称为Cell-fate1和Cell-fate2(图4B)。来自CRSwNP个体的基底细胞在cell -fate2中富集,而来自对照和CRSsNP组织的基底细胞在cell -fate1中更多地表达(图4C和4D),表明CRSwNP与CRSsNP上呼吸道环境下基底细胞分化的结果不同。对Cell-fate1和Cell-fate2进行DEG分析后(4E和4G),根据关联作用,可以将Cell-fate1重命名为“宿主防御”,将Cell-fate2重命名为“免疫重塑”。研究者们还观察到,在IMM重塑导向的基底细胞中,基础IMM相互作用增加(图4H),代谢、IL-4/IL-13信号传导、中性粒细胞脱粒和组织重塑途径上调(图4I)。这些结果表明基底细胞被推向一种启动IMM吸引和重塑的状态,暗示其分化轨迹是NP形成的潜在决定因素。
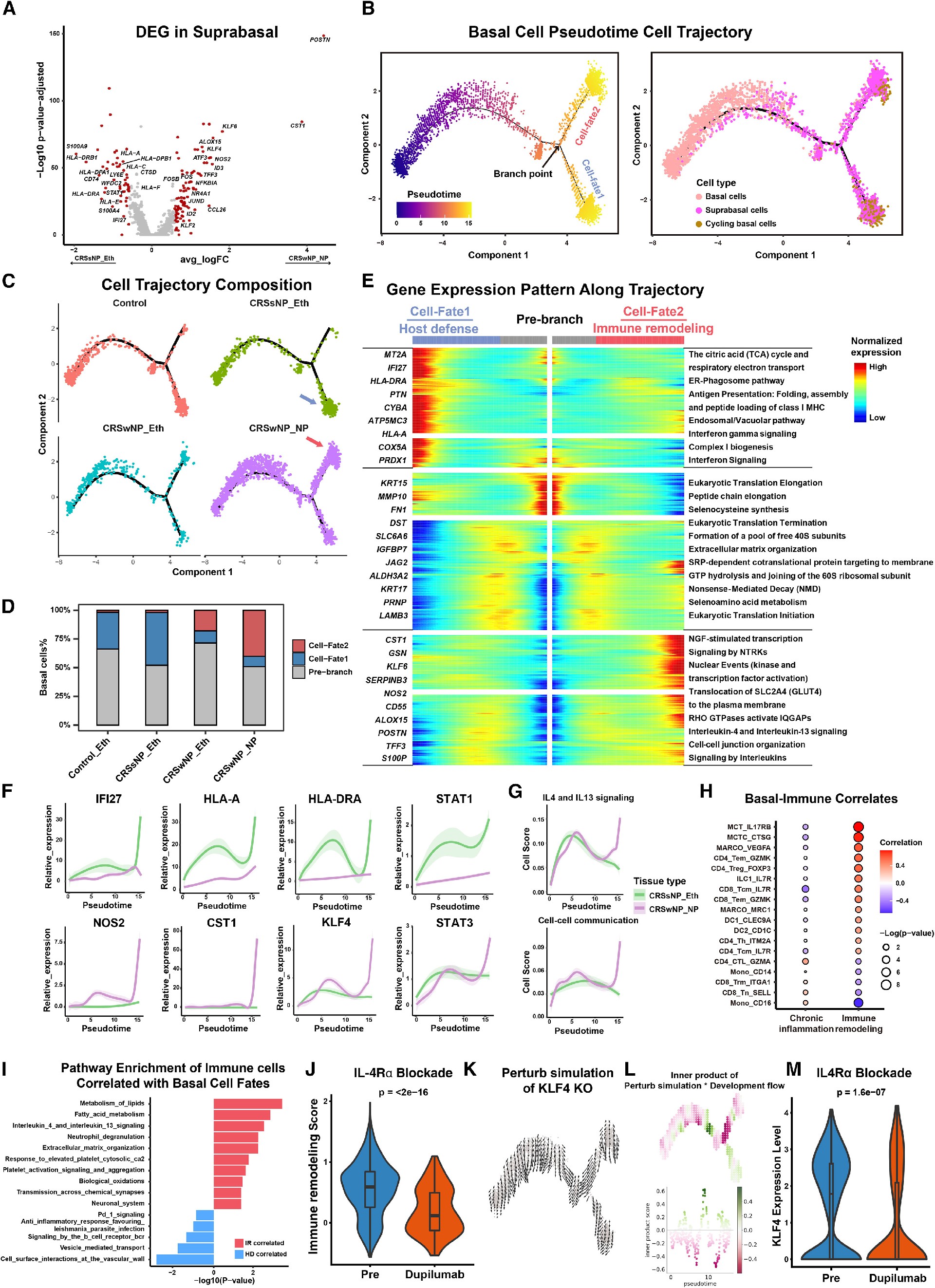
Figure 4
5. 大规模空间转录组学验证队列中保守的IMM-EPI重塑组织特征
为了确定研究结果的普遍性和临床相关性,研究者们收集了来自61个CRSwNP、45个CRSsNP和7个对照个体的大量鼻组织(图5A),使用GeoMx空间转录组学与PanCK、CD45和CD68抗体结合来指导特定细胞类型的全转录组捕获(图5A),从每个ROI中提取下游转录组(图5B),进行DEG分析(图5C)、单细胞空间分析(图5A)、细胞型富集分析(图5D、5E)、MLC室的空间DEG分析(图5F)、通路富集(图5G)以及趋化因子分析(图5H)、REACTOME通路分析(图5I)等。这些数据支持簇状细胞、CD4+ Th2细胞和MLCs协同重塑CRSwNP组织微环境的模型(图5L)。
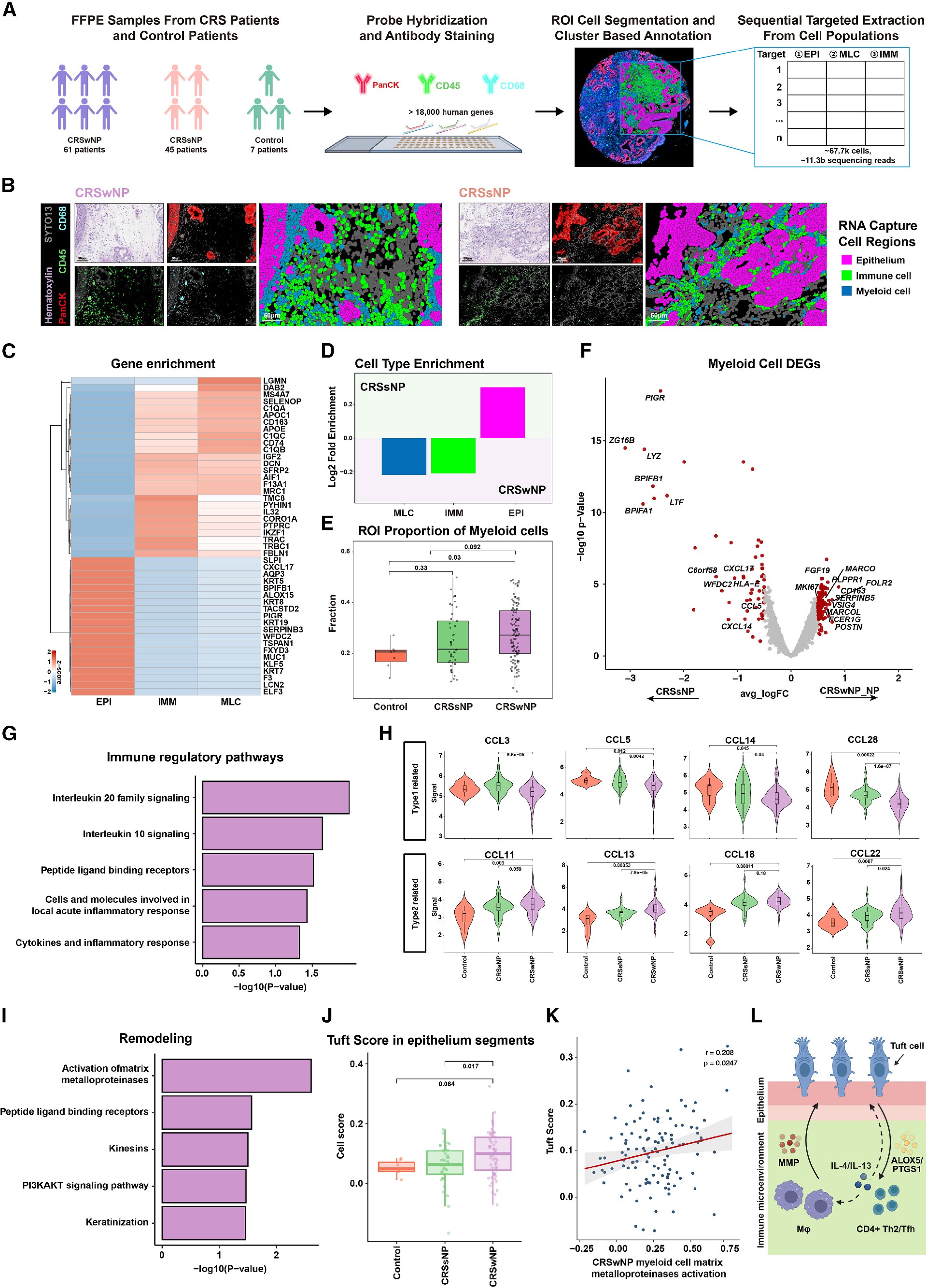
Figure 5
6. 空间转录组学鉴定了CRSwNP中IMM-EPI重塑及其相关途径
研究者们对EPI区域进行PCA,揭示了非CRS、CRSsNP和CRSwNP个体在组成和基因程序上的系统性差异(图5A、6A、S6A和S6B)。通过比较CRSsNP和CRSwNP的DEG分析,EPI细胞发现了多个DEG(图6B),途径分析显示,CRSwNP中G蛋白偶联受体(GPCR)信号通路、L-R相互作用和角化富集,而CRSsNP中抗原呈递和代谢途径上调(图6C),支持了先前的发现(图4E)。将来自每个个体组织ROI的EPI转录组从scRNA-seq中投射到基底细胞轨迹上(图4B和4C),也能发现类似的分布:CRSsNP样本在宿主防御命运中富集,CRSwNP在IMM重塑中富集(图6D和6E),与先前的单细胞数据一致(图4B - 4d)。与非CRS和CRSsNP样本相比,CRSwNP EPI细胞中的IMM重塑特征显著增加(图6F)。
在图6G中,研究者们展示了共表达的IMM-EPI基因模块分层亚型(图6G),富集指向中性粒细胞脱粒、糖基化和细胞外基质(ECM)粘附途径。
最后,L-R分析发现,在CRSwNP中,EPI-IMM串扰具有一致的2型炎症信号,而在CRSsNP中则没有(图6H)。利用Delaunay三角剖分技术进行空间可视化突出了CRSwNP组织中复杂的细胞组织(图6I),几何分析证实了CRSwNP中EPI-IMM相互作用相对于其他组升高(图6J)。总之,这些发现支持了一个涉及CRSwNP中基底细胞、2型T细胞和MLC群体的IMM-EPI重塑模型。
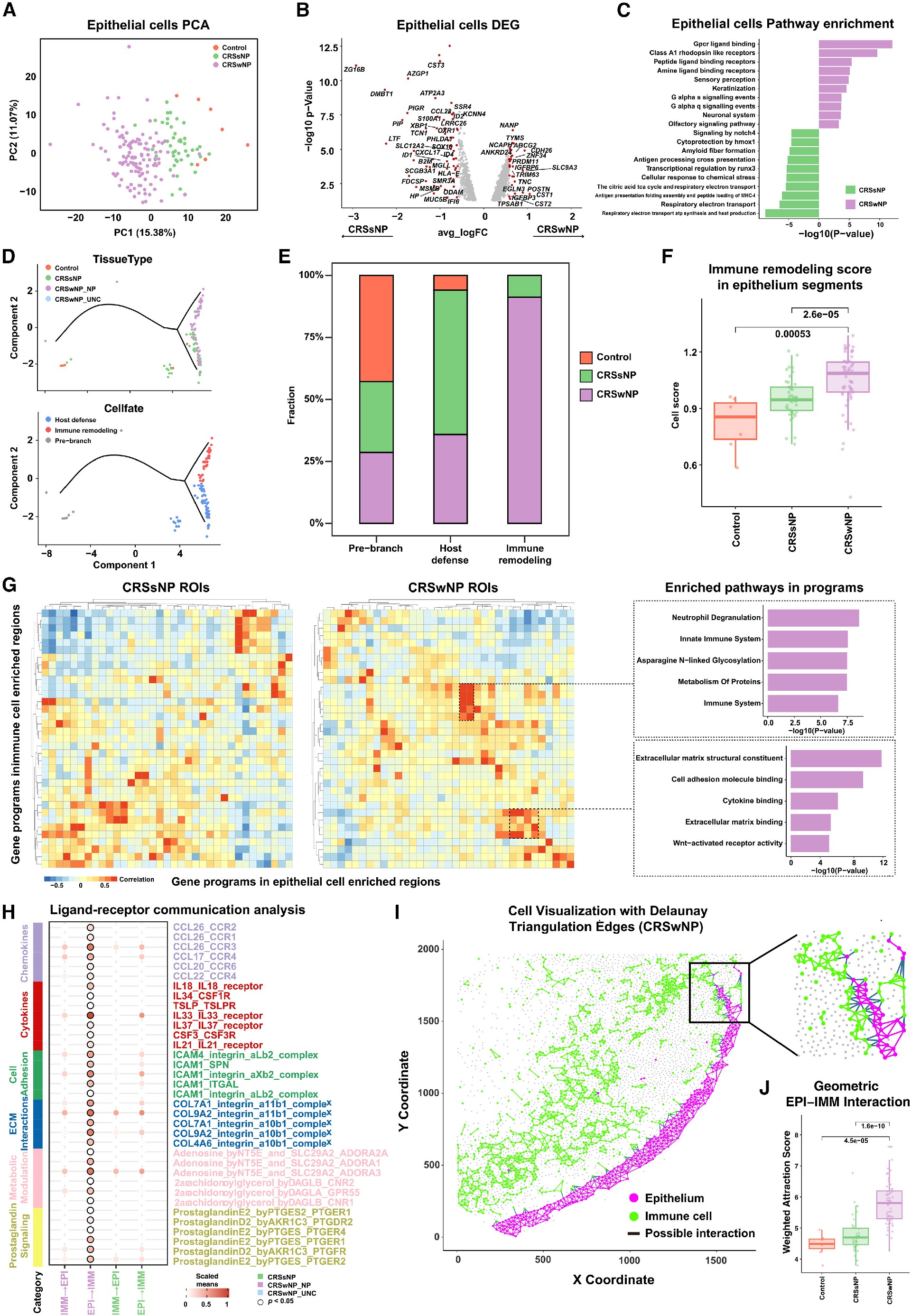
Figure 6
本研究通过整合scRNA-seq和GeoMx数字空间Profiler (DSP)空间转录组学来剖析CRS组织水平炎症,其CRS组织环境的广泛IMM-EPI数据资源为上呼吸道炎症的机制发现和治疗创新提供了参考框架。
 技术咨询:
技术咨询: