“肠道-脂肪轴”——决定你的运动控糖效益
2026-01-13
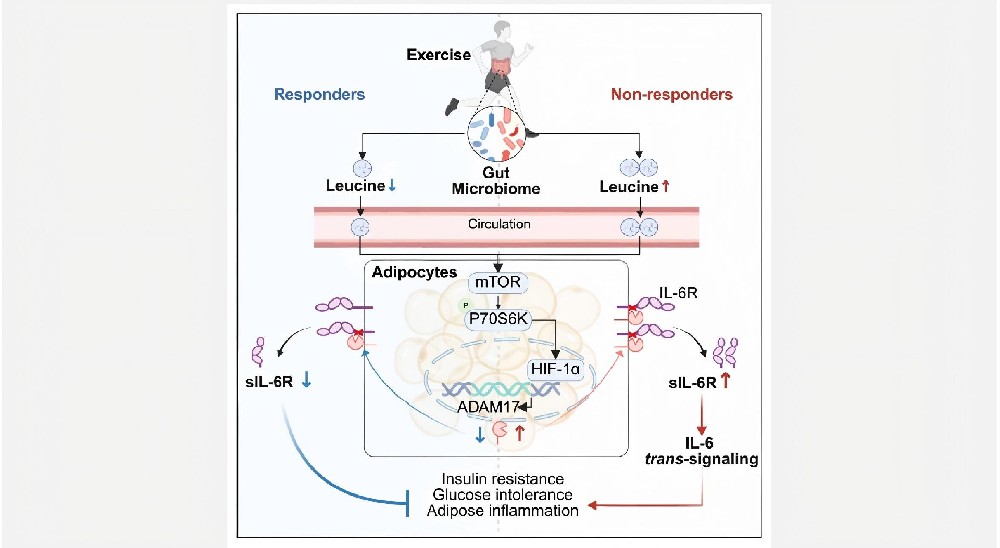
运动是一种常用于预防和管理2型糖尿病的非药物干预手段,适度运动干预不仅能降低2型糖尿病风险并延缓其发病进程,还能改善糖尿病患者的胰岛素抵抗与血糖控制。尽管运动是预防和管理糖尿病的有效干预措施,但个体对运动干预产生的代谢适应存在高度差异,这阻碍了其在临床中的广泛应用。在胰岛素敏感性和血糖稳态方面,相当一部分人群对各种运动方案无反应甚至出现不良反应,其运动反应异质性的分子机制尚需探索。
本次分享一篇徐爱民教授团队于2025年11月18日发表在Cell Metabolism(IF=30.9)杂志上名为Gut microbiome-adipose crosstalk modulates soluble IL-6 receptor influencing exercise responsiveness in glycemic control and insulin sensitivity的文章,文章通过解密肠道菌群-脂肪细胞互作调节sIL-6R影响运动对血糖的控制,揭示靶向脂肪细胞sIL-6R有望成为提升运动效益、个性化预防糖尿病的新策略。
文章链接:https://www.cell.com/cell-metabolism/fulltext/S1550-4131(25)00473-5
图形摘要(见首图)
血清sIL-6R水平在运动反应者与无反应者中存在变化差异
在先前一项针对39名糖尿病前期的超重/肥胖男性的随机临床试验中,观察到个体对为期12周的高强度间歇训练后,在胰岛素敏感性和血糖控制方面存在高度差异的反应性,并划分为运动反应者(Responders,Rs)与无反应者(Non-Responders,NRs)。为了识别可能决定运动反应性的循环外泌因子,本研究检测了64种血清肽类激素、细胞因子和生长因子的水平。其中,36种循环因子表现出显著变化。运动显著降低了所有组的血清抵抗素、脂质运载蛋白2和瘦素水平,同时增加了脂联素水平。同样,作为一种公认的外泌因子的IL-6,在运动适应后于Rs和NRs中展现出平行的升高轨迹(图1A)。
本研究进一步检测探索队列与验证队列的数据后发现,运动干预后Rs血清sIL-6R水平持续显著降低,而NRs则明显升高(图1B)。与Rs相比,NRs在训练后相对于基线值的sIL-6R高出30%(图1C)。此外,在合并队列中,运动训练后sIL-6R与空腹胰岛素水平及胰岛素抵抗指数的变化呈显著正相关(图1D、1E)。提示sIL-6R的差异性变化可能是导致运动对Rs和NRs胰岛素敏感性及葡萄糖代谢产生不同影响的重要因素。
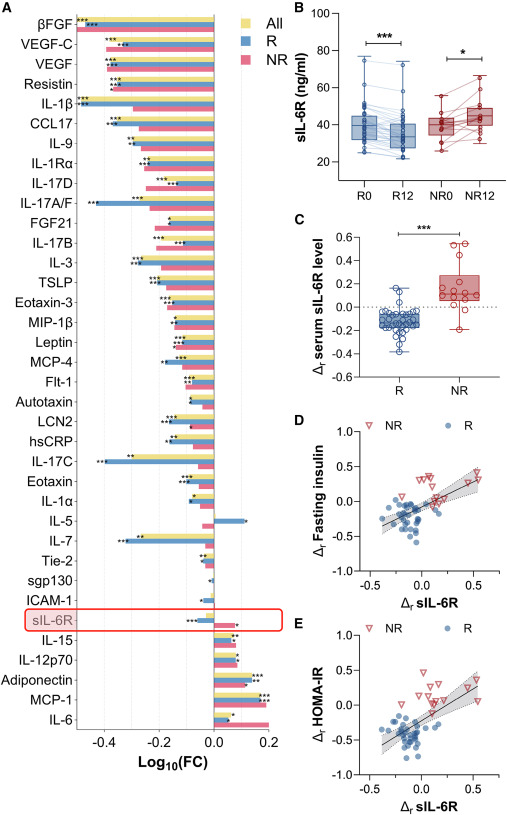
图1 高强度间歇训练12周后,运动Rs和NRs的循环sIL-6R变化差异
白色脂肪组织是循环sIL-6R分泌的主要来源
sIL-6R源自锚定于细胞膜上的IL-6Rα经ADAM17蛋白水解作用的产物。本研究筛选了不同器官/组织中IL-6Rα和ADAM17的基因表达显示,ADAM17与IL-6Rα在人类脂肪组织和肺部存在共表达,且丰度显著高于其他组织(图2A)。在小鼠中,皮下白色脂肪组织(white adipose tissue,WAT)与附睾WAT均表现出更高的ADAM17与IL-6Rα表达(图2B-2D)。在皮下WAT与附睾WAT中,成熟脂肪细胞的ADAM17表达水平均显著高于配对的基质血管组分,而IL-6Rα表达水平在这两类细胞组分中相当(图2E-2H)。与棕色脂肪组织、肝脏和骨骼肌相比,皮下WAT与附睾WAT向条件培养基中释放的sIL-6R量最高,且肥胖小鼠的皮下WAT与附睾WAT释放的sIL-6R水平较瘦型小鼠显著增加(图2I)。在附睾WAT与皮下WAT中,成熟脂肪细胞分泌的sIL-6R水平均比基质血管组分高出2倍以上(图2J、2K)。综合而言,WAT可能是肥胖状态下sIL-6R产量升高的主要贡献者。
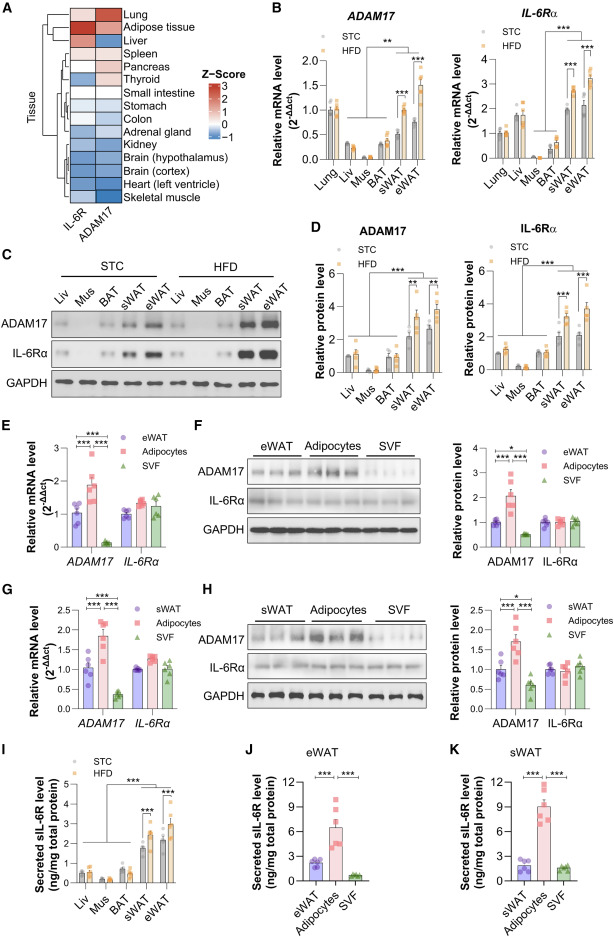
图2 WAT是肥胖中升高sIL-6R的主要产生部位
运动干预降低sIL-6R产生以缓解肥胖诱导的小鼠葡萄糖不耐受及胰岛素抵抗
为探究运动干预是否调节循环sIL-6R水平,本研究对雄性C57BL/6J小鼠进行为期8周的45%高脂饮食处理后,实施了4周的跑台训练(图3A)。运动训练显著降低了肥胖诱导的血清sIL-6R升高,使其恢复至与瘦型小鼠相当的水平(图3B)。运动的这一效应伴随着肥胖诱导的附睾WAT与皮下WAT中HIF1α和ADAM17表达的显著逆转,而对两种脂肪库中IL-6Rα的表达均无明显影响(图3C–3H)。
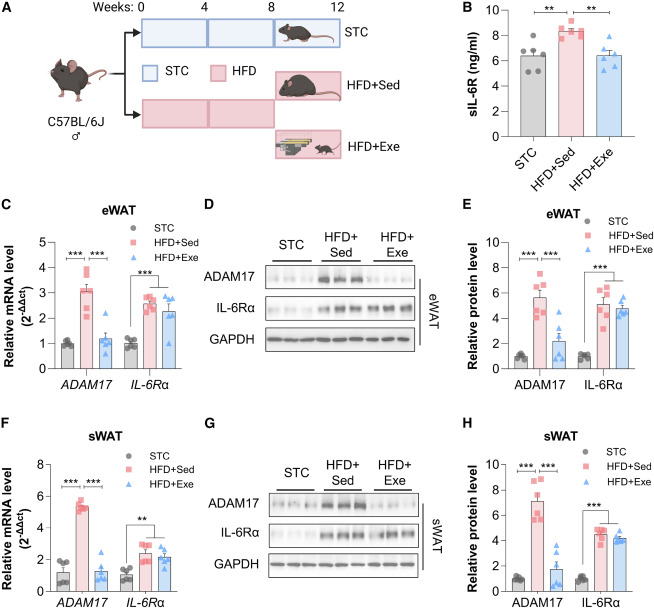
图3 运动训练对肥胖小鼠循环sIL-6R水平和脂肪组织中ADAM17和IL-6Rα表达的影响
本研究接下来试图评估sIL-6R诱发的IL-6反式信号传导是否调节小鼠体内的运动代谢效应。与静息小鼠相比,为期4周的跑台运动有效降低了IL-6/sIL-6R处理组和PBS处理组的体重及脂肪量(图4A、4B),这反映了本研究的临床观察结果:运动训练后,Rs和NRs实现了相当的体重减轻。然而,与PBS处理组相比,IL-6/sIL-6R处理显著削弱了运动在降低空腹及进食状态下的胰岛素和葡萄糖水平方面的效果(图4C和4D)。同时,运动诱导的胰岛素敏感性及血糖控制的改善,在很大程度上被IL-6/sIL-6R复合物处理所抵消(图4E和4H)。接受IL-6/sIL-6R复合物与PBS的静息小鼠之间,在血糖、循环胰岛素水平、葡萄糖耐量和胰岛素敏感性方面均未观察到明显差异(图4C–4H),这表明IL-6反式信号传导选择性地参与肥胖小鼠中运动介导的代谢调节。
IL-6反式信号传导的激活已被证明可通过促进脂肪组织中巨噬细胞的招募部分触发促炎反应。因此,本研究评估了运动和IL-6/sIL-6R处理对肥胖诱导的附睾WAT炎症的影响。正如预期,运动显著减轻了饮食诱导肥胖小鼠附睾WAT中的巨噬细胞积累(图4I–4L)。然而,运动这种减少脂肪巨噬细胞的作用被IL-6/sIL-6R复合物的给予显著阻断。同样,与静息组相比,运动组小鼠附睾WAT中促炎基因的表达显著降低,而运动的这些抗炎效果被IL-6/sIL-6R处理所削弱(图4M)。这些发现共同表明,sIL-6R激活的IL-6反式信号传导损害了运动对葡萄糖代谢和胰岛素作用的有益影响,其机制可能通过脂肪组织炎症实现。
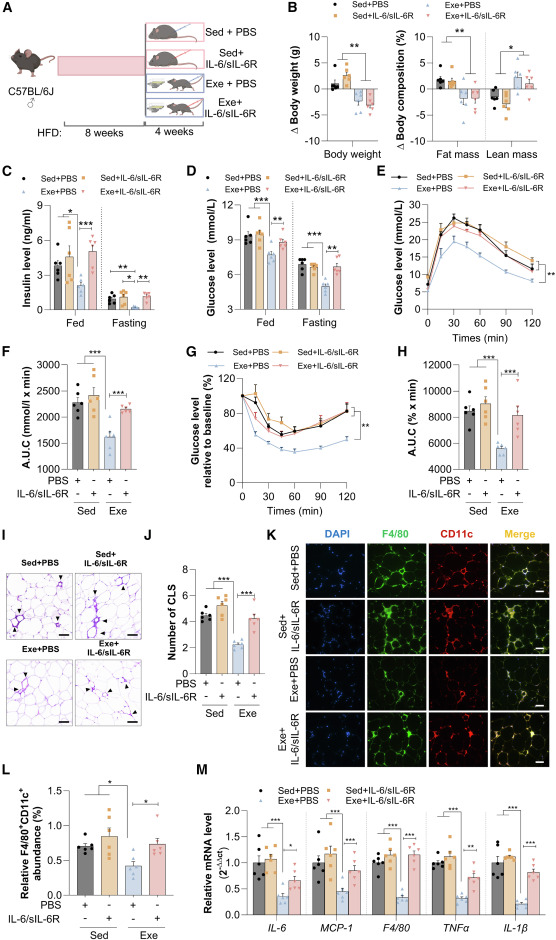
图4 IL-6/sIL-6R复合物的补充消除了运动对肥胖小鼠葡萄糖代谢和胰岛素敏感性的有益影响
亮氨酸通过mTOR-HIF1α信号通路上调脂肪细胞中ADAM17表达,从而诱导sIL-6R产生
本研究接下来探究了运动干预后,Rs和NRs体内sIL-6R发生差异性变化的分子基础。值得注意的是,以支链氨基酸和短链脂肪酸为代表的微生物组调节代谢产物的不同变化,是影响运动在血糖控制和胰岛素敏感性方面反应性的重要因素。因此,本研究进行了斯皮尔曼相关性分析,以探究运动训练前后循环代谢物变化与sIL-6R水平之间的关系。该分析鉴定出4种循环代谢物与本研究队列中的血清sIL-6R水平显著相关(图5A)。其中,亮氨酸是排名最高的候选物,呈正相关性。在原代小鼠脂肪细胞中,亮氨酸处理剂量依赖性地增加了sIL-6R向条件培养基中的释放(图5B)。亮氨酸对脂肪细胞的这种效应与ADAM17表达的显著增加相关,而与IL-6Rα的表达无关(图5C和5D),表明亮氨酸直接作用于脂肪细胞,通过诱导ADAM17来促进sIL-6R的释放。
亮氨酸是众所周知的mTOR-p70S6激酶1激活剂,它通过调节HIF1α等多种转录因子来触发下游信号级联反应。ADAM17的启动子区域含有缺氧诱导因子反应元件,且HIF1α已被证实可介导缺氧和高糖诱导的ADAM17表达。因此,本研究探究了亮氨酸是否通过激活mTOR-HIF1α-ADAM17信号级联来诱导脂肪细胞产生sIL-6R。正如预期,用亮氨酸处理原代小鼠脂肪细胞增强了P70S6K苏氨酸369位点的磷酸化,并以剂量依赖方式显著增加了HIF1α和ADAM17的蛋白及mRNA水平(图5C和5D)。亮氨酸对HIF1α和ADAM17表达以及sIL-6R产生的刺激作用,可被mTOR抑制剂预处理脂肪细胞完全消除(图5E–5G)。一致地,使用HIF1α的抑制剂(图5H–5J)或siRNA进行阻断,均能逆转亮氨酸诱导的ADAM17表达和sIL-6R分泌(图5K–5M)。
为进一步明确脂肪细胞ADAM17作为介导亮氨酸诱导的ADAM17表达和sIL-6R产生的关键枢纽作用,本研究通过体外实验发现,亮氨酸刺激显著增强了从野生型小鼠分离的原代脂肪细胞中ADAM17的表达和sIL-6R的分泌(图5N–5Q)。然而,尽管上游mTOR-HIF1α信号轴被激活,这种刺激效应在ADAM17缺陷的原代脂肪细胞中完全消失(图5N–5Q)。此外,腹腔注射亮氨酸以剂量依赖方式显著增加了野生型小鼠的循环sIL-6R水平(图5R)。这些结果表明ADAM17是亮氨酸在脂肪细胞中引发sIL-6R产生的关键介质。
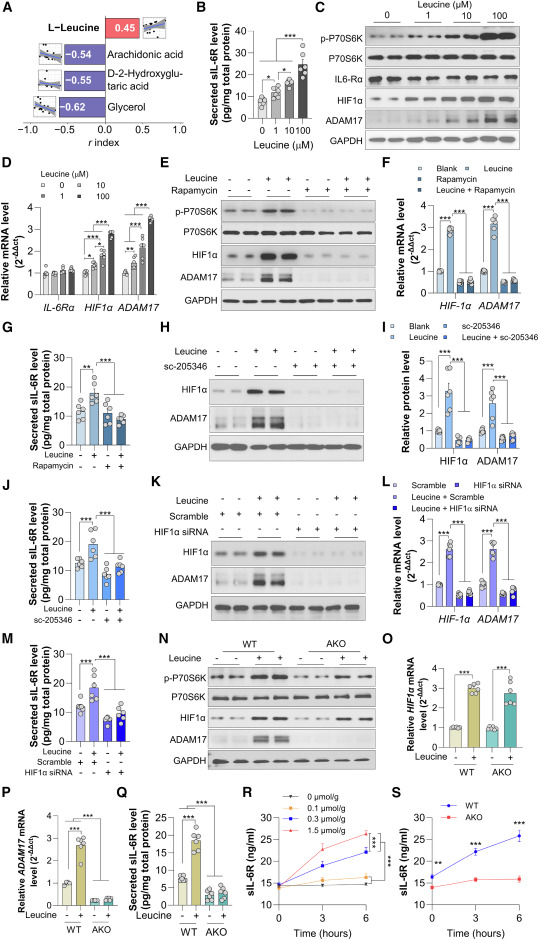
图5 白藜芦醇通过mTOR-HIF1α信号轴诱导脂肪细胞中ADAM17的表达和sIL-6R的分泌
运动反应者与无反应者的粪菌移植在受体小鼠中引发sIL-6R的差异性变化
为探究在运动Rs和NRs中观察到的循环sIL-6R的两极分化变化是否归因于肠道微生物群依赖性的亮氨酸,本研究接下来通过口服灌胃法,将运动Rs和NRs在完成12周运动训练后的粪便悬液,分别移植给经抗生素处理的饮食诱导肥胖小鼠模型(图6A)。通过宏基因组测序验证了粪菌移植模型的成功建立。与PBS对照组小鼠相比,接受NRs粪菌移植的小鼠血清sIL-6R和亮氨酸水平均显著升高,而Rs粪菌移植组则相反降低(图6B和6C)。这些小鼠的血清sIL-6R水平与亮氨酸水平呈显著正相关(图6D)。此外,NRs粪菌移植显著增加了附睾WAT和皮下WAT中HIF1α和ADAM17的表达,而在Rs粪菌移植组中则明显降低(附睾WAT见图6E-6G;皮下WAT见图6H-6J)。
本研究通过每日腹腔注射亮氨酸给Rs粪菌移植小鼠,进一步研究了亮氨酸在sIL-6R分泌中的因果作用。正如预期,补充亮氨酸导致接受Rs粪菌移植的小鼠血清sIL-6R水平升高约1.5倍(图6K),同时伴随着附睾WAT和皮下WAT中P70S6K苏氨酸386位点磷酸化的明显升高,以及HIF1α和ADAM17表达的显著增加(附睾WAT见图6L-6N;皮下WAT见图6O-6Q)。这些体内数据支持了肠道微生物群介导的亮氨酸作用于脂肪组织,通过mTOR-HIF1α- ADAM17轴促进sIL-6R释放的观点。
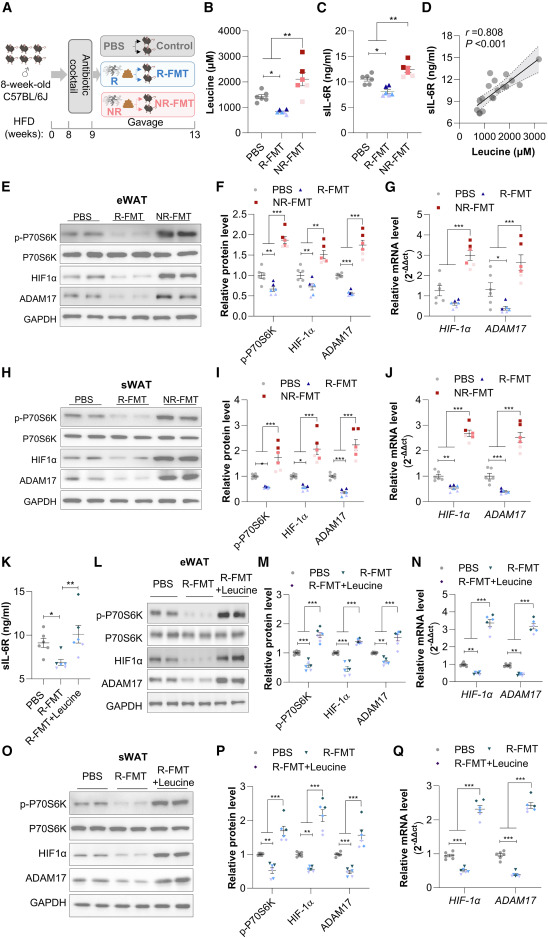
图6 接受运动响应者与非响应者粪菌移植的小鼠,循环亮氨酸和sIL-6R变化趋势相反
脂肪组织选择性敲除ADAM17或药物阻断sIL-6R可恢复无反应者粪菌移植对胰岛素敏感性和血糖稳态的改善作用
为确认脂肪细胞ADAM17是介导亮氨酸诱导循环sIL-6R升高的关键枢纽,本研究在脂肪细胞特异性ADAM17敲除小鼠及其野生型同窝对照小鼠中,比较了NRs和Rs粪菌移植的代谢效应。本研究对高脂饮食喂养16周后的脂肪细胞特异性ADAM17敲除小鼠和野生型小鼠进行NRs或Rs粪菌移植处理(图7A)。粪菌移植4周后,NRs粪菌移植组和Rs粪菌移植组中,脂肪细胞特异性ADAM17敲除小鼠与野生型小鼠的体重、脂肪量和瘦体重的变化也相当(图7B-7D)。正如预期,与Rs粪菌移植组相比,接受NRs粪菌移植的高脂饮食喂养野生型小鼠,其进食和空腹状态下的血糖和胰岛素水平显著升高(图7E和7F),且在葡萄糖耐量试验和胰岛素耐量试验期间表现出更差的血糖偏移(图7G-7J)。相比之下,接受NRs粪菌移植的高脂饮食喂养脂肪细胞特异性ADAM17敲除小鼠,其进食和空腹状态下的葡萄糖和胰岛素水平显著降低,与接受NRs粪菌移植的野生型小鼠相比,其血糖稳态和胰岛素敏感性明显改善(图7E-7J)。值得注意的是,尽管NRs粪菌移植4周后,野生型和脂肪细胞特异性ADAM17敲除小鼠的循环亮氨酸水平相当(图7K),但接受NRs粪菌移植的野生型小鼠的血清sIL-6R水平显著高于接受NRs粪菌移植的脂肪细胞特异性ADAM17敲除小鼠或接受Rs粪菌移植的野生型小鼠(图7L)。接受NRs粪菌移植的脂肪细胞特异性ADAM17敲除小鼠中,肥胖引发的巨噬细胞浸润显著低于接受NRs粪菌移植的野生型小鼠。而在Rs粪菌移植组中,脂肪细胞特异性ADAM17敲除小鼠与野生型小鼠的附睾WAT巨噬细胞浸润无明显差异(图7M-7P)。同样,与接受NRs粪菌移植的野生型小鼠相比,接受NRs粪菌移植的脂肪细胞特异性ADAM17敲除小鼠,其附睾WAT中多种促炎基因的表达显著降低,而在Rs粪菌移植组的野生型或脂肪细胞特异性ADAM17敲除小鼠的附睾WAT中,未观察到这些基因表达的类似变化(图7Q)。
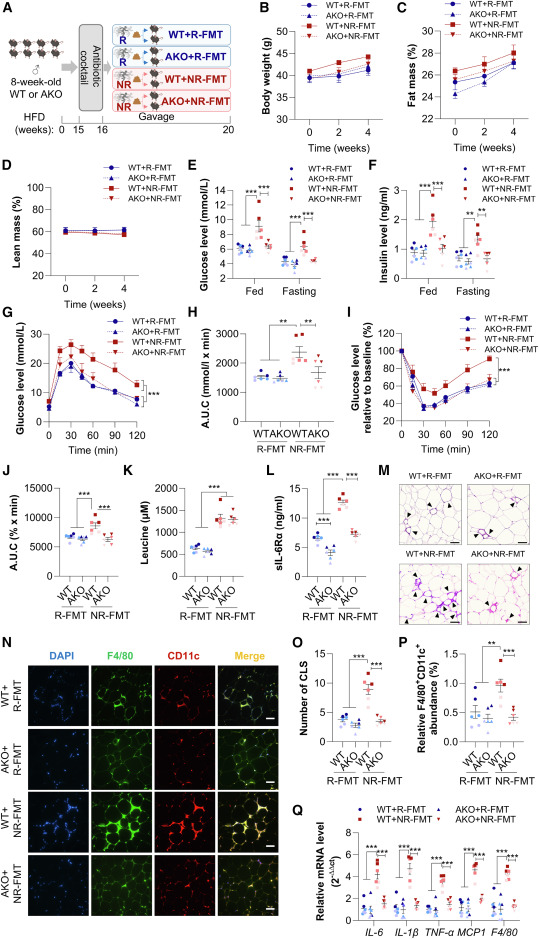
图7:脂肪细胞特异性敲除ADAM17可改善NR-FMT小鼠的葡萄糖稳态和胰岛素敏感性,降低sIL-6R分泌,并减轻脂肪组织炎症
综上,从人类到小鼠的转化研究揭示了肠道菌群-脂肪组织轴的核心机制:亮氨酸通过激活脂肪细胞内mTOR-HIF1α-ADAM17信号级联,驱动sIL-6R产生,进而调控运动改善胰岛素敏感性与血糖控制的效果。这为运动干预效果的个体差异提供了分子基础,提示靶向微生物亮氨酸生成或ADAM17-sIL-6R通路的策略,有望提升运动在糖尿病预防中的效益。
 技术咨询:
技术咨询: