调节性T细胞:从基础生物学到疾病调控的临床转化
2026-01-27
引言:免疫系统的“刹车”与“油门”
免疫系统的核心在于维持精准的平衡,其功能既需有效清除病原体与异常细胞,又必须避免对自身组织造成伤害。这种被称为免疫稳态的微妙状态,依赖于一套复杂的调节网络。其中,调节性T细胞(Treg)作为一类功能特化的CD4+ T淋巴细胞亚群,扮演着至关重要的抑制性调节角色。该细胞亚群最明确的定义性特征是高表达转录因子Foxp3。Foxp3并非简单的表面标记,而是主导其发育、稳定及功能执行的核心调控枢纽。Treg的功能失衡与多种重大疾病病理紧密相关,但其作用方向截然不同。在自身免疫性疾病、过敏及器官移植排斥中,常观察到Treg数量相对不足或功能受损,导致免疫反应过度激活。相反,在肿瘤微环境中,癌细胞可招募并扩增Treg,利用其强大的抑制功能来压制机体抗肿瘤免疫应答,促进免疫逃逸。此外,新兴研究还揭示其在代谢性疾病、组织修复及神经免疫调节等广泛生理病理过程中的作用。因此,深入理解其生物学特性并发展精准的调控策略,已成为免疫治疗领域的前沿焦点。
认识Treg:起源与核心特征
Treg具有明确的表型特征以便于鉴别,其典型标志为表面高表达CD25,同时低表达CD127。这种CD4+CD25高CD127低的表型,是区分Treg与活化的常规效应T细胞的关键依据之一。此外,抑制性分子CTLA-4的高表达也是其重要功能特征。
根据发育起源,Treg主要分为两类。一部分在胸腺中分化成熟,直接进入外周循环,承担维持系统性自身免疫耐受的基础功能。另一部分则由外周组织中的常规CD4+ T细胞,在特定抗原刺激及微环境信号(如转化生长因子-β)的驱动下诱导生成,这类细胞对于建立对局部抗原(如肠道共生菌群、移植物抗原)的特异性耐受至关重要。
Treg的稳定性指其在炎症环境中维持调节表型与功能、不发生向效应细胞转分化的能力(图1)。这种特性与其关键调控基因座上的特定表观遗传修饰状态密切相关,该区域的稳定低甲基化状态是维持其谱系特征的核心机制。目前,基于标准分离扩增流程制备的临床级Treg产品,在回输后显示出可接受的功能稳定性。

图1. 调节性T细胞稳定性的调控机制
Treg还具备一定的功能可塑性,能够根据不同炎症环境中的细胞因子信号,调整其转录组与蛋白表达,分化出具有不同趋化或抑制偏向的功能亚群。这种适应性使其能够精准抑制特定类型的免疫反应,但其功能状态也因而高度依赖于复杂的微环境信号网络(图2)。

图2. 调节性T细胞的功能可塑性
Treg发挥作用的分子机制
Treg并非通过单一方式发挥功能,而是采用一套多层次、多靶点的复合策略来实施免疫抑制,这些机制协同作用,共同维持免疫稳态。其作用模式大致可归纳为三大策略:直接调控抗原呈递细胞功能、塑造局部抑制性微环境、以及通过“传染性耐受”扩大调节效应(图3)。
1. Treg能够通过细胞间直接接触,在免疫反应的起始阶段进行干预。当Treg识别抗原呈递细胞表面的特定抗原后,其高表达的抑制性受体CTLA-4会与APC上的共刺激分子CD80/CD86以高亲和力结合。这一行为具有双重效果:一方面,它物理性阻断了CD28介导的、对效应T细胞激活至关重要的共刺激信号;另一方面,CTLA-4可引发CD80/CD86的内吞与降解,从而降低APC的共刺激能力,使其无法有效激活幼稚T细胞。这种对APC的“功能调校”是早期抑制的关键。
2. Treg通过分泌抑制性细胞因子及调节局部代谢环境,实现对已激活免疫细胞的压制。其分泌的转化生长因子-β和白细胞介素-10是两大核心介质。TGF-β不仅能直接抑制效应T细胞的增殖与功能,还能促进初始T细胞向更多Treg分化。IL-10则主要抑制巨噬细胞、树突状细胞的促炎活性及细胞因子的产生。此外,Treg表面组成性高表达的CD25可竞争性结合微环境中的IL-2,造成效应T细胞生长因子的相对匮乏,即所谓的“IL-2剥夺”效应。同时,Treg表达的胞外酶CD39和CD73能将免疫细胞释放的ATP(一种危险信号)逐步水解为具有强力抗炎作用的腺苷,进一步强化抑制性微环境。
3. 上述机制的综合作用可诱导一种称为“传染性耐受”的长效状态。其核心在于,由初始Treg建立的局部抑制环境,能够促进周围的其他T细胞也获得调节特性,从而像接力一样将耐受状态扩展和维持下去。这种效应可能通过TGF-β等因子介导,使得短暂的Treg干预有可能产生持久的治疗效果,这对于实现自身免疫病缓解或移植耐受至关重要。
除了经典的免疫抑制,研究发现某些组织驻留的Treg还能分泌如两性调节因子等组织修复分子。这揭示了Treg在限制炎症损伤后,主动参与组织重建的另一面,也为其在心肌梗死、神经退行性疾病等非典型免疫性疾病中的应用提供了理论依据。这些复杂而精密的机制共同构成了Treg强大的免疫调控能力,也成为了设计靶向疗法时所依据的分子基础。

图3. 调节性T细胞介导的免疫抑制的三个阶段
不同疾病中的Treg
Treg功能的精确平衡是维持机体健康的关键,而其活性或数量的失调则构成多种重大疾病的免疫学基础。在不同病理状态下,Treg所扮演的角色呈现显著差异,甚至完全相反,这直接决定了截然不同的治疗策略方向(图4)。
在自身免疫性疾病与过敏性疾病中,Treg通常表现为功能相对不足或数量减少。例如,在1型糖尿病、多发性硬化症、系统性红斑狼疮及类风湿关节炎患者的外周血或病灶局部,常可观察到Treg频率降低、抑制功能减弱或表观遗传稳定性受损。这种“抑制缺陷”导致免疫系统对自身抗原或无害环境抗原(如花粉、食物蛋白)的耐受被打破,效应T细胞过度活化并攻击自身组织或引发过激的炎症反应。因此,在该领域治疗的核心逻辑是增强Treg功能,旨在补充或激活内源性调节网络,重建免疫耐受。
器官移植领域面临类似的挑战,但抗原来源明确。移植术后,受体的免疫系统会将供体器官识别为“非己”而发起攻击,即排斥反应。理想的解决方案是诱导针对供体抗原的特异性免疫耐受,从而避免长期使用非特异性免疫抑制剂带来的感染和毒副作用风险。研究表明,移植受者体内供体反应性Treg的数量与移植物长期存活呈正相关。因此,通过扩增或输注供体抗原特异性Treg来主动抑制排斥反应,是实现“移植耐受”极具前景的策略。
与上述情况形成鲜明对比的是肿瘤免疫微环境。在这里,Treg的功能被肿瘤巧妙地劫持,从保护者转变为协同促进免疫逃逸的“帮凶”。多种实体瘤和血液肿瘤能够通过分泌特定趋化因子(如CCL22、CCL28)主动招募Treg,并在富含TGF-β、腺苷等因子的微环境中促进其增殖、活化与功能强化。肿瘤浸润Treg通常高表达CTLA-4、PD-1等免疫检查点分子以及CD39/CD73等代谢调控酶,通过多种机制强烈抑制CD8+细胞毒性T细胞、NK细胞等效应免疫细胞的功能,从而形成一道“免疫抑制屏障”。在大多数癌症中,肿瘤内Treg的高浸润通常与患者的不良预后相关。故此,肿瘤免疫治疗的一个重要分支即是抑制或清除Treg,特别是肿瘤局部富集的Treg亚群,以解除免疫抑制,释放内源性或治疗性抗肿瘤免疫的活力。
近年研究揭示了Treg在更广泛生理病理过程中的作用。在代谢方面,脂肪组织驻留的Treg参与调控局部炎症和全身胰岛素敏感性,其功能紊乱与肥胖及相关2型糖尿病的发展有关。在心血管领域,Treg有助于抑制动脉粥样硬化斑块内的炎症反应,并在心肌梗死后的组织修复中发挥积极作用。在神经系统,研究发现阿尔茨海默病、帕金森病及肌萎缩侧索硬化等神经退行性疾病的进展伴随神经炎症,而脑内或全身性Treg可能通过抑制过度小胶质细胞活化等方式发挥神经保护作用。这些发现正在拓展以Treg为靶点的治疗策略的应用边界。
Treg在疾病中的作用并非固定不变,而是高度依赖具体的病理环境。对其角色进行准确评估——是“不足”需补充,还是“过度”需削弱——是发展精准免疫治疗的前提。这种基于免疫状态的功能性诊断,正推动着个体化医疗在自身免疫、移植和肿瘤等重大领域向前发展。

图4. 调节性T细胞在体内平衡及疾病中的作用
驾驭Treg:从基础到临床的治疗策略全景
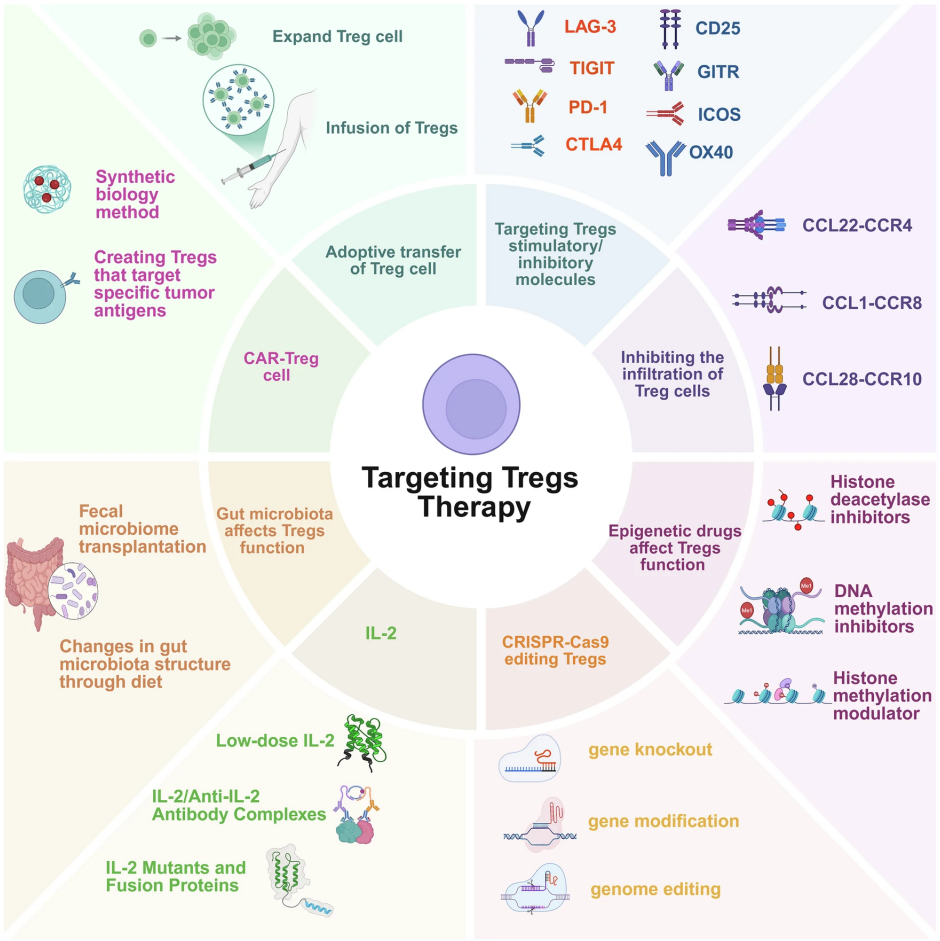
基于对调节性T细胞生物学及其在疾病中双重角色的深刻理解,针对性地调控其功能已成为免疫治疗领域的核心方向。目前主要的策略可分为三大类:在体内调控内源性Treg、进行过继性Treg细胞治疗,以及在肿瘤微环境中特异性抑制Treg功能(图5)。
1. 在体内选择性扩增或增强内源性Treg活性,是一种相对便捷的干预思路。经典方法包括应用低剂量白细胞介素-2。由于Treg高表达高亲和力IL-2受体,低剂量IL-2可优先促进其增殖。然而,天然IL-2半衰期短且能同时活化效应细胞。因此,工程化改造的IL-2变体被开发出来,旨在延长半衰期并提高对Treg的选择性。此外,纳米医学技术为此提供了更精准的工具。可将抗原、细胞因子(如IL-2、TGF-β)或免疫调节剂(如雷帕霉素)封装于靶向性纳米颗粒中,将其递送至特定组织或细胞,从而在局部诱导抗原特异性Treg的生成或扩增,避免全身性免疫影响。
2. 过继性Treg细胞疗法,即将体外扩增或改造的Treg回输给患者,提供了更直接和强效的调控手段。早期临床试验主要使用从患者外周血分离并多克隆扩增的自体Treg,已在1型糖尿病、移植物抗宿主病和实体器官移植中证明了安全性和初步疗效。为了提升治疗的靶向性与效力,基因工程改造是当前的发展焦点。通过给Treg装备嵌合抗原受体或特异性T细胞受体,可将其重定向至特定的疾病相关抗原。例如,表达HLA-A2特异性CAR的Treg能在移植模型中向移植物归巢并延长其存活;而针对自身抗原的CAR-Treg则在自身免疫病模型中展现出治疗潜力。通过基因编辑技术进一步改造Treg,例如增强其稳定性、抵抗抑制性药物或引入正交细胞因子受体系统,有望诞生功能更优的“下一代”治疗产品。
3. 在肿瘤免疫治疗中,策略则转向抑制或清除Treg。一种方法是使用靶向Treg表面标志物的抗体,如抗CCR4抗体可阻断其向肿瘤的招募,而某些抗CTLA-4抗体则可通过抗体依赖的细胞介导的细胞毒性作用清除肿瘤内的Treg。另一种思路是干扰其免疫抑制功能,例如使用CD39/CD73的小分子抑制剂来阻断腺苷的生成,或使用抗TIGIT等抗体来干扰其抑制性信号。将这些方法与抗PD-1/L1等免疫检查点抑制剂联合使用,是克服肿瘤免疫抑制微环境、提升疗效的重要临床探索方向。这些策略共同构成了一个多层次、精准化的Treg靶向治疗工具箱,正推动着相关疾病治疗模式的革新。

图5. 调节性T细胞在疾病中表现出多种靶向策略
挑战与未来展望
尽管靶向调节性T细胞的治疗策略展现出巨大潜力,但将其成功转化为广泛应用仍面临多重挑战。首要问题在于特异性。无论是通过药物在体内扩增Treg,还是通过抗体在肿瘤中清除Treg,现有方法仍难以精准区分“疾病相关”Treg与执行正常生理功能的Treg。这种特异性不足可能导致疗效不佳或引发自身免疫、感染等风险。其次,Treg细胞的稳定性与持久性是过继细胞疗法的核心关切。回输的Treg,特别是经过基因工程改造的细胞,在患者体内复杂且常伴有炎症的微环境中,能否长期维持其表观遗传程序、转录因子表达和抑制功能,而不发生功能衰竭或向效应细胞转化,仍需更长期的临床数据来验证。从技术转化角度看,制造的复杂性与成本是瓶颈之一。获取高纯度、功能稳定的Treg,尤其是制备抗原特异性或基因修饰的Treg产品,涉及复杂的分离、扩增、工程化和质控流程,导致生产成本高昂,限制了其可及性。此外,缺乏用于实时监测Treg数量、亚群及抗原特异性变化的敏感且标准化的生物标志物,也阻碍了对治疗反应的精准评估与方案优化。
展望未来,该领域的发展将集中于提升治疗的精准度与可控性。下一代技术致力于开发微环境响应型的智能疗法,例如仅在疾病部位被激活的工程化细胞或药物。联合治疗策略,例如将Treg调控手段与免疫检查点抑制剂、代谢干预或放疗相结合,有望产生协同效应,克服单一疗法的局限。同时,对组织驻留Treg异质性、代谢特征及表观遗传调控的基础研究将持续深入,为发现全新靶点和设计更优疗法提供理论基石。通过跨学科合作解决这些挑战,Treg靶向治疗有望在未来十年内为更多患者带来变革性的精准医疗选择。
参考文献:
1. Regulatory T cells in homeostasis and disease: molecular mechanisms and therapeutic potential. Signal Transduct Target Ther. 2025,10(1):345. doi:10.1038/s41392-025-02326-4
2. Harnessing the biology of regulatory T cells to treat disease. Nat Rev Drug Discov. 2025,24(2):93-111. doi:10.1038/s41573-024-01089-x
- “肠道-脂肪轴”——决定你的运动控糖效益
- 没有了!
 技术咨询:
技术咨询: