联合分析专题(十)单细胞测序和肿瘤微环境
2023-12-13
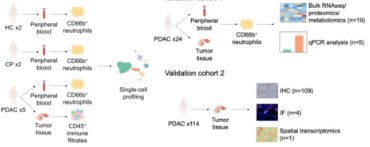
单细胞测序和肿瘤微环境
单细胞转录组测序( Single -cell RNA -sequencing)是指在单细胞水平上对 RNA进行高通量测序和分析的新技术。同种细胞会由于所处的生理状态出现差异表达,常规的 bulk RNA(bulk就是我们测的是所有细胞的总RNA(mRNA)取平均值代表每个基因的表达量。)并不能捕获这种差异表达,而这种差异又代表着表型背后的原理,为了捕获这种差异,单细胞测序技术应运而生。不同于常规组织或细胞群测序得到的结果(只是大量细胞平均表达水平),单测序能够深入挖掘特异性的信息。目前,单细胞测序已广泛应用于肿瘤异质性、免疫微环境、神经科异质性、免疫微环境神经科 、胚胎发育细胞分化等领域的研究。
肿瘤微环境是指肿瘤的发生、生长及转移与肿瘤细胞所处的内外环境有着密切关系,它不仅包括肿瘤所在组织的结构、功能和代谢,而且亦与肿瘤细胞自身的(核和胞质)内在环境有关。肿瘤细胞可以通过自分泌和旁分泌,改变和维持自身生存和发展的条件,促进肿瘤的生长和发展。全身和局部组织亦可通过代谢、分泌、免疫、结构和功能的改变,限制和影响肿瘤的发生和发展。
推荐文章:Single-cell RNA-seq analysis reveals BHLHE40-driven pro-tumour neutrophils with hyperactivated glycolysis in pancreatic tumour microenvironment. Journal: Gut, Year:2023.
内容:作者使用单细胞组学、免疫荧光/免疫组化染色、多组学分析和体外实验等手段,在 PDAC 肿瘤微环境中发现了中性粒细胞的促肿瘤亚群,揭示了 TANs 中高糖酵解活性与促肿瘤功能之间的关联,并证明了缺氧诱导和内质网应激诱导的 BHLHE40 激活是驱动 TANs 向促肿瘤表型发展的潜在机制。
联合分析思路(技术路线):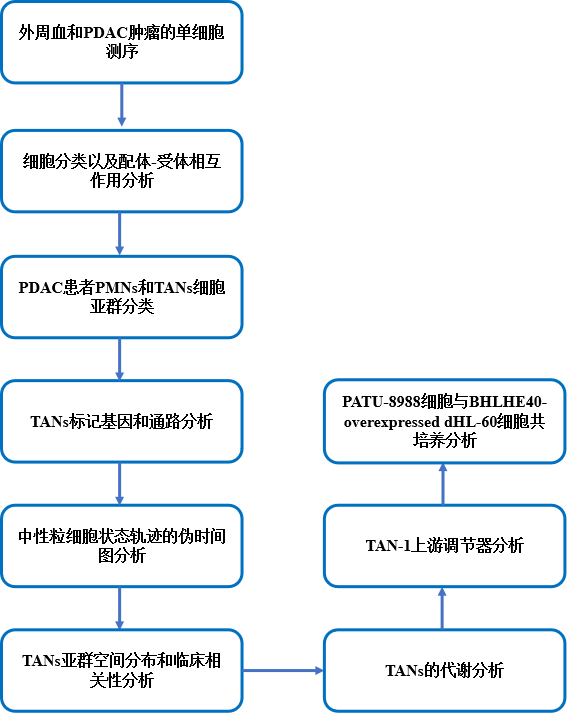
结果展示:外周血和 PDAC 肿瘤的单细胞图谱,以及 PDAC 微环境中中性粒细胞和其他细胞之间的细胞间通讯。
通过主成分分析和基于图的聚类分析,来自外周血的 33891个细胞和 PDAC 的 17932 个细胞被分为 9 个细胞簇,根据已知的细胞类型标记基因,它们被标记为中性粒细胞( 2个簇)、巨噬细胞、肥大细胞、B 细胞、浆细胞、T细胞、导管细胞和成纤维细胞(图 1B)。与其他类型的免疫细胞相比,巨噬细胞表达的中性粒细胞配体对应的受体数量明显更多,相反,巨噬细胞表达的中性粒细胞表达的受体对应的配体数量也明显更多(图 1C 和 D ),这表明在肿瘤微环境中,中性粒细胞和巨噬细胞之间存在密切的相互作用。进一步研究发现,肿瘤相关巨噬细胞通过 CCL13-CCR1、CCL3-CCR1、CCL3L3-CCR1、CXCL2-CXCR1、CXCL2-CXCR2 和 CXCL8-CXCR2 轴吸引中性粒细胞,而巨噬细胞通过 CCL3L3-CCR1 轴被中性粒细胞招募(图1C)。此外,IF染色证实了 PDAC 组织中中性粒细胞和巨噬细胞之间的物理亲近性(图1E)。此外,巨噬细胞用促炎细胞因子白细胞介素 1 (IL-1) 和肿瘤坏死因子 (TNF) 刺激中性粒细胞(图1C),与 PMNs 相比,在 TANs 中观察到 TNFα/ 核因子 κB (NF-κB) 和 IL-1 信号通路的显著激活(图1F)。
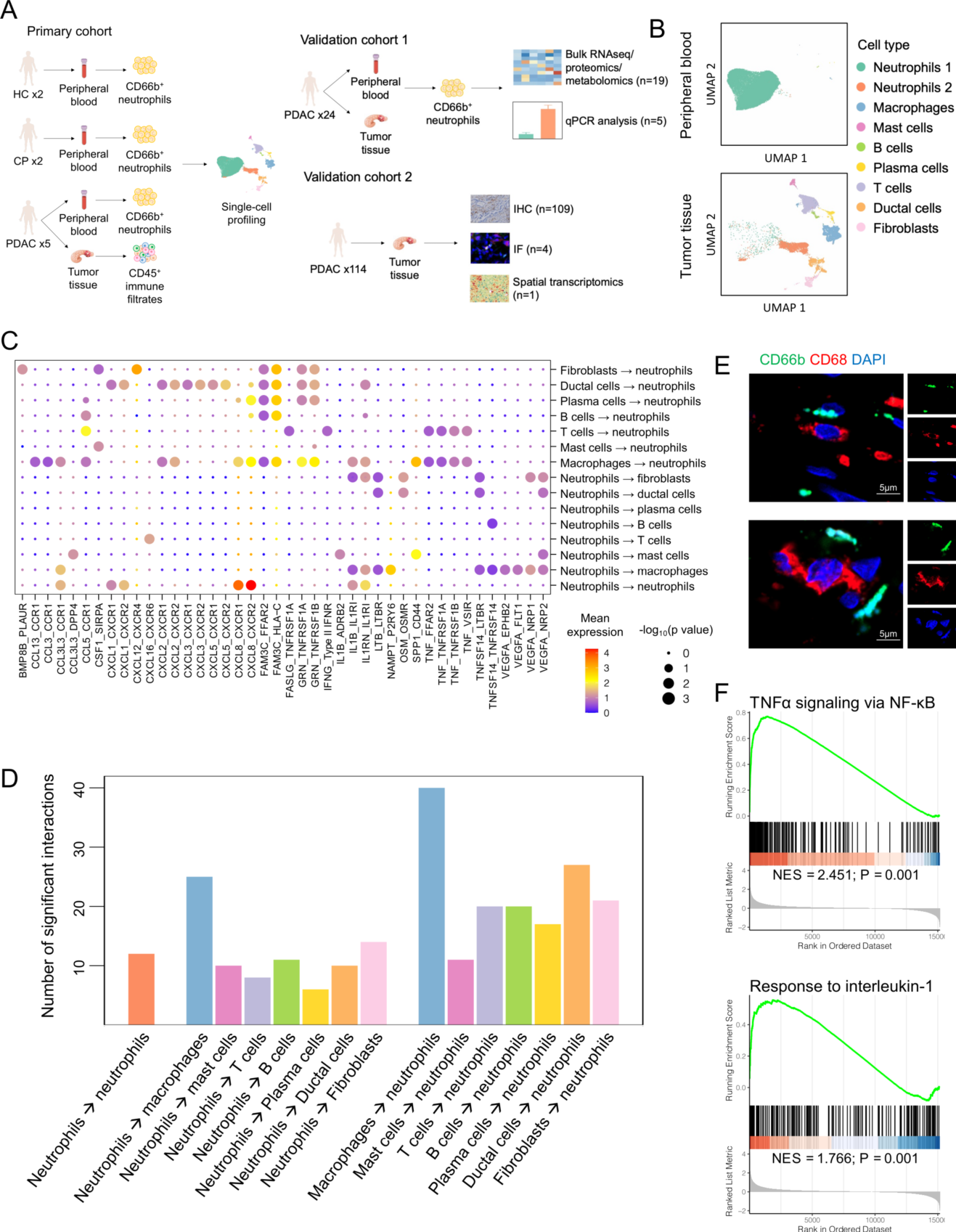
(A) 实验流程图,包括初级队列的单细胞测序研究,验证队列1的多组学分析和定量 PCR 分析,验证队列2的 IHC、IF 和 ST 研究。每个亚组的患者/健康供体人数如图所示。
(B) UMAP 图描绘了单细胞测序鉴定的主要细胞类型,包括来自健康对照者、慢性胰腺炎患者和 PDAC 患者外周血的 CD66b+ PMNs,以及来自 PDAC 肿瘤组织的 CD45+ 免疫滤液。
(C)点状图描绘了 PDAC 肿瘤微环境中中性粒细胞与其他细胞之间选择的配体-受体相互作用。通过 CellPhoneDB (http:// www.cellphonedb.org/) 计算平均表达式和 p 值,分别用圆圈颜色和大小表示。
(D)条形图描绘了 PDAC 肿瘤微环境中中性粒细胞与其他细胞之间显著的配体-受体相互作用的数量。细胞类型标记为(表达配体的细胞类型)→(表达相应受体的细胞类型)。
(E) PDAC 组织中 CD66b 和 CD68 的IF染色。
(F)基因集富集分析 (GSEA) 图显示 TANs 中 TNFα 和 IL-1 通路的富集分数。基于 PDAC 患者 PMNs 和 TANs 的单细胞 RNA 测序 (RNA-seq) 数据进行通路富集分析。CP:慢性胰腺炎;HC:健康对照;PDAC:胰腺导管腺癌;PMNs:外周血多形核白细胞;ST:空间转录组学;TANs:肿瘤相关的中性粒细胞。
结果展示2:来自 PDAC 肿瘤的 TANs 是由一个多样化的群体组成,且中心粒细胞最终会分化成为促肿瘤 TAN-1
此研究鉴定出 6个 PMN 亚群和 6个 TAN 亚群(图 2A和B),每个中性粒细胞亚群都存在于所有 PDAC 患者样本中。相关分析显示,所有的 PMN 亚群具有相似的表达谱,而 TAN 亚群彼此之间的差异很大(图 2C ),这表明肿瘤浸润中性粒细胞是一个异质群体,这可能归因于肿瘤微环境中不同的刺激造成不同表型。不同的 TAN 之间的标记基因显示, TAN-1 可以被认为是“促肿瘤亚群”, TAN-2 由炎症亚群组成, TAN-3 是一种过渡性中性粒细胞,TAN-4 有一个独特的转录特征,表达干扰素 (IFN) 刺激基因(图2D)。中性粒细胞亚群的通路活性分析显示, TAN-1 和TAN-2 表达高水平的趋化因子、细胞因子和血管生成因子,TAN-3 高表达与吞噬、呼吸爆发和中性粒细胞颗粒相关的基因,TAN-4 则与先天免疫反应相关(图2E)。进一步研究发现,中性粒细胞以 PMNs 为起点,通过 TAN-3 作为 PMNs 和 TANs 之间的过渡状态,然后进入以 TAN-0 和 TAN-4 为特征的中间肿瘤浸润状态,最后达到 TAN-2 和 TAN-1 的终末分化状态(图2F)。接下来分析单细胞转录组,鉴定出 1757 个表达变化显著的基因,这些基因可以聚类为三种表达模式:第一组包括沿轨迹表达水平下降的基因;途径富集分析显示,这些基因与 IFN 信号通路和先天免疫功能相关。二组基因在肿瘤浸润早期表达上调,参与吞噬和抗原提呈。三组基因在肿瘤微环境晚期被激活,在缺氧、内质网应激、IL-1 和 TNF 信号通路以及糖酵解等方面富集(图2G)。进一步研究发现内质网应激和缺氧是 TAN-1 极化的有效刺激物(图2H)。
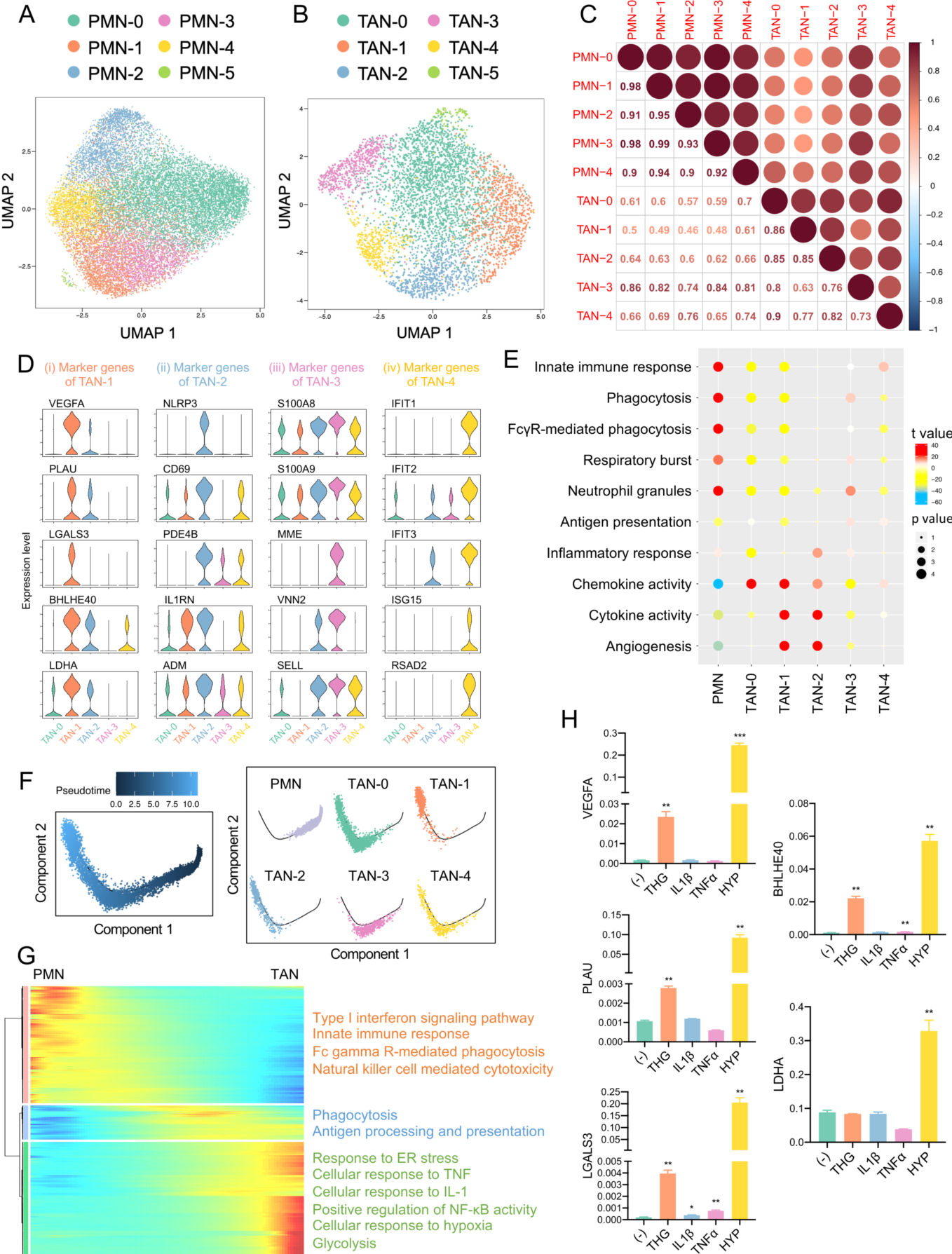
(A) UMAP 图显示 PDAC 患者 PMNs 的亚群。
(B) UMAP 图显示 PDAC 患者的 TANs 亚群。所有来自 PDAC 肿瘤组织的注释为中性粒细胞的细胞作为 TANs 进行分析,包括图 1B 中的中性粒细胞簇1和2。
(C)各亚群中性粒细胞表达谱之间的 Pearson 相关系数。计算每个子簇中前2000 个高可变基因的平均归一化表达量,并进行 Pearson 相关分析。
(D)显示 (i) TAN-1亚群、(ii) TAN-2亚群、(iii) TAN-3亚群和 (iv) TAN-4亚群标记基因的小提琴图。
(E)不同中性粒细胞亚群之间途径活性的比较。这些通路与中性粒细胞功能有关。通过基因集变异分析对每个细胞的通路活性进行评分。T 值和 p 值是基于线性模型计算的,该模型分析了来自一个簇的中性粒细胞与来自所有其他簇的中性粒细胞之间的差异,并分别用圆圈的颜色和大小表示。
(F)二维空间中中性粒细胞沿伪时间的运动轨迹。每个点对应一个单元格。
(G)基因表达随假时间的动态变化的热图。将差异表达基因按层次聚类为3组,并给出了每组中具有代表性的富集途径。
(H)使用 qPCR 分析经过 THG、IL-1β、TNFα 和缺氧作用 24h 后中性粒细胞样 dHL-60 细胞 TAN-1 标记基因的表达。*P<0.05;* *P<0.01;* * *P<0.001。HL-60: 分化HL-60;ER: 内质网;HYP: 缺氧。
结果展示3:TAN-1 与 PDAC 患者预后不良相关
IF 染色证实了每个 TAN 亚簇都表达了中心粒细胞标记基因 (VEGFA, NLRP3, MME 和IFIT2)(图3A)。TAN 亚簇的 CD66b 和标记基因的免疫组化结果显示,PDAC 组织中 VEGFA+ TANs、NLRP3+ TANs、MME+ TANs 和 IFIT2+ TANs 在总细胞中的中位数百分比分别为 2.6%、1.4%、4.7% 和 0.9% 。大多数 VEGFA+ TANs 接近恶性细胞,在空间上使它们具有促肿瘤功能,而 IFIT2+ TANs 经常存在于纤维化间质组织中(图3B)。临床数据显示,VEGFA+ TANs与癌症晚期和不良预后显著相关(图3C)。进一步的验证也表明在这两个组中具有标准 PDAC 组织学的 treatment-naïve 患者中,TAN-1 标记是一个不利的预后因素(图3D和E)。
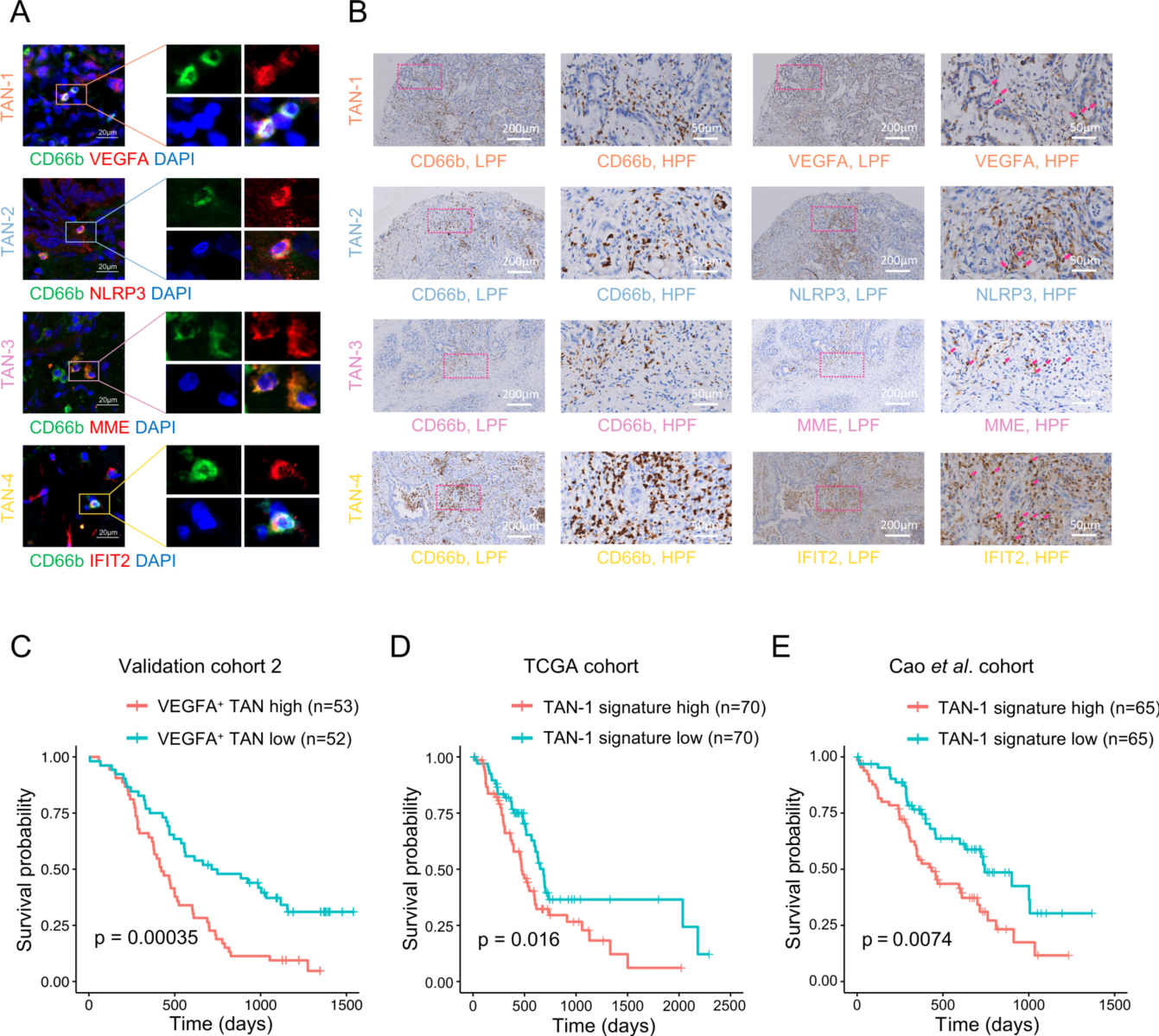
(A) PDAC 组织上中性粒细胞标记基因 (CD66b) 和 TAN 亚簇 (TAN-1 的VEGFA, TAN-2 的 NLRP3, TAN-3 的 MME 和 TAN-4 的 IFIT2) 的 IF 染色。
(B) PDAC 组织中中性粒细胞标记基因 (CD66b) 和 TAN 亚簇 (TAN-1 的VEGFA,TAN-2 的 NLRP3,TAN-3 的 MME和TAN-4的IFIT2) 的免疫组化图像。通过 CD66b 染色和多核形态鉴定中性粒细胞。粉色箭头表示表达 TAN 亚簇标记的中性粒细胞。
(C) Kaplan-Meier 生存曲线展示 IHC 分析中 PDAC 患者的总生存期。根据PDAC 组织中 VEGFA+ TANs 占总细胞的百分比将患者平均分为两组。
(D) Kaplan-Meier 生存曲线,表示 TCGA-PAAD 队列中具有标准 PDAC 组织学的 treatment-naïve 患者的总生存率。根据 TAN-1 标记基因的表达情况将患者平均分为两组,采用 GSVA 法评估每个样本中 TAN-1 标记基因表达情况。(E) Kaplan-Meier 生存曲线,treatment-naïve 标准 PDAC 患者的总生存率。根据 TAN-1 标记基因的表达情况将患者平均分为两组,采用 GSVA 法评估每个样本中 TAN-1 标记基因表达情况。
结果展示4:代谢分析显示,糖酵解开关主要在 TAN-1中上调
通过分析了每个 TAN 亚簇的标志性代谢特征,作者发现 TAN-1 的糖酵解和缺氧活性明显高于其他中性粒细胞亚簇(图4A),并且中性粒细胞转移轨迹上调(图4B)。葡萄糖转运蛋白 GLUT1 和糖酵解酶 HK2、PFKFB3 和 LDHA 在 PDAC 组织中表达 TAN-1 标记物 LGALS3 的中性粒细胞中的表达上调(图4C)。与间质区嗜中性粒细胞富集点相比,肿瘤区内或邻近区嗜中性粒细胞富集点的糖酵解活性显著上调(图4D和E),提示 PDAC 肿瘤微环境中恶性细胞诱导中性粒细胞糖酵解开关。转录组学、蛋白质组学和代谢组学结果也显示糖酵解通路在 TANs 中显著上调(图4F、G、H和I)。
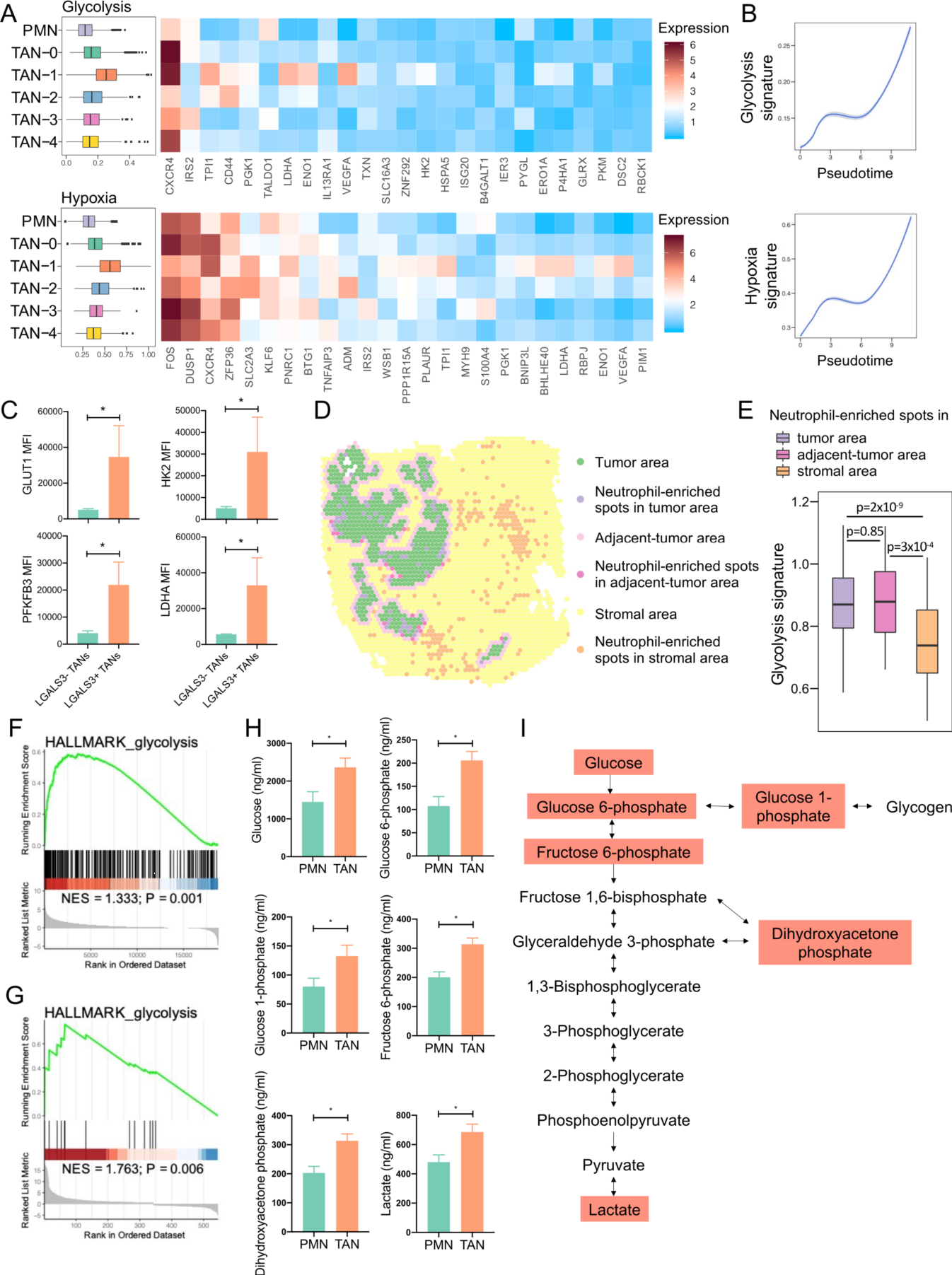
(A) 每个中性粒细胞亚群中标志性糖酵解和缺氧特征表达的箱形图(左图),以及特征中平均标准化基因表达的热图(右图)。
(B)二维图显示糖酵解特征和缺氧特征沿伪时间轨迹的动态表达。
(C)流式细胞术分析 PDAC 组织 LGALS3+ 和 LGALS3−TANs 中 GLUT1、HK2、PFKFB3 和 LDHA 的表达。在4例 PDAC 患者的肿瘤组织中测量LGALS3+ 和 LGALS3−TANs 中 GLUT1、HK2、PFKFB3 和 LDHA表达的MFI,并用 SD 表示平均值。
(D)肿瘤、肿瘤邻近区及间质区中性粒细胞富集斑的空间特征图。根据单细胞测序鉴定的中性粒细胞标记基因,通过单样本基因集富集分析计算各空间点的中性粒细胞特征,将中性粒细胞特征前 10% (ssGSEA 评分> 0.53)的点定义为中性粒细胞富集点。
(E)箱形图显示肿瘤、邻近肿瘤和间质区嗜中性粒细胞富集点的糖酵解特征。
(F-G) GSEA 图显示了 TANs 中 HALLMARK 糖酵解途径的 NES。基于 PDAC 患者配对的 CD66b+ PMNs 和 TANs 的转录组学 (F )和蛋白质组学 (G) 数据进行途径富集分析。
(H) PMN 和 TAN 裂解物中糖酵解中间体的代谢组学分析。数据用 SD 表示平均值。(1)糖酵解途径示意图。红色框表示与 PDAC 患者的 PMNs 相比, TANs 的代谢物显著增加 (P<0.05)。
结果展示5:上游调控因子分析显示BHLHE40驱动中性粒细胞向促肿瘤表型发展
作为 TAN-1 的标记基因之一, BHLHE40 是 TAN-1 中表达上调最显著的转录因子之一(图5A)。根据SCENIC构成的基因调控网络, BHLHE40 是转录因子 HIF1A 和 XBP1 的下游靶基因, BHLHE40 调节 TAN-1 标记物 VEGFA、PLAU、LGALS3、LDHA 和 BHLHE40 (自动调节)以及 TAN-2 标记物 PDE4B 和 IL1RN 的表达,提示在缺氧和内质网应激诱导下,BHLHE40 可促进肿瘤微环境中中性粒细胞向促瘤表型分化(图 5B)。qPCR 证实 BHLHE40 过表达导致 VEGFA、PLAU、LGALS3、LDHA 和 PDE4B 的表达显著上调,证明 BHLHE40 在中性粒细胞中直接转录调控促肿瘤基因(图5C)。在敲低 BHLHE40 的 dHL-60 细胞中,TAN-1 标记物的诱导显著降低(图5E),表明 BHLHE40 在中性粒细胞向 TAN-1 表型极化中起关键作用。作者观察到与 BHLHE40 过表达的 dHL-60 共培养的 PDAC 细胞增殖和迁移能力显著增强(图6A和B),表明上游调节因子 BHLHE40 驱动中性粒细胞向促肿瘤亚型转变。免疫学试验显示 BHLHE40 过表达的 dHL-60 细胞对 CD8+ T细胞的促炎细胞因子产生及淋巴细胞增殖能力有抑制作用,表明 BHLHE40 可能是髓源性抑制细胞的潜在调节因子(图6C和D)。免疫组化分析揭示了 BHLHE40+ 中性粒细胞和表达 TAN-1 标记基因 VEGFA 的中性粒细胞在 PDAC 微环境中的共定位(图6E)。BHLHE40+ 中性粒细胞浸润水平越高,预后越差(图6F),进一步证明了上游调节因子 BHLHE40 在 TANs 中的促瘤作用。
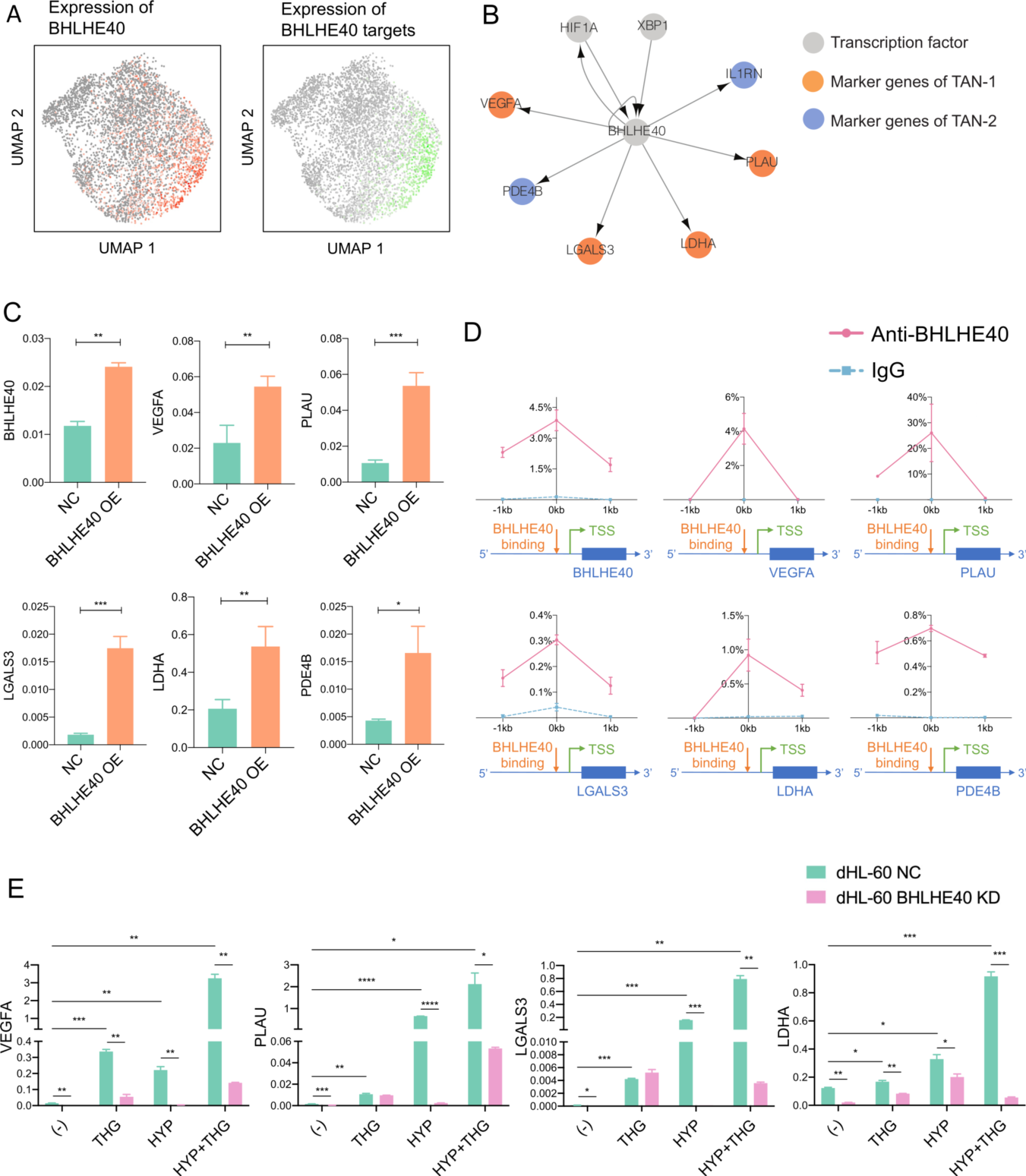
(A) UMAP 图显示了 TANs 中 BHLHE40 的表达(左图),以及 TANs 中 BHLHE40 调节活性 AUC 评分(右图)。
(B)单细胞调控网络推理与聚类揭示的 BHLHE40 的代表性调控网络。
(C) qPCR 分析 BHLHE40 靶细胞在对照细胞和 BHLHE40 过表达的 dHL-60 细胞中的表达情况。数据用 SD 表示平均值。
(D)通过染色质免疫沉淀 -qPCR 分析 BHLHE40 在 dHL-60 细胞中靶基因启动子区域的结合。
(E) qPCR 分析用 THG 和/ 或 HYP 刺激 24小时后对照组和敲低 BHLHE40 的 dHL-60 细胞中 BHLHE40 靶基因的表达情况。数据用 SD表示平均值。*P<0.05;* *P<0.01;* * *P<0.001;* * * *P<0.0001。
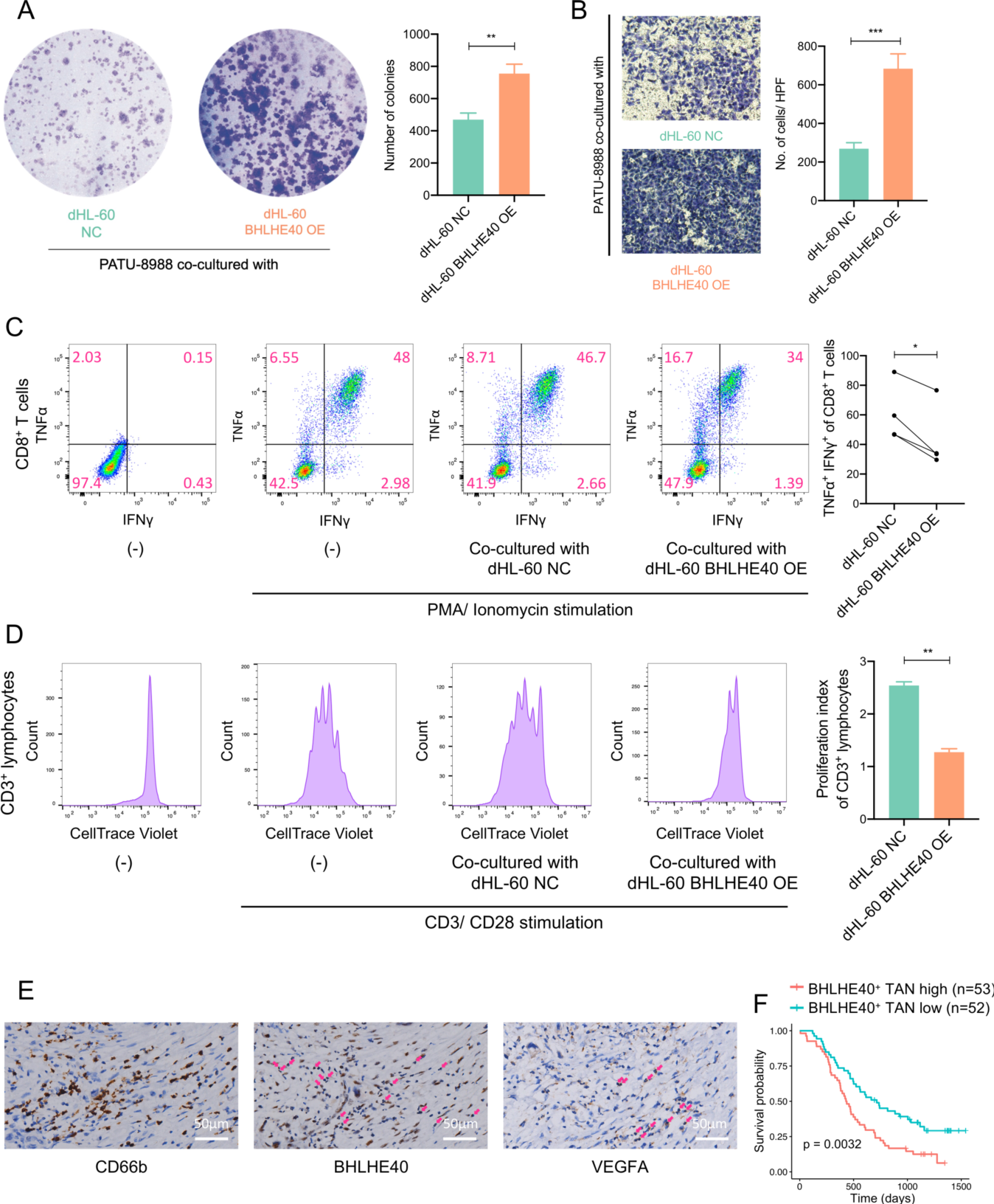
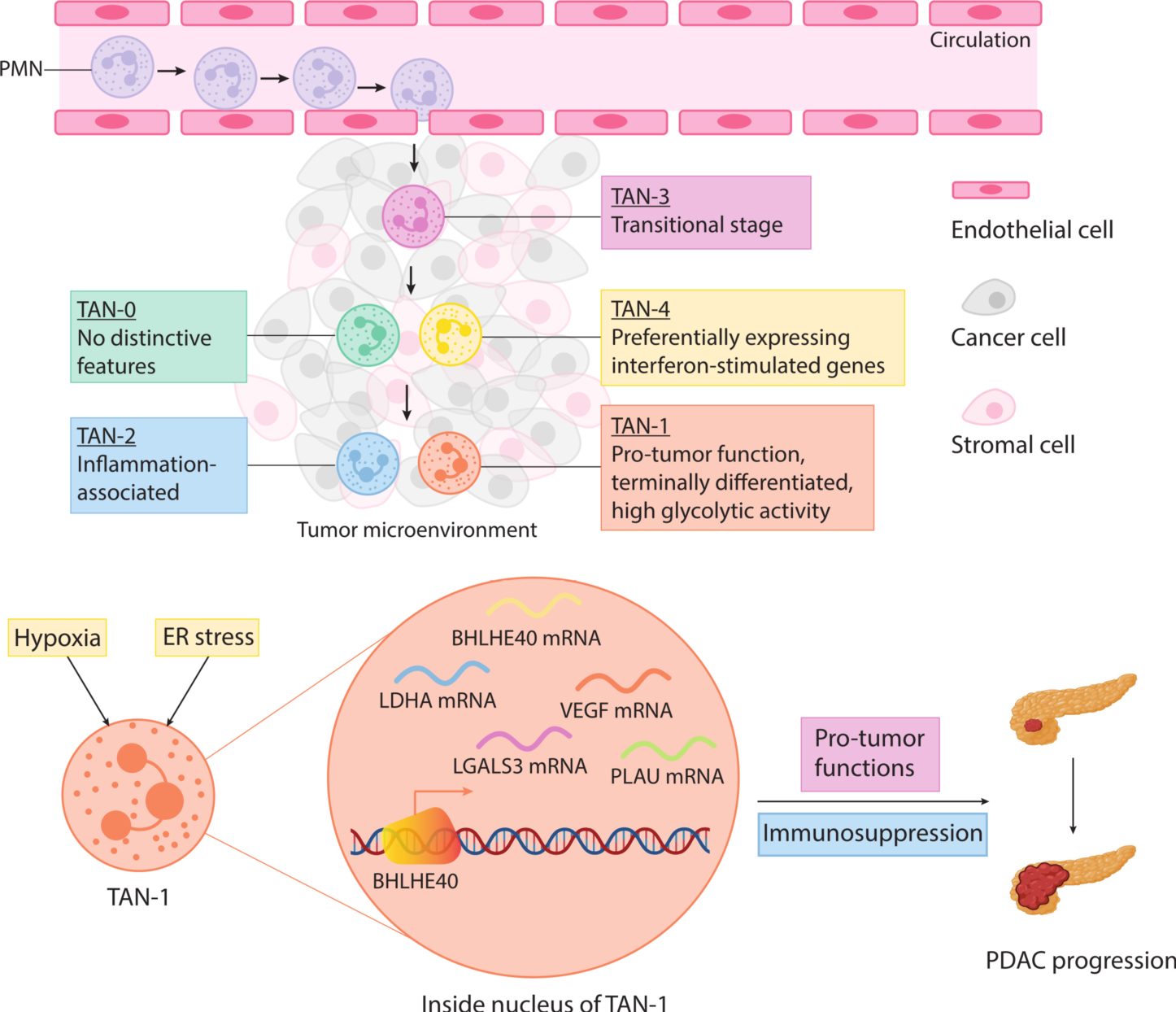
ER:内质网;PDAC ,胰腺导管腺癌;PMN,中心粒细胞;TAN,肿瘤相关中性粒细胞。
 技术咨询:
技术咨询: