巨噬细胞来源的组织蛋白酶S重塑细胞外基质促进肝纤维化
2024-03-08
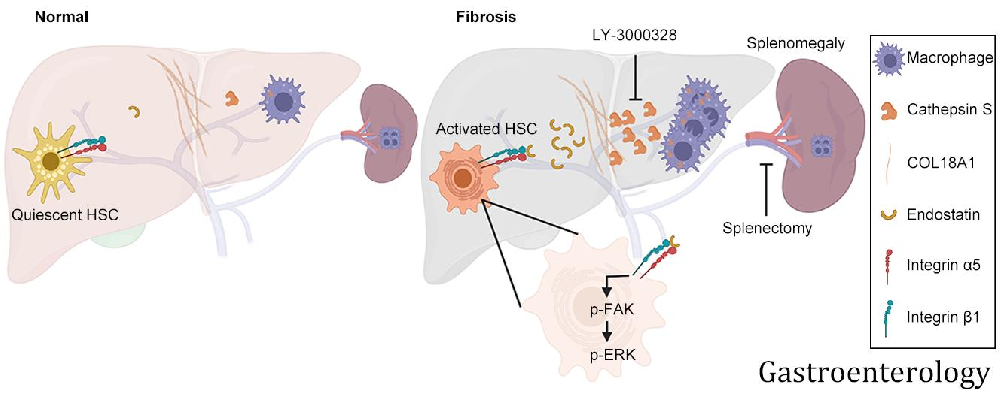
前言:肝纤维化是对慢性损伤的内在伤口愈合反应,也是世界范围内肝脏相关发病率和死亡率的主要原因。但其分子病因不明确,且缺乏有效的诊断或治疗策略。本研究对临床纤维化肝样本进行定量蛋白质组学分析,以确定失调蛋白。进一步分析了164例肝纤维化患者的血清。采用两种纤维化小鼠模型和多项生化实验来阐明肝纤维化的发生。通过蛋白质组学筛选,发现组织蛋白酶S上调是人纤维化肝细胞外基质重塑的中心节点。血清组织蛋白酶S水平升高可有效预测肝纤维化,即使在早期也是如此。分泌的组织蛋白酶S在其c端切割胶原18A1,释放内皮抑素肽,该肽通过整合素α5β1信号直接结合并激活肝星状细胞,而CTSS基因消融在体内通过内皮抑素减少显著抑制肝纤维化。进一步研究发现巨噬细胞是肝组织蛋白酶S的主要来源,脾切除术可有效降低纤维化肝中巨噬细胞的浸润和组织蛋白酶S的表达。在小鼠模型中,组织蛋白酶S的药理抑制改善了肝纤维化的进展。组织蛋白酶S作为一种新的促纤维化因子通过重塑细胞外基质蛋白发挥作用,可能是肝脏诊断和治疗的一个有希望的靶点。
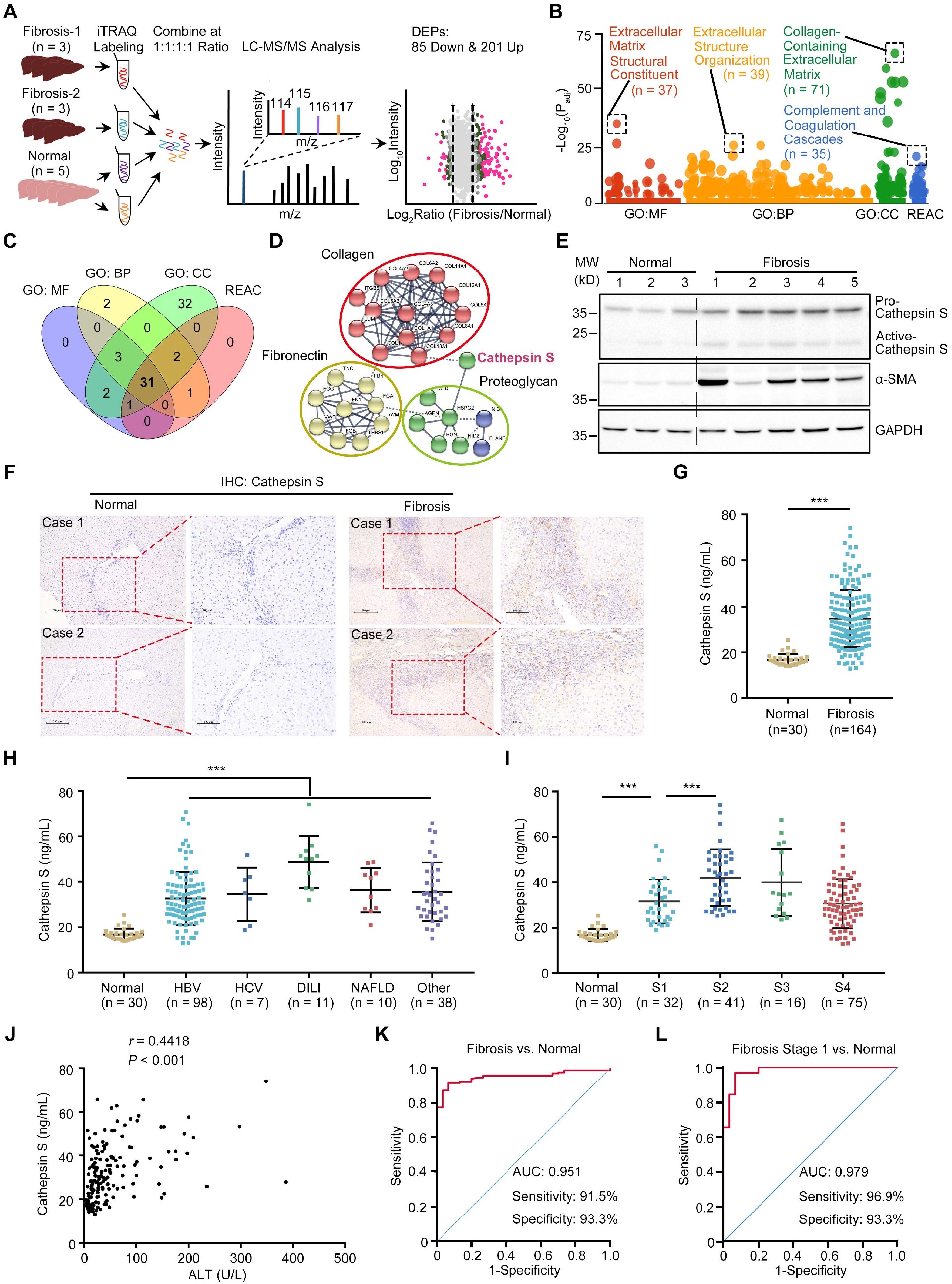
图1 通过蛋白质组学筛选鉴定组织蛋白酶S作为肝纤维化生物标志物
为了研究肝纤维化的可能机制和治疗靶点,在正常和纤维化的人肝组织中采用iTRAQ定量蛋白质组学策略来鉴定差异表达蛋白(DEPs)(图1A)。总共定量了2364个蛋白。技术重复和生物重复的相关性接近1。这表明在重复中变化很小,质谱仪系统稳定。以R<0.05和比值(纤维化/正常)> 1.5为阈值,在纤维化肝组织中分别鉴定出201个上调蛋白和85个下调蛋白(图1A)。
使用g: Profiler 20对DEPs进行统计富集分析。一系列的聚类分析结果,包括细胞成分、分子功能、生物过程和反应组,都表明ECM相关信号在上调的DEP中排名第一(图1B)。此外,由于ECM失调有助于纤维化进展,通过结合前1簇的富集蛋白筛选核心ECM调节蛋白,得到31个候选蛋白(图1C)。STRING分析进一步揭示,这些蛋白主要属于纤维连接蛋白、胶原蛋白和蛋白多糖基团,而组织蛋白酶S是连接这些亚群的关键节点(图1D)。
为了探讨组织蛋白酶S在肝纤维化中的作用,检测了组织蛋白酶S在正常和纤维化肝组织中的表达。WB分析显示,正常肝组织中组织蛋白酶S水平较低,而纤维化肝组织中组织蛋白酶S水平频繁上调(图1E)。免疫组化(IHC)分析显示组织蛋白酶S染色增加,在门静脉和纤维化间隔区明显可见(图1F),肝纤维化患者血清组织蛋白酶S水平明显升高(图1G)。根据肝纤维化的病因和病理分期将所有患者分别分为不同的亚组。观察到,血清组织蛋白酶S上调是肝纤维化的一个普遍特征,与疾病原因无关,并且在肝纤维化进展过程中作为早期事件表达(图1H和图I)。
肝纤维化的早期诊断在临床实践中仍然是一个挑战。因此,探讨血清组织蛋白酶S水平是否有助于肝纤维化患者的分类。Spearman相关分析显示,血清组织蛋白酶S与肝损伤标志物ALT的血清活性以及血清GP73和COL IV水平呈显著正相关(图1J),这是慢性肝纤维化的潜在生物标志物。ROC分析显示,血清组织蛋白酶S对所有纤维化病例和纤维化1期的诊断准确性高于ALT、GP73和COL IV(图1K-L)。因此,这些结果表明,血清组织蛋白酶S是肝纤维化包括早期纤维化的潜在无创诊断标志物。
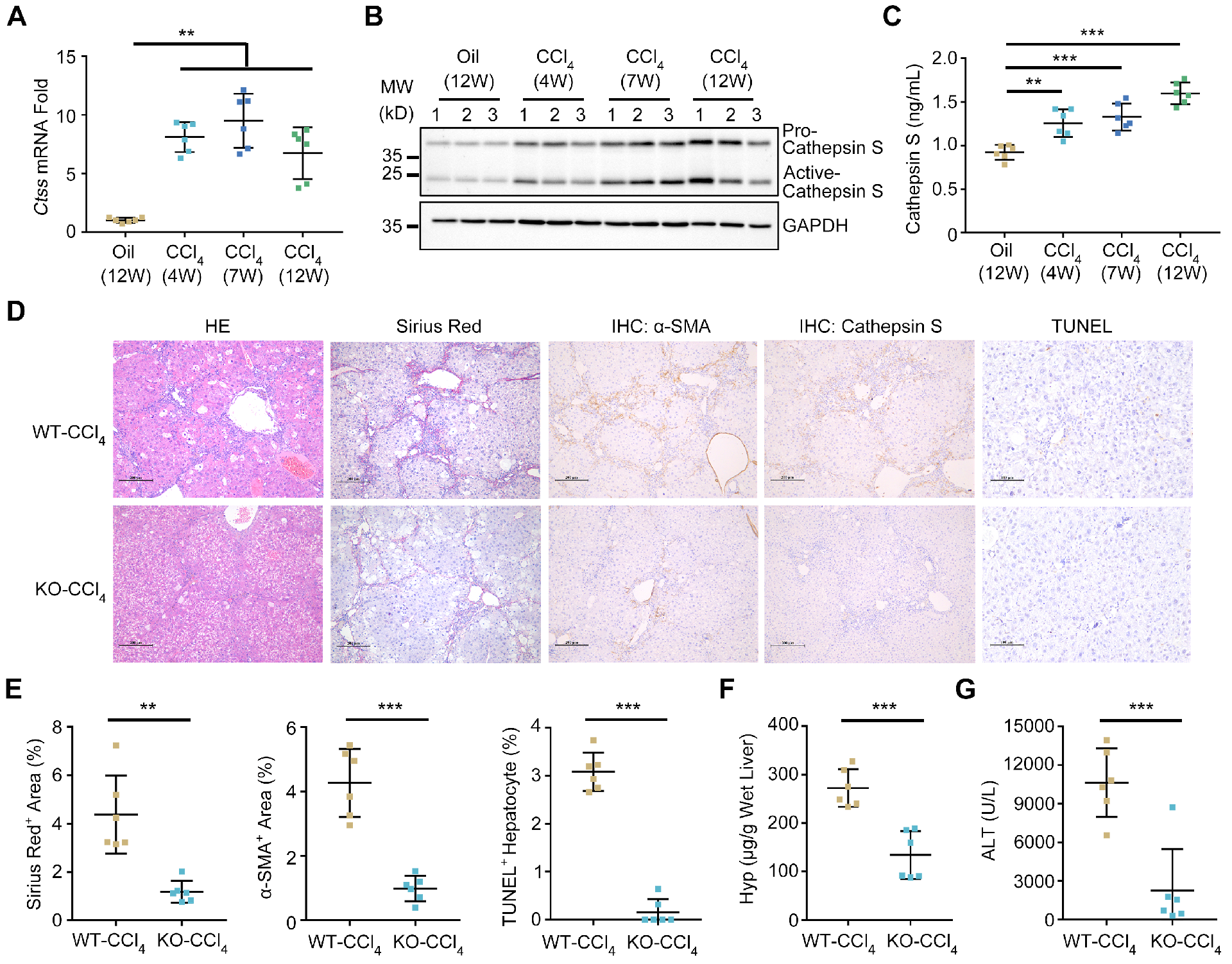
图2 CTSS基因缺失可防止小鼠肝纤维化
使用CCL4诱导的肝纤维化小鼠模型来确定组织蛋白酶S是否在肝纤维化中起关键作用。在CCL4治疗4、7、12周后采集肝脏组织。在所有时间点,组织蛋白酶S的mRNA和蛋白表达水平均升高(图2A和B)。组织蛋白酶S上调主要见于肝脏纤维化区,尤其是门静脉区。此外,随着肝纤维化的进展,血清组织蛋白酶S水平逐渐升高(图2C)。为了了解组织蛋白酶S表达的增加是否是肝纤维化的早期事件,在CCL4治疗后第3、7和14天测量了肝脏和血清中组织蛋白酶S的表达。观察到组织蛋白酶S水平在肝损伤开始时显著升高。
接下来,利用CTSS-KO小鼠在体内阐明组织蛋白酶S在肝纤维化中的作用。在CTSS-KO小鼠的不同器官和血清中证实了组织蛋白酶S表达的消融,并与WT进行了比较。在CTSS-KO小鼠的表型、体重或器官指数方面没有发现差异。经过12周的CCL4治疗后,CTSS-KO雄性小鼠的纤维化间隔形成明显减弱,苏木精-依红(HE)染色(图2D)。CTSS-KO小鼠肝组织中肌成纤维细胞标志物、α-SMA、天狼星红染色区和羟脯氨酸(Hyp)含量的表达也显著降低(图2D-F)。此外,在CCL4刺激的CTSS-KO小鼠中检测到较低水平的TUNEL+肝细胞和血清ALT(图2E和G)。同样,在雌性小鼠中也观察到CTSS消耗对肝纤维化的保护作用。
通过另一种机制不同的DDC诱导的纤维化模型,进一步研究了CTSS在肝纤维化中的作用。观察到类似的结果;肝脏和血清组织蛋白酶S水平随着纤维化进展而上调。此外,敲除CTSS可显著减轻DDC诱导的纤维化间隔形成、α-SMA+细胞积聚、胶原沉积和肝细胞死亡。因此,CTSS消耗可预防小鼠肝损伤和纤维化。
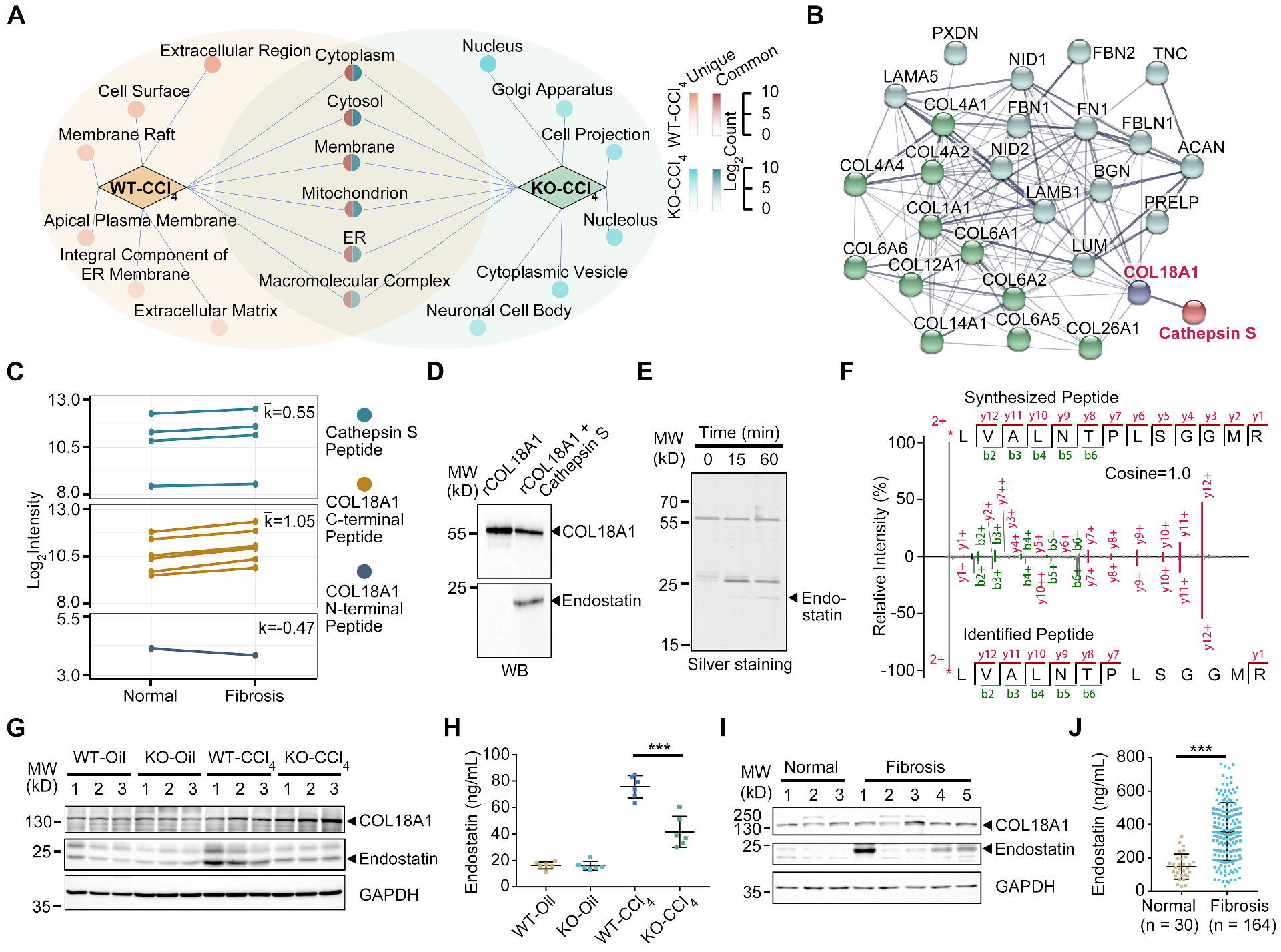
图3 组织蛋白酶S裂解胶原18A1生成内皮抑素
组织蛋白酶S参与目标蛋白的切割和降解。探索了组织蛋白酶S的潜在底物,可能有助于其促纤维化作用。TAILS 26的N端组学分析显示,CCL4诱导的纤维化肝脏中新N端肽显著增加,而CTSS缺失的纤维化小鼠中新N端肽进一步减少。CCL4诱导的纤维化肝脏中独特的新N端肽(独特肽≥2)主要定位于细胞外区域,包括ECM,与CTSS缺失的纤维化小鼠相比(图3A)。考虑到ECM重塑在肝纤维化中的作用,以及组织蛋白酶S与含胶原的ECM结构成分之间的强相关性(图1B-D),进一步分析了组织蛋白酶S与新N端肽衍生的ECM蛋白之间可能的相互作用。在纤维化肝脏中降解的26种独特的ECM蛋白中,只有胶原18A1与组织蛋白酶S有很强的相关性(图3B)。此外,在人纤维化肝脏中发现的不同胶原来源的肽中,胶原18A1的肽主要富集在其C端。
与胶原18A1的C端肽含量成正比,而与胶原18A1的N端肽含量成正比(图3C),提示胶原18A1的C端可能是组织蛋白酶S的直接靶点。
先前的研究表明,胶原18A1的C端可以被裂解,产生一种约20 kD的生物活性肽,内皮抑素。因此,在体外研究组织蛋白酶S是否直接降解胶原18A1生成内皮抑素。与组织蛋白酶S共培养降低了重组胶原18A1的含量,产生了内皮抑素抗体可识别的新条带,迁移分子量约为20 kD,与内皮抑素相似(图3D)。PAGE凝胶的银染色显示重组胶原18A1与组织蛋白酶S反应后降解产物的积累时间越来越长(图3E)。利用二甲基标记技术进一步鉴定了分子量为~20 kD的降解片段。然后末端标记结合质谱检测结果显示,N端肽序列为“LVALNSPLSGGMR”,表明新生成的条带为内皮抑素(图3F)。
进一步评估了组织蛋白酶S是否有助于纤维化肝脏中胶原18A1裂解为内皮抑素。WB分析表明,CTSS敲除消除了CCL4诱导的纤维化肝中内皮抑素表达升高(图3G)。CTSS缺失的纤维化小鼠血清内皮抑素水平也显著降低(图3H)。此外,证实肝纤维化患者的肝组织和血清中内皮抑素水平升高(图3I和J)。这些结果表明,组织蛋白酶S切割非纤维性胶原18A1生成内皮抑素。

图4 内皮抑素通过直接激活肝星状细胞,对组织蛋白酶s刺激的肝纤维化至关重要
接下来,评估了组织蛋白酶S是否通过催化内皮抑素的生成来促进肝纤维化。将重组内皮抑素肽注射到CCL4激发的WT或CTSS-KO小鼠体内,4周后解剖肝脏组织进行检查。组织学分析表明,补充内皮抑素对WT小鼠肝纤维化的影响较小,但可以恢复CTSS-KO小鼠的中膈形成、α-SMA+肌成纤维细胞积累和胶原沉积(图4A和B)。此外,内皮抑素的添加还逆转了CTSS消耗介导的纤维化小鼠肝损伤减轻。因此,胶原18A1来源的内皮抑素对组织蛋白酶S刺激的肝纤维化至关重要。
进一步探讨了组织蛋白酶S介导的内皮抑素上调如何促进肝纤维化的进展。内皮抑素是最有效的内源性血管生成抑制剂之一,对肝纤维化进展至关重要。免疫组化染色显示,尽管内皮抑素减少了WT和CTSS-KO小鼠的CD31+血管(一种可靠的血管生成标志物)的面积,但CTSS消耗对纤维化肝脏血管生成的影响最小(图4C和D)。人脐静脉内皮细胞体外成管实验表明,用CCL4激发的WT 或 CTSS-KO 小鼠提取的血清处理不影响成管的数量。此外,还分析了组织蛋白酶S对肝窦内皮细胞(LSECs)表型和窦毛细血管化的潜在影响。肝窦区图像显示,CTSS清除对LSECs凋亡影响不大。由胶原IV标记物确定的窦状窦毛细血管化也不受CTSS-KO或内皮抑制素额外治疗的影响,这表明组织蛋白酶S不会作用于LSECs来调节肝损伤或纤维化。因此,内皮抑素可能不会在体内通过肝脏新生血管促进组织蛋白酶s刺激的肝纤维化。
肝星状细胞(HSC)活化成肌成纤维细胞被认为是肝纤维化的中心事件。接下来,探讨内皮抑素是否可以作用于造血干细胞促进其转分化。观察到内皮抑素有效地增强了原代HSC中肌成纤维细胞标志物α-SMA的表达和COL1A1的产生(图4E和F)。为了进一步阐明内皮抑素诱导HSC活化的潜在途径,筛选了原代HSC中内皮抑素受体的表达模式,包括整合素α5/β1、VEGFR-2和VEGFR-3。FACS检测显示造血干细胞高表达整合素α5/β1,而VEGFR-2和VEGFR-3的水平相对较低(图4G)。重组内皮抑素能够与造血干细胞表面结合,并被整合素α5β1中和抗体强烈减弱(图4H)。免疫沉淀实验证实了内皮抑素和整合素α5之间的相互作用。重组内皮抑素的加入触发了整合素α5/β1下游FAK和ERK激酶的激活,但对JNK/AKT的磷酸化或整合素α5/β1亚基的表达没有影响(图4I)。此外,整合素α5/β1被其抑制剂ATN161或特异性中和抗体抑制,阻断了内皮抑制素诱导的α-SMA和COL1A1表达以及FAK和ERK激活(图4J)。因此,内皮抑素可以通过整合素α5/β1信号直接结合并激活HSC。
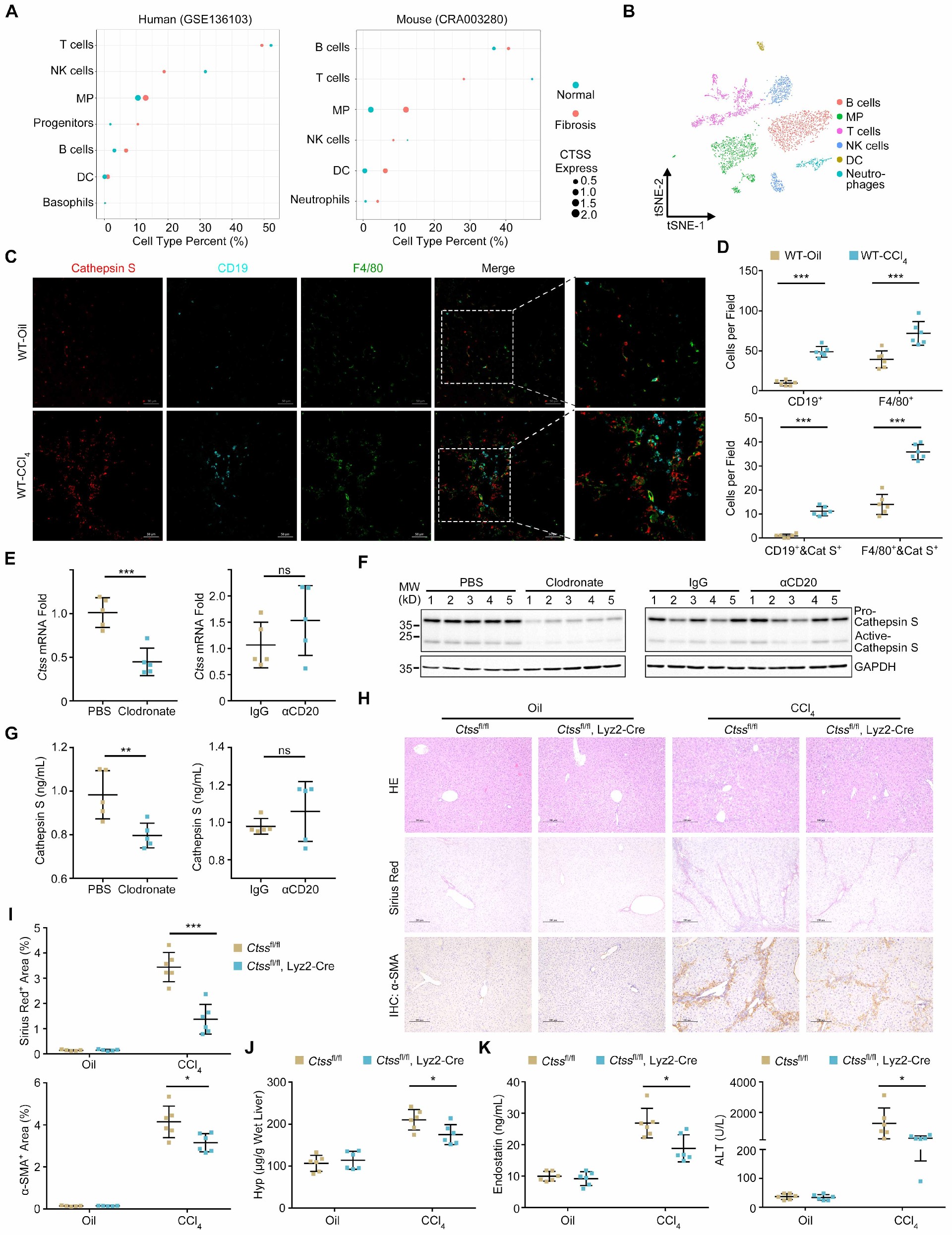
图5 巨噬细胞来源的组织蛋白酶S对小鼠肝纤维化至关重要
组织蛋白酶S主要在免疫细胞中表达。接下来,通过分析来自患者(GSE136103)和小鼠模型(CRA003280)的公开CD45+白细胞scRNA-seq数据来研究肝纤维化中分泌的组织蛋白酶S的可能来源。观察到,随着肝纤维化的发生,CTSS mRNA在不同类型免疫细胞中的表达基本不变,而在两个数据集中,表达CTSS的单核吞噬细胞(MPs)和B细胞的数量均显著增加(图5A)。
还通过scRNA-seq分析了CTSS转录本在CCL4诱导的纤维化肝脏中获得的CD45+细胞中的表达模式,发现CTSS mRNA水平在B细胞和MPs中较高(图5B)。此外,免疫荧光染色证实,在纤维化肝组织中,表达组织蛋白酶S的B细胞(CD19+和组织蛋白酶S+)和巨噬细胞(F4/80+和组织蛋白酶S+)的水平显著升高(图5C和D)。为了了解这两种细胞类型的浸润是否参与了纤维化肝组织中cathepsin的调控,分别使用氯钠脂泌体和抗cd20中和抗体消耗小鼠巨噬细胞和B细胞。观察到,通过长期使用氯膦酸脂质体去除巨噬细胞,可显著降低纤维化肝脏中CTSS转录本、蛋白表达和血清组织蛋白酶S水平。相反,B细胞清除不能触发这种变化(图5E-G)。而且,肝巨噬细胞中组织蛋白酶S的表达高于B细胞,尤其是在蛋白水平上。因此,巨噬细胞是肝纤维化过程中组织蛋白酶S表达和分泌增加的主要来源。
为了进一步验证巨噬细胞来源的组织蛋白酶S在肝纤维化中的作用,构建巨噬细胞特异性CTSS-KO和B细胞特异性CTSS-KO小鼠模型,并注射CCL4 7周。WB证实,只有巨噬细胞中CTSS的缺失才会降低肝组织蛋白酶S的表达。组织学分析表明,巨噬细胞特异性敲除CTSS而非B细胞可减轻天狼星红染色面积、α-SMA表达和羟脯氨酸含量(图5H-J。此外,巨噬细胞中CTSS敲除导致血清内皮抑素和ALT水平下调,而B细胞中没有CTSS敲除(图5K)。

图6 脾切除术可减轻纤维化肝中巨噬细胞浸润和组织蛋白酶S的表达
利用CCL4诱导的纤维化小鼠构建脾切除模型,进一步研究肝脾轴在肝巨噬细胞聚集和组织蛋白酶S上调中的作用(图6A)。脾切除术后5周取肝组织;组织学检查显示,脾切除抑制肝脏胶原沉积和α-SMA+肌成纤维细胞扩张(图6B和C)。免疫荧光染色证实,脾切除术与假手术组相比,显著降低了纤维化小鼠肝脏中F4/80+和F4/80+/cathepsin S+巨噬细胞水平(图6D和E),肝组织蛋白酶S的表达也受到脾脏切除的抑制(图6B、C和F)。脾切除术小鼠血清组织蛋白酶S和内皮抑素水平明显降低(图6G和H)。
此外,收集了25例肝硬化患者脾切除术前后的配对血清样本。观察到,术后1个月内血清组织蛋白酶S和内皮抑素水平明显下降,而纤维扫描检查值仅在术后1个多月后才出现明显下降(图6I)。
总的来说,这些结果表明,脾脏异常导致纤维化肝脏中巨噬细胞异常浸润和组织蛋白酶S上调。
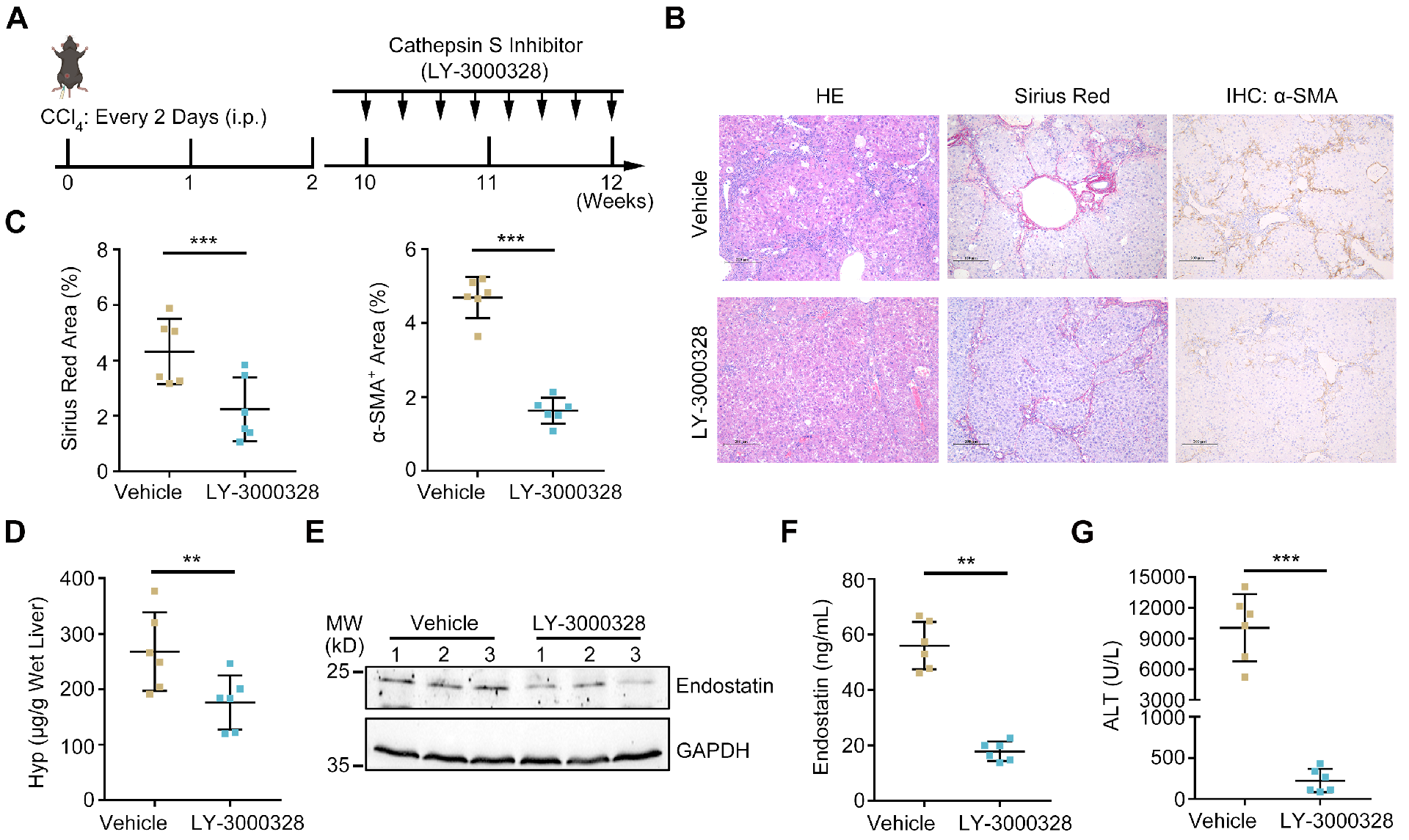
图7 组织蛋白酶S的药理抑制可改善小鼠肝纤维化
LY-3000328是一种有效的、选择性的组织蛋白酶S抑制剂。利用CCL4诱导的肝纤维化小鼠模型检测LY- 3000328是否能抑制肝纤维化。CCL4给药10周后,腹腔注射LY-3000328 (5 mg/kg),每2天1次,连续2周(图7A)。组织学分析表明,LY-3000328有效抑制了CCL4致毒肝组织中HSC的转分化、胶原蛋白的生成和纤维化间隔的形成(图7B-D)。此外,LY-3000328给药显著降低了肝脏和血清内皮抑素水平(图7E和F)。此外,通过血清ALT活性测量,抑制内源性组织蛋白酶S可预防慢性肝损伤(图7G)。总之,这些发现表明组织蛋白酶S抑制可能对肝纤维化治疗有益。
 技术咨询:
技术咨询: