胶质母细胞瘤进化的整合蛋白质基因组特征
2024-03-21
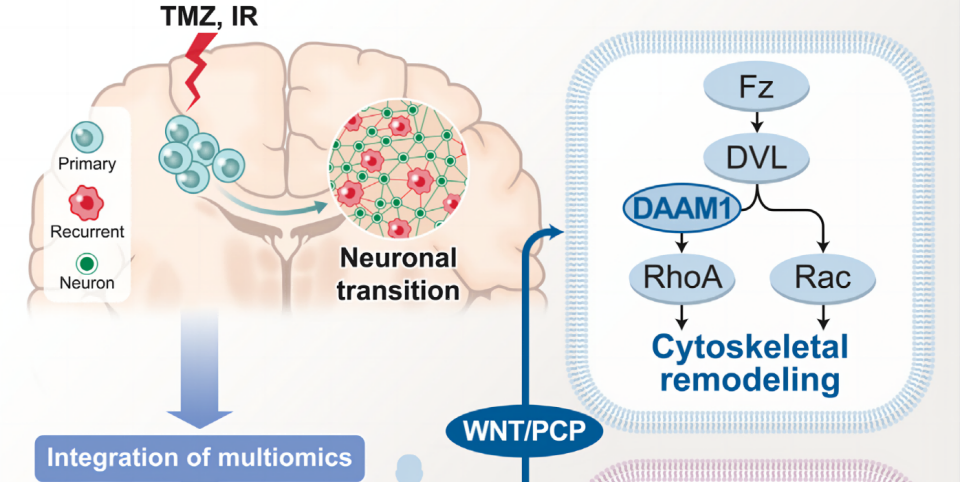
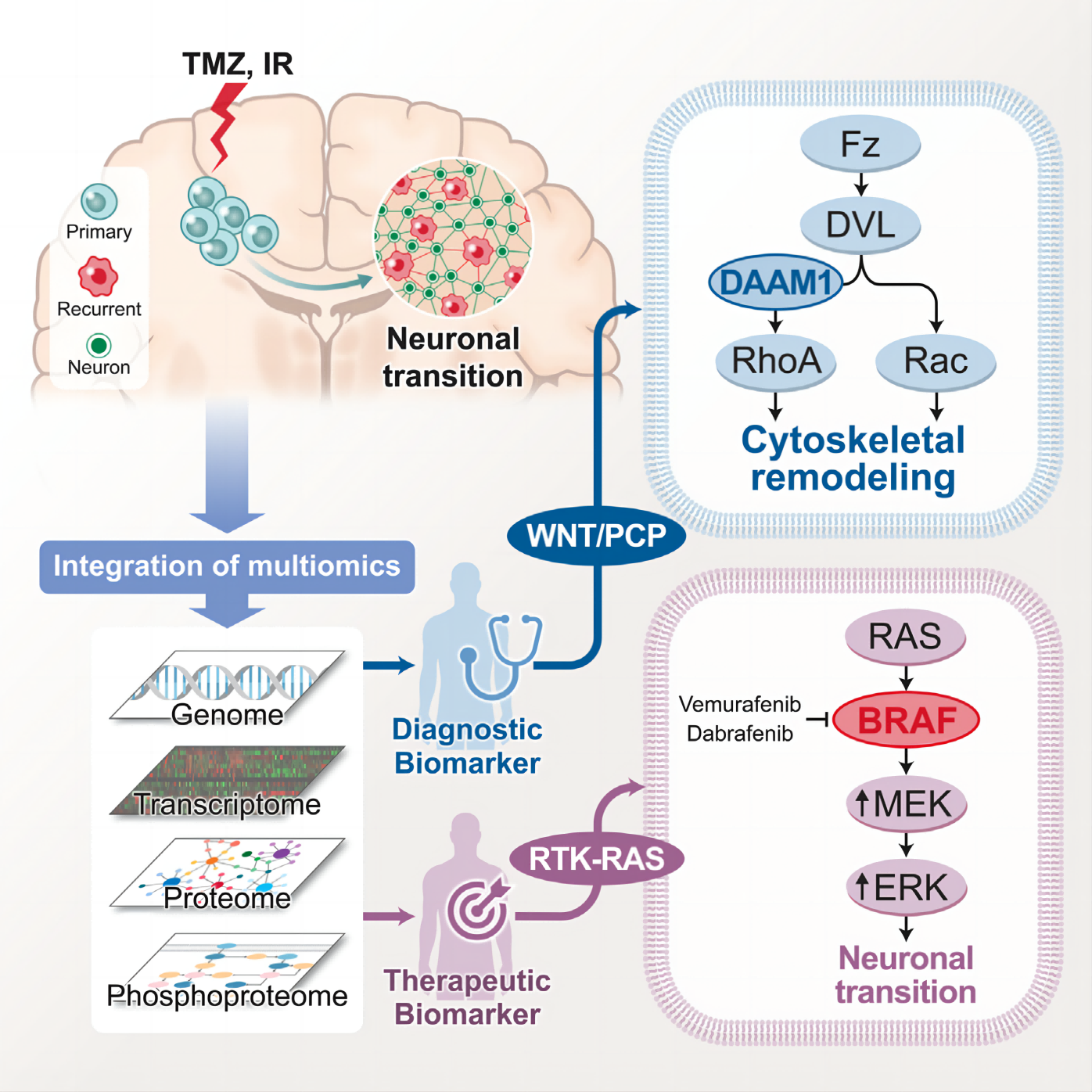
前言:
胶质母细胞瘤(GBM)是成人中最常见、最致命的原发性脑肿瘤,但是胶质母细胞瘤的进化轨迹是一个超越单纯基因改变的多层面生物学过程。当与基因组学和转录组学相结合时,蛋白质组学为研究癌症生物学中未被发现的隐藏维度提供了另一种方式。在这项研究中,作者对123例匹配的初发和复发的胶质母细胞瘤进行了全面的蛋白质基因组学分析,并采用基因组学和深度蛋白质组学特征的整合,以发现在治疗过程中驱动胶质母细胞瘤进化的显著变化。对纵向胶质母细胞瘤队列的蛋白质基因组学研究确定了神经元程序的激活是治疗后驱动肿瘤复发的主要机制。整合的多组学分析揭示了WNT/PCP通路和BRAF激酶的激活是复发性胶质母细胞瘤中神经元转化的分子决定因素,从而为胶质母细胞瘤患者的肿瘤复发提供了诊断和治疗工具。
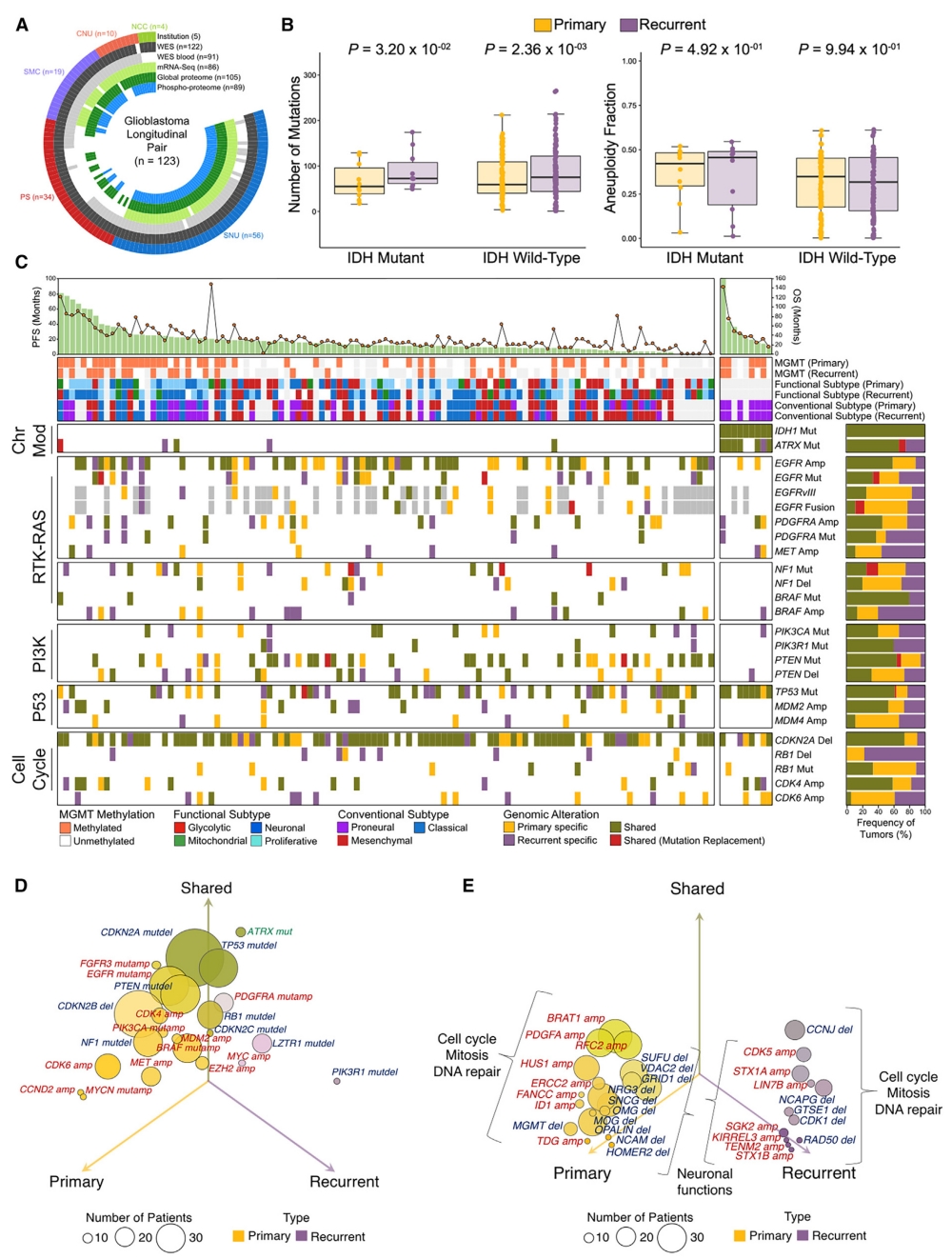
图1 纵向胶质母细胞瘤的分子轨迹
为了研究驱动GBM进化复杂分子轨迹的潜在机制,作者收集了来自5个不同机构的123例匹配的GBM纵向标本。其中,122个通过全外显子组测序(WES), 86个通过全转录组测序(WTS), 105个通过基于质谱的蛋白质组学来提供可靠的蛋白质和磷酸化蛋白定量(图1A)。排除超突变肿瘤后,作者观察到在异柠檬酸脱氢酶1 (IDH1)突变型和IDH1野生型GBM中,复发后的肿瘤突变负荷均显著增加,而非整倍体部分未表现出显著差异(图1B)。接下来,作者研究了GBM进化过程中主要驱动突变和拷贝数改变的发生情况。作者首先关注了构成胶质母细胞瘤核心致癌通路的驱动基因,包括受体酪氨酸激酶(RTK)-RAS信号通路、磷脂酰肌醇-3-激酶(PI3K)、p53、染色质修饰和细胞周期通路。IDH1突变在时间进化过程中表现出一致的稳定性 (图1C)。总体而言,作者发现从原发肿瘤到复发肿瘤,主要GBM驱动基因改变(包括CDKN2A、TP53、EGFR和PTEN)保持不变。相反,几个基因在原发性和复发性GBM中发生了差异改变。诊断时改变频率较高的基因包括CDK6和MET癌基因(扩增)以及NF1肿瘤抑制基因(突变/缺失)(图1D)。复发性GBM的标志是神经元分化促进基因(包括SGK2、LIN7B、STX1A和CDK5)的功能性扩增(图1E),这表明细胞增殖可能是治疗前GBM肿瘤扩张的驱动力。
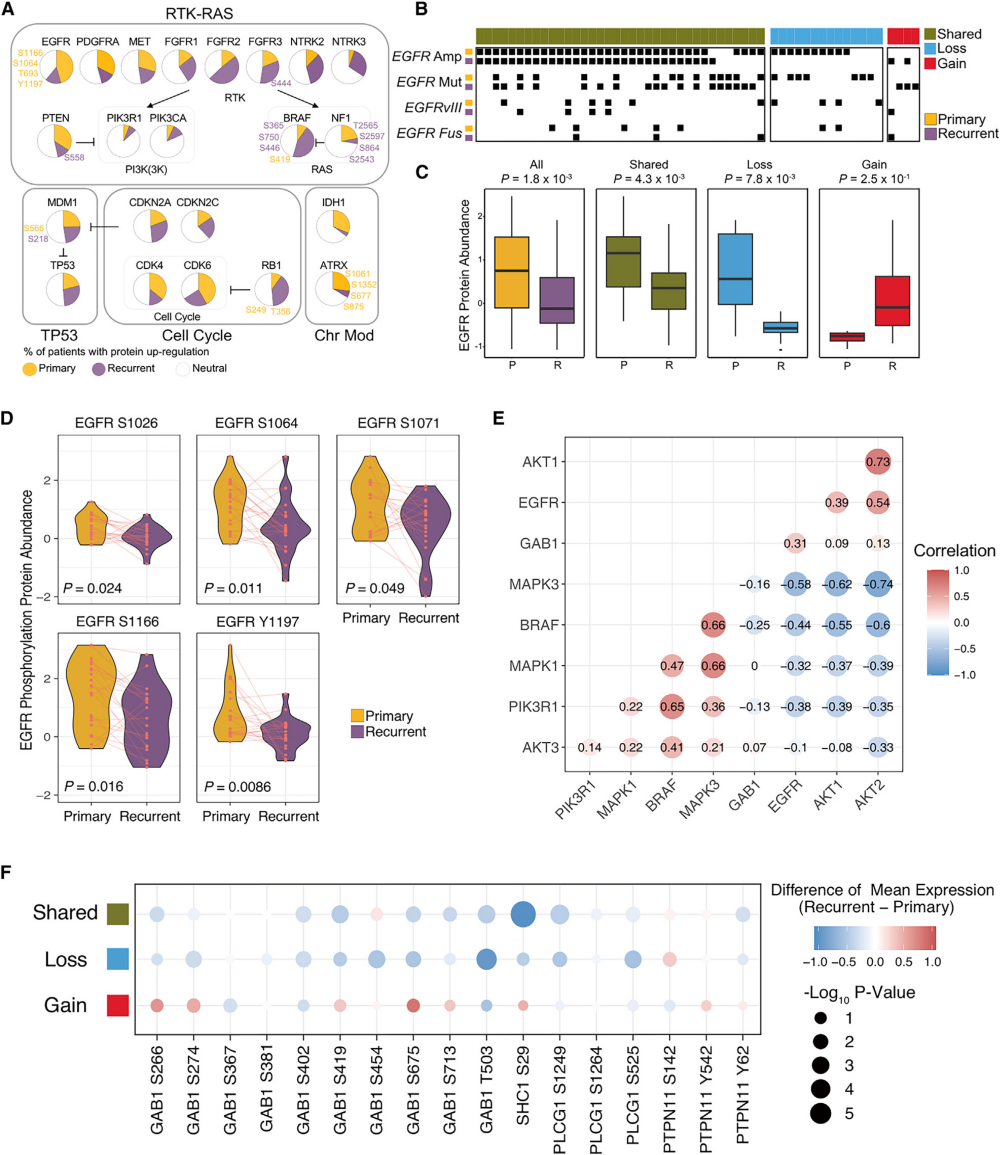
图2 EGFR基因组改变对复发后下游信号传导的影响
当作者在蛋白水平研究GBM进化过程中的这些关键致癌信号通路时,作者发现FGFR2/3、NTRK2/3和BRAF蛋白主要在复发性肿瘤中富集,而EGFR、CDK4和CDK6蛋白的丰度在原发肿瘤中增加(图2A)。研究已证明EGFR在原发性GBM中的重要功能,但其在驱动GBM复发中的作用仍不清楚。作者分析了匹配的初发-复发GBM样本中EGFR基因组改变的动态变化。作者确定了三组不同的患者,其中一组在原发肿瘤和复发肿瘤中均有EGFR改变,而在另外两组中,复发肿瘤的EGFR改变要么丢失,要么获得(图2B)。正如预期,复发时EGFR改变的丧失与EGFR蛋白减少相关(图2C)。值得注意的是,在复发时维持EGFR改变的肿瘤中也检测到EGFR丰度和磷酸化的减少,这提示翻译后机制在进化过程中发挥作用,以减弱EGFR信号传导(图2D)。EGFR主要通过下游信号通路PI3K-AKT-PTEN-mTOR和RASRAF- MEK-ERK来执行致癌活性。作者发现EGFR和GAB1与AKT1和AKT2蛋白呈显著正相关,但与BRAF和MAPK1/3蛋白呈显著负相关(图2E)。作者发现,磷酸化EGFR (Y1197, S1166)在维持EGFR基因改变的复发肿瘤和复发时病变丢失的肿瘤中显著降低。与此同时,复发时磷酸化GAB1 (S402, T503)显著降低(图2F)。总之,EGFR信号通路在复发性GBM中大部分是失活的。
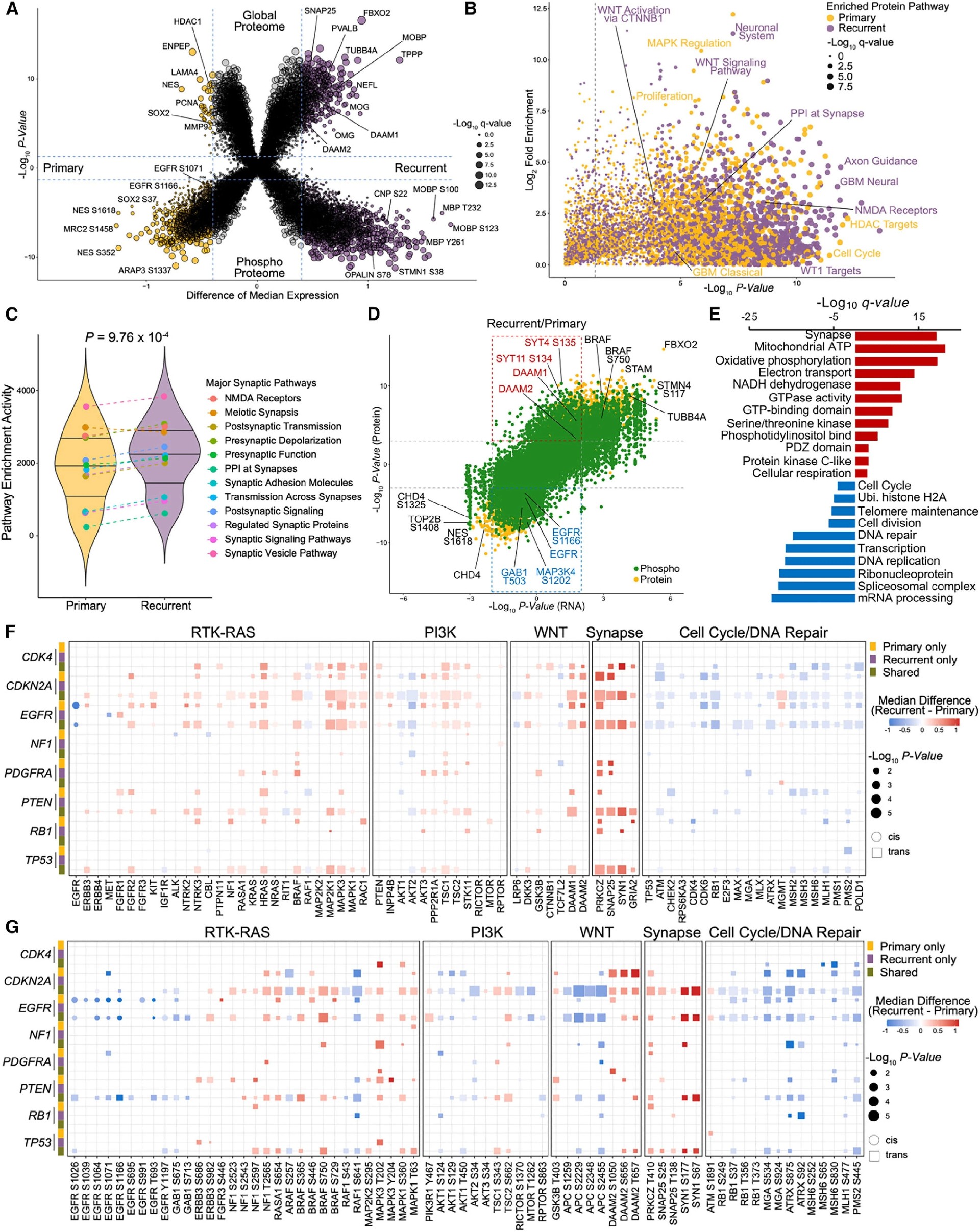
图3 纵向GBM的蛋白质基因组特征显示复发性GBM的神经元活动增加
为了鉴定复发性胶质母细胞瘤的生物学特征,作者检测了配对的胶质母细胞瘤对的差异蛋白质组和磷酸化蛋白质组。作者发现在复发性GBM中增加的377种蛋白和1,820种磷酸化蛋白中包括SNAP25、TUBB4A、NELF、DAAM1/2、STMN1和MBP(图3A)。通路富集分析显示,复发性肿瘤的特征是与神经元结构和功能以及突触形成(突触前和突触后活动)有关的蛋白和磷酸化蛋白的升高。另一方面,原发性GBM主要富集于DNA复制、细胞增殖、丝裂原活化蛋白激酶(MAPK)调节、细胞外基质功能和EGFR信号传导的激活(图3B和3C)。虽然复发性GBM中大多数蛋白的相应mRNA有一致的变化(n=8,207, PLP1、GFAP、FBXO2、STMN4),但许多分子显示了mRNA-蛋白解离(SYT4/11、DAAM1/2、BRAF、EGFR及其底物GAB1)(图3D)。生物通路富集分析显示,复发时增加的蛋白和磷酸化蛋白与突触形成、GTP酶活性和氧化磷酸化显著相关。相反,与细胞分裂、mRNA加工和转录相关的蛋白质和磷蛋白在原发性GBM中更为丰富(图3E)。作者发现顺式作用(同源基因产物)对EGFR有很强的影响,复发时多个位点(S1071、S1166和T693)的总蛋白和磷酸化丰度显著降低(图3F和3G)。在反式作用(其他基因产物)水平,携带多种GBM驱动基因改变(如EGFR、PDGFRA、PTEN和TP53)的复发性肿瘤表现出RAS通路成员(NTRK2/3、BRAF和MAP2K1/2)、WNT通路成员(DAAM1/2)和参与突触形成的蛋白(PRKCZ、SNAP25、SYN1和GRIA2)的蛋白和磷酸化蛋白水平升高(图3F和3G)。
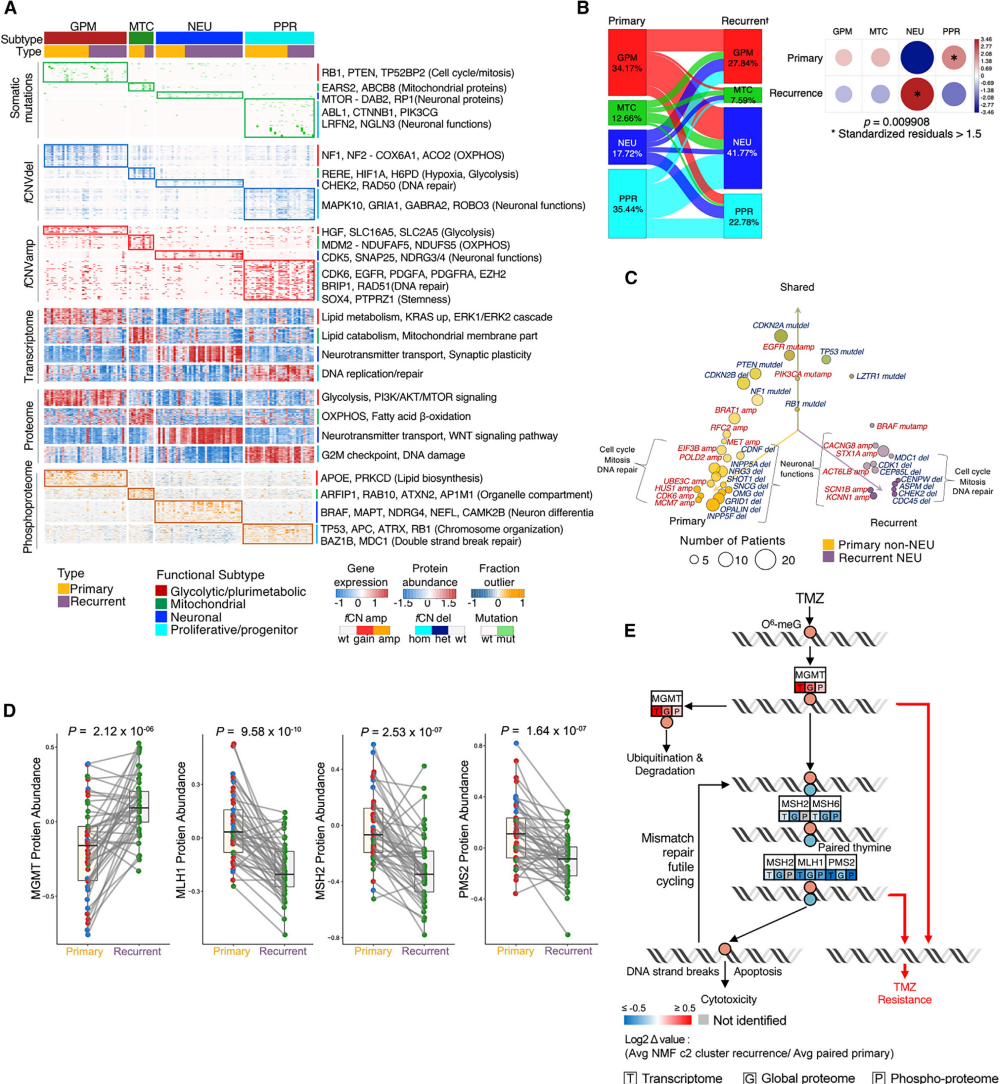
图4 综合多组学聚类揭示了GBM在原发时向复发时神经元状态的转变
作者将四种肿瘤亚型分为两个功能分支,神经发育分支(增殖/祖细胞,PPR和神经元,NEU)和代谢分支(糖酵解/多元代谢,GPM和线粒体,MTC) (图4A)。然后,作者量化了匹配的原发肿瘤和复发肿瘤的亚型转换频率,发现复发性GBM表现出显著较低的PPR频率和较高的NEU亚型频率(图4B)。复发肿瘤与神经元分化和突触活动相关的基因如BRAF、STX1A、KCNN1、SCN1B和ACTL6B出现fCNV扩增,与细胞周期、有丝分裂和DNA修复相关的基因如CHEK2、ASPM、CENPW、CDK1和MDC1出现fCNV缺失。相反,原发肿瘤主要表现为参与细胞周期、有丝分裂和DNA修复功能的基因的fCNV增加,以及控制神经元分化和特化神经元功能的基因的fCNV丢失(图4C)。C2亚型肿瘤复发时MGMT蛋白表达增加,MMR蛋白(包括MSH2、ML1和PMS2)表达下调(图4D)。虽然之前的研究表明,主要由失活突变引起的MMR缺乏导致GBM进展期间对TMZ耐药,但作者的研究结果提示,蛋白失活(可能通过蛋白降解)也可能是导致GBM复发的一个重要机制(图4E)。
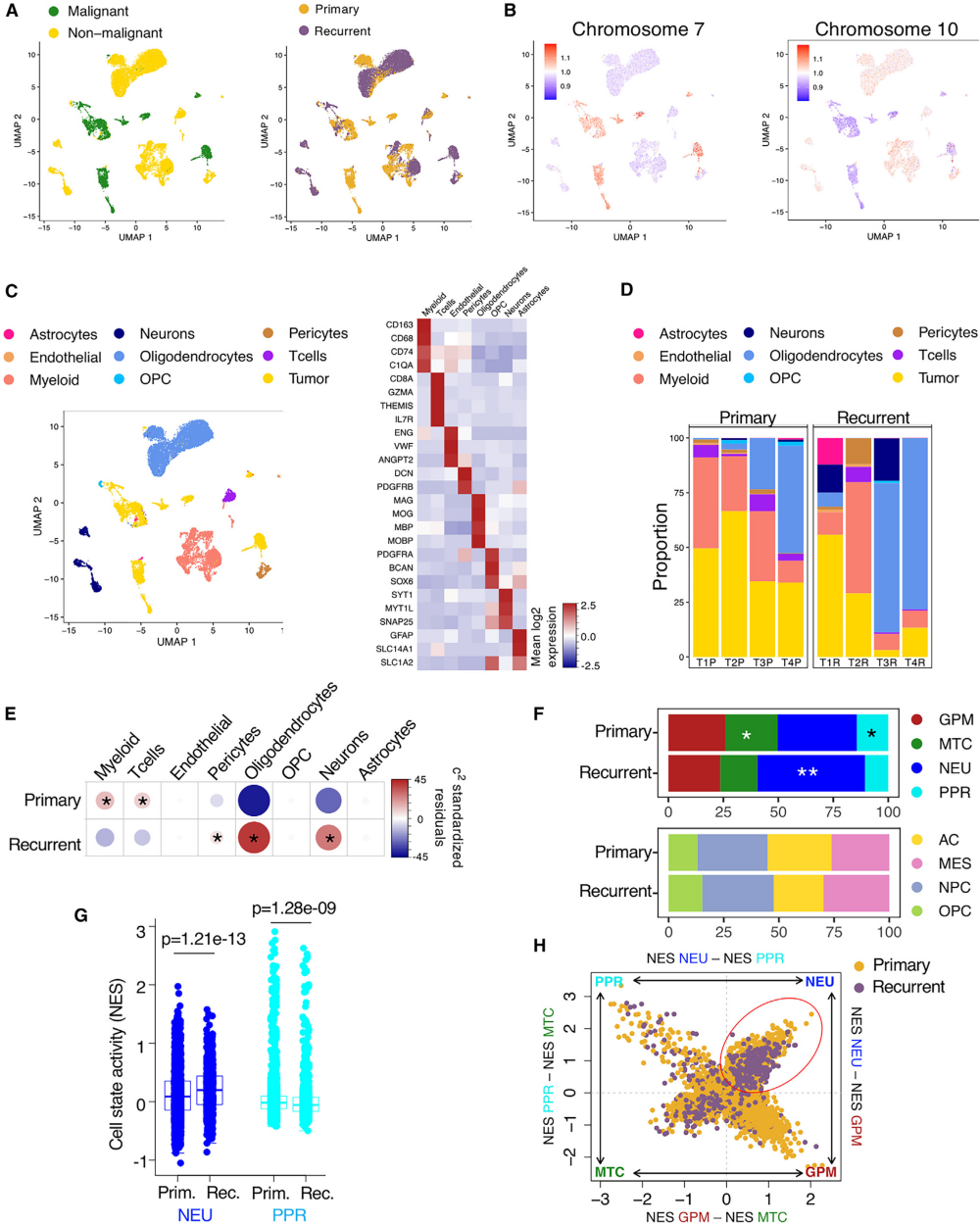
图5 单细胞分析显示复发性GBM的TME中肿瘤固有神经元状态、神经元和少突胶质细胞增加
为了评估复发时神经元和突触活动的富集是否是肿瘤细胞固有的,而不是来自微环境,作者对4对配对的原发性和复发性肿瘤组织标本进行了单细胞RNA测序。作者首先根据每个细胞中的大规模染色体CNVs区分了4,228个恶性细胞和12,258个非恶性细胞(图5A和5B)。降维分析(Uniform Manifold Approximation and Projection, UMAP)显示了8种主要的非恶性细胞类型,它们高表达不同的标记基因,包括少突胶质细胞、髓样细胞、T细胞、星形胶质细胞、少突胶质细胞祖细胞(OPCs)、内皮细胞、周细胞和神经元(图5C)。对比分析原发和复发GBM的肿瘤微环境(TME)发现,在复发肿瘤中,少突胶质细胞和神经元增多,髓样细胞和T细胞减少(图5D和5E)。在肿瘤细胞状态方面,我们基于通路功能状态分析了复发性GBM的进化轨迹,发现GBM进化的标志是PPR(从14.2%到10.5%)和MTC(从23.8%到16.8%)的降低和NEU状态的增加(从36.2%到49.0%)(图5F)。相反,另一种胶质瘤细胞状态分类器(包括NPC样、OPC样、AC样和MES样状态)未发现原发性和复发性GBMs之间有显著变化(图5F)。PPR和NEU细胞状态活性的计算证实,以牺牲干/祖细胞样活性为代价,神经元功能整体增加(图5G)。肿瘤的象限/状态聚集表明,神经元活动是复发性肿瘤的主要生物学特征(图5H)。
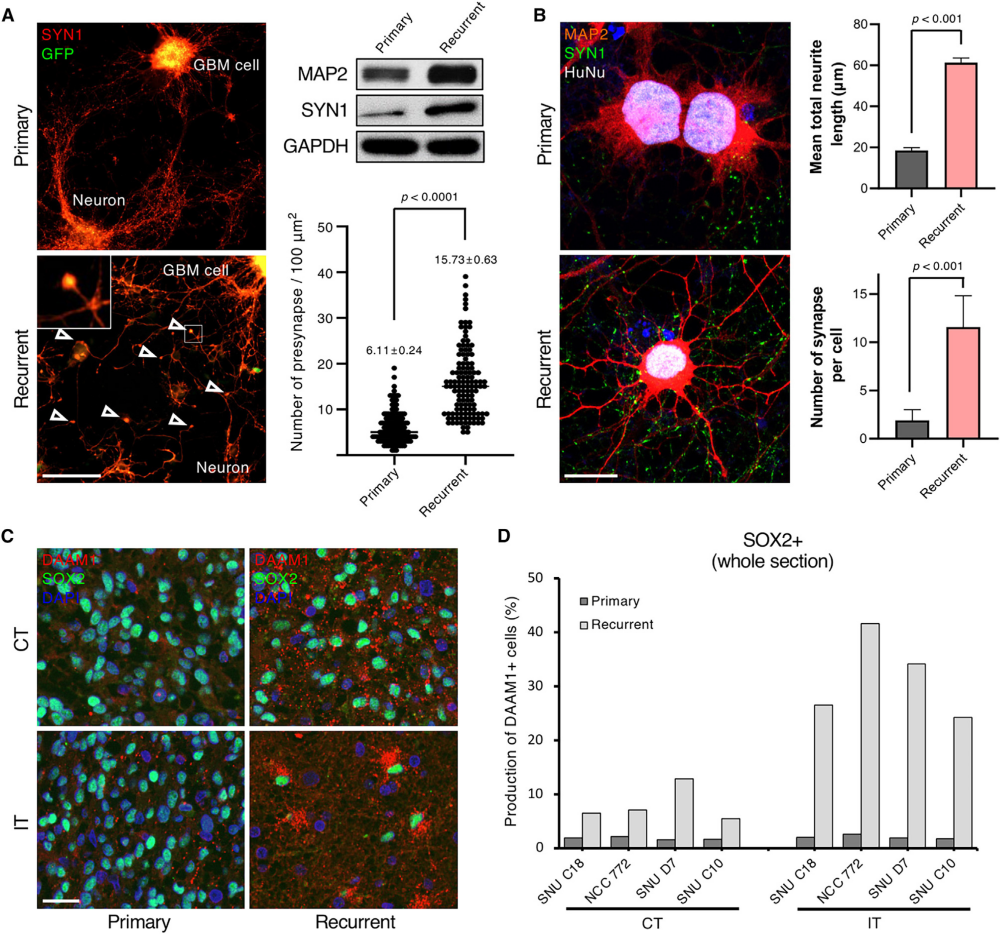
图6 复发性GBM突触活性增强的功能验证
作者将匹配的GFP标记的原发和复发的GBM患者来源的肿瘤细胞与小鼠皮质神经元共培养。通过对synapsin-1进行定量免疫荧光和免疫印迹分析,作者发现,与原发性肿瘤相比,复发性GBM细胞的特征是突触前数量增加(图6A)。此外,与来自原发肿瘤的细胞相比,复发肿瘤细胞每个细胞产生了大量突触,并且显示出更长突起(图6B)。有趣的是,无论分析的是哪个区域,在原发肿瘤的两个区域几乎都检测不到DAMM1的表达。相比之下,复发性肿瘤的肿瘤核心中DAMM1表达水平较高,在浸润边缘观察到明显增加(图6C和6D)。
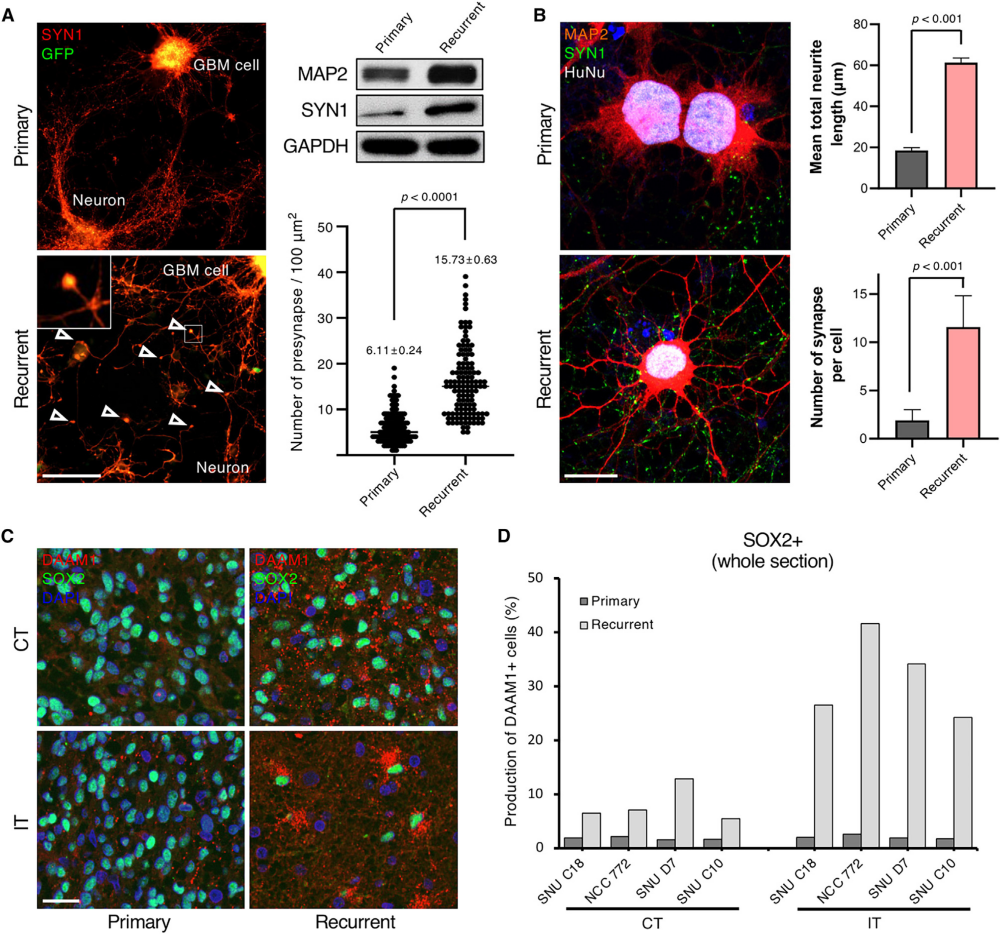
图7 复发时神经元转化的体内模型
为了研究神经元复发性胶质母细胞瘤进化轨迹中转录组、蛋白质组和磷酸化蛋白质组的动态调控,作者使用来自治疗后发生神经元转化的患者的肿瘤细胞建立了PDX模型。图7A表示整个的实验过程。然后用TMZ或者vehicle处理小鼠,并在多个时间点(从第7-41天)收集GBM组织样本用于蛋白质基因组学分析。组织采集是基于代表GBM模型复发状态的MRI结果。结果显示TMZ治疗显著延长了小鼠的总生存期(图7B)。初始时间点(T7, T18和T27)表现出增加的干性活性,细胞增殖和染色质重塑。使用无监督共调控聚类进行的独立分析显示,在T34有两个不同的蛋白和磷酸位点聚类显著不同。在T34降低的C1显著富集于细胞周期蛋白,氧化磷酸化,MYC和E2F靶点。相反,在T34富集的C2富集了参与神经元功能的蛋白和通路,如神经递质释放、多巴胺能突触和钙信号(图7D和7E)。免疫荧光分析证实,与vehicle治疗的肿瘤相比,TMZ治疗的PDXs中T34的DAMM1表达增加(图7F)。
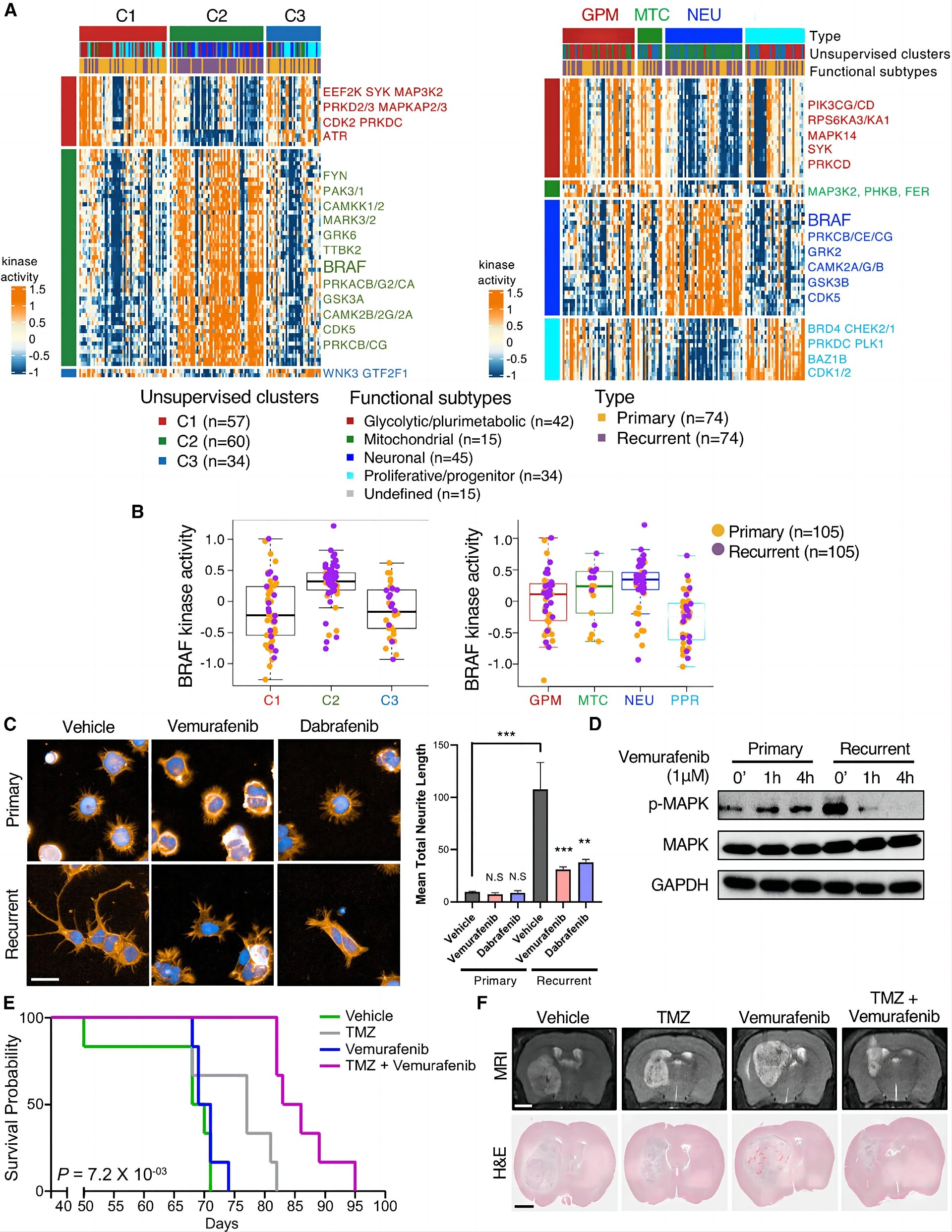
图8 鉴定BRAF是GBM进化的关键治疗靶点
为了确定在复发性GBM中驱动神经元转化的潜在治疗靶点,作者使用SPHINKS重建了原发-复发性GBM特异性激酶-磷酸相互作用网络,SPHINKS是一种最近开发的工具,它整合了蛋白质组学和磷酸化蛋白质组学特征,以构建激酶-磷酸-底物对的相互作用组,根据它们在所有样本中的相互作用强度进行评分。丝氨酸/苏氨酸蛋白激酶BRAF是基于多组学的簇C2(主要由神经元复发性GBM组成)和基于功能分类器的NEU亚型中活性最高的激酶之一(图8A和8B)。1 mM浓度的BRAF抑制剂治疗导致复发性GBM细胞的神经突起塌陷(图8C)。扩散试验证实,维莫非尼减少了神经元细胞迁移,在复发性GBM细胞中效果最明显。此外,维莫非尼显著降低了复发性GBM细胞中MAPK1/3的磷酸化,但对原发肿瘤细胞无影响(图8D)。此外,维莫非尼联合TMZ显著延长了GBM PDX模型的总生存期,并缩小了肿瘤大小(图8E和8F)。这些发现共同表明,BRAF在GBM向神经元状态进化过程中驱动神经元属性,BRAF抑制剂可以作为有用的治疗工具,防止复发性GBM中与耐药相关的神经元转化。
 技术咨询:
技术咨询: