阿尔茨海默病治疗新发现:免疫疗法激活小胶质细胞,助力淀粉样蛋白清除
2025-03-26
本期介绍来自美国西北大学Lynn van Olst研究团队于2025年3月发表在nature medicine(IF=58.7)杂志上,名为Microglial mechanisms drive amyloid-β clearance in immunized patients with Alzheimer’s disease的文章。文章链接:https://doi.org/10.1038/s41591-025-03574-1
背景
阿尔茨海默病(AD)与淀粉样β蛋白(Aβ)沉积密切相关。本研究通过空间转录组学和单细胞RNA测序,分析了主动(AN1792)和被动(仑卡奈单抗)Aβ免疫接种的免疫效果,来揭示了免疫介导的Aβ清除机制。
结果
1.主动Aβ免疫接种维持了Aβ微环境中的炎症
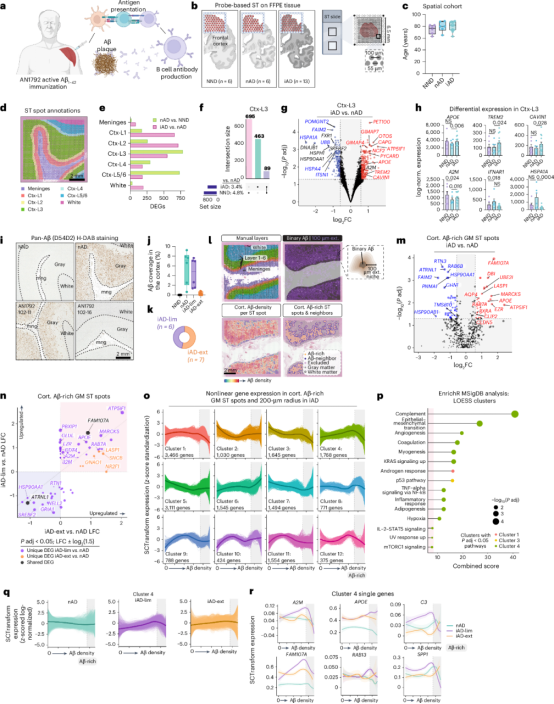
对AN792试验的AD患者前脑皮层(FCX)切片进行空间转录组学(ST)分析,鉴定了不同皮质层的差异表达基因(DEGs)(图1a-1d)。发现皮质III层在iAD与nAD的比较中表现出显著的转录组变化,包括TREM2和APOE等髓系基因的上调,以及热休克蛋白(HSPs)基因的下调。iAD大脑中与突触可塑性相关的基因如SEMA3G和HES5上调(图1e-1h)。通过免疫组化(IHC)量化Aβ病理,iAD患者被分为有限(iAD-lim)和广泛(iAD-ext)Aβ清除组(图1i-1l)。Aβ微环境的转录组分析显示,iAD-lim组中炎症基因如B2M、A2M、CD74和APOE显著上调(图1m-1n)。层次聚类和通路分析发现Aβ富集区域中特别是IL-2-STAT5和补体信号传导免疫相关途径的激活(图1o-1r)。表明AN1792免疫接种后,Aβ微环境中持续存在炎症反应,且炎症基因在AD患者中显著上调。
2.小胶质细胞表型定义了不同程度的Aβ清除
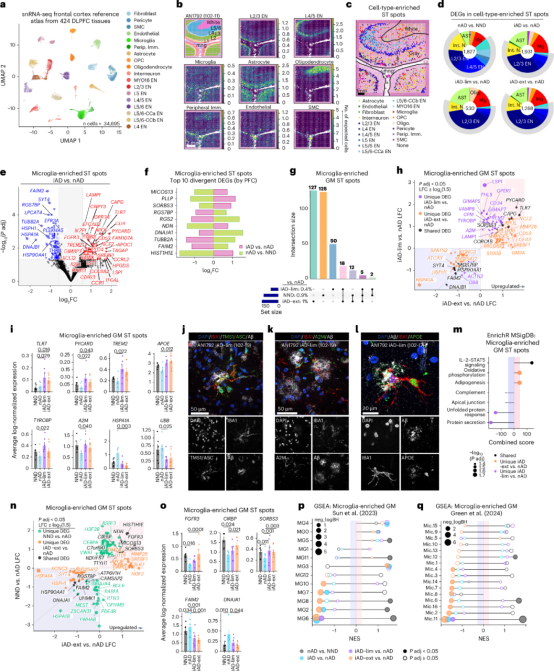
利用Cell2Location(C2L)工具将空间转录组(ST)数据与单细胞核RNA测序(snRNA-seq)数据整合,解析了AN1792免疫接种后AD患者前脑皮层的细胞组成。结果显示,灰质中星形胶质细胞数量增加,而L2/3兴奋性神经元(ENs)减少。L2/3 ENs富集的ST点中差异表达基因(DEGs)最多,其次是微胶质细胞和星形胶质细胞(图2a-2d)。与nAD相比,iAD中小胶质细胞富集的ST点显示APOE、TREM2、A2M等淀粉样反应基因上调,而热休克蛋白(HSP)基因下调。iAD-ext组中小胶质细胞状态变化更显著,FGFR3、PYCARD等基因上调,表明Aβ清除与小胶质细胞代谢状态相关(图2e-2l)。iAD-ext组小胶质细胞从糖酵解转向氧化磷酸化,而iAD-lim组补体和未折叠蛋白反应途径下调(图2m-2q)。表明有效的Aβ清除依赖于小胶质细胞代谢状态的平衡,以减少Aβ的神经毒性。
3.被动Aβ免疫接种诱导不同的小胶质细胞状态
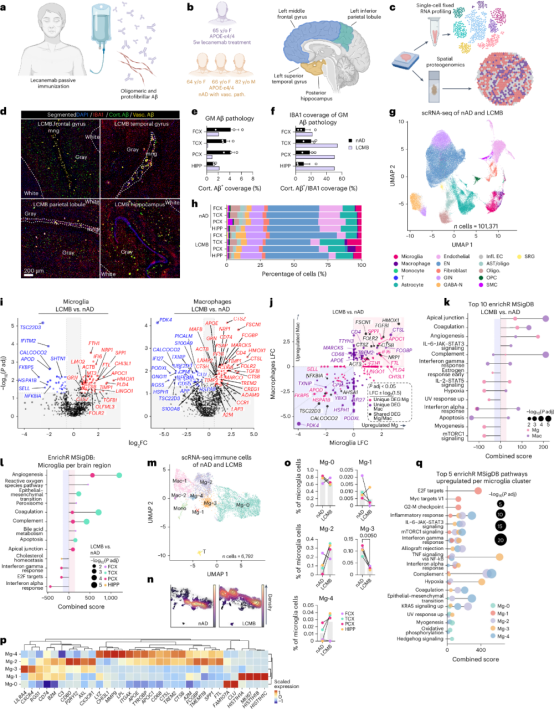
通过单细胞RNA测序和空间蛋白质组学研究分析了一名接受仑卡奈单抗被动免疫治疗的AD患者,发现其皮层血管和实质Aβ斑块被吞噬,且Aβ清除存在区域差异(图3a-3f)。仑卡奈单抗治疗后,小胶质细胞和巨噬细胞中与活化、溶酶体功能和干扰素反应相关的基因(如SPP1、APOC1、TREM2)上调,而热休克蛋白(HSP)基因下调。血管功能调节和补体信号通路在巨噬细胞和小胶质细胞中显著上调。Aβ清除率较高的区域(如TCX和PCX)中,小胶质细胞的补体信号、溶酶体功能和铁代谢相关基因表达增加(图3g-3l)。此外,鉴定出的两种小胶质细胞状态(Mg-2和Mg-4),均表达APOE和TREM2,并表现出增强的补体信号(图3m-3q)。表明仑卡奈单抗治疗通过触发特定的小胶质细胞适应性反应,促进了Aβ清除;揭示了区域间Aβ清除差异的潜在机制。
4.空间蛋白质组学将Aβ微环境与小胶质细胞状态联系起来
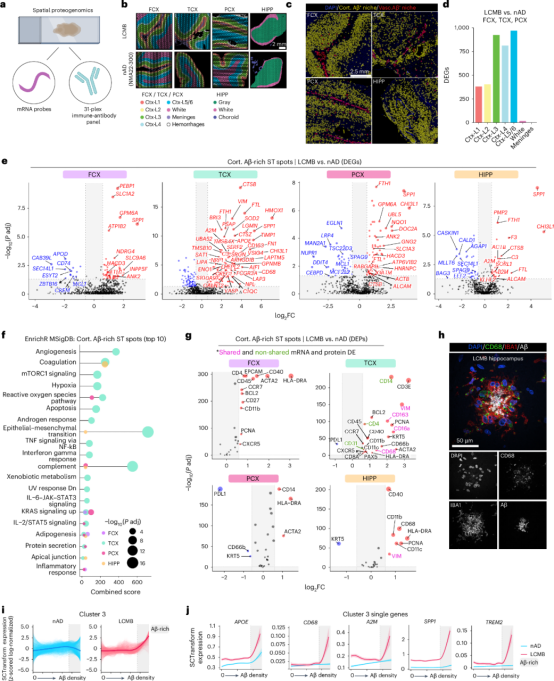
研究通过空间蛋白质组学分析了仑卡奈单抗治疗后AD患者Aβ微环境中的免疫反应。结果显示,深层皮层(III、IV和V/VI层)的Aβ富集区域中差异表达基因(DEGs)最多,与补体信号(如C3、C1QC)、脂质代谢(如APOE、LIPA)和溶酶体功能(如CTSB)相关的基因表达上调。SPP1和FTH1在所有脑区的Aβ微环境中均上调,表明其在Aβ清除中的重要作用(图4a-4f)。蛋白质组学分析发现,HLA-DRA在所有脑区的Aβ富集区域中上调,而CD11c和CD68在TCX和HIPP中上调,提示小胶质细胞吞噬活性增强。此外,Aβ清除率较高的区域(如TCX、PCX)中免疫抑制受体配体PD-L1减少(图4g-4h)。研究还鉴定出与Aβ清除相关的小胶质细胞状态,包括A2M、APOE、APOC1等基因的上调(图4i-4j)。揭示了仑卡奈单抗治疗后Aβ微环境中补体信号、脂质代谢和溶酶体功能的激活,以及小胶质细胞在Aβ清除中的关键作用。
5.免疫接种后,共享的小胶质细胞反应驱动Aβ清除
研究通过量化灰质中的Aβ覆盖率,发现仑卡奈单抗和AN1792治疗后Aβ覆盖率下降,且髓系细胞向Aβ的募集增加。整合分析揭示了9个基于基因表达的Aβ生态位簇,其中富含小胶质细胞的Aβ-6簇在仑卡奈单抗治疗样本中最为显著,表现为A2M、APOE、C1QC、C3和SPP1等基因的上调(图5a-5f)。AN1792样本中,FAM107A、RAB13和TREM2等基因在Aβ-6簇中上调,而仑卡奈单抗治疗样本中A2M、APOE和SPP1显著上调(图5g-5m)。免疫荧光染色证实,仑卡奈单抗治疗后Aβ斑块附近小胶质细胞中SPP1和APOE表达增加。两种治疗均显示TREM2和APOE的共同上调,而FAM107A和SPP1分别为AN1792和仑卡奈单抗的特异性反应基因(图5n-5u)。相关性分析表明,AN1792抗体滴度与TREM2/APOE表达呈正相关,且APOE表达与Aβ斑块评分呈负相关,提示小胶质细胞中的APOE和TREM2表达与Aβ清除密切相关(图5v)。揭示了主动和被动Aβ免疫接种后小胶质细胞反应的共同和独特特征。

总结
本研究揭示了AD患者对Aβ疫苗接种的小胶质细胞反应,发现APOE和TREM2在主动和被动免疫中均上调,表明其在Aβ清除中的关键作用。主动免疫后,小胶质细胞中应激基因减少,神经保护基因表达增加,代谢向氧化磷酸化转变。仑卡奈单抗治疗诱导了两种与Aβ斑块相关的小胶质细胞亚型,补体信号增强。两种治疗均上调APOE和TREM2,下调应激基因,且APOE/TREM2表达与抗体滴度正相关,与Aβ负荷负相关。这些发现为优化AD免疫治疗提供了新方向。
 技术咨询:
技术咨询: