神经免疫双向调控:从神经递质到免疫因子的跨界对话
2025-03-14
近年来的研究揭示了神经系统与免疫系统之间复杂而动态的交互作用,这一领域被称为"神经免疫学"。本文基于四篇高分论文,系统综述了神经免疫交互的核心机制及其在疾病调控中的关键作用。研究显示,神经递质、细胞因子、外周与中枢神经环路通过多模态信号传递形成双向调控网络,不仅参与癌症、神经退行性疾病的病理进程,还在感染、过敏反应中发挥核心作用。在肠道健康领域(之前推文"肠道健康新发现:神经免疫的关键作用"),这种神经免疫调节机制通过肠-脑轴的特殊环路展现出独特的免疫记忆编码特性,其中神经信号对肠道菌群代谢产物的动态响应机制尤为关键。基于上述机制,本文进一步分析靶向神经免疫轴的新型治疗策略,整合前沿发现为开发跨系统的精准疗法提供了全新视角。
一、 神经免疫交互的分子机制与调控网络
1.1 神经递质与免疫因子的双向对话
神经-免疫系统的分子对话建立在共享信号通路基础上。肿瘤微环境中交感神经通过释放去甲肾上腺素,激活β2-肾上腺素受体信号通路,诱导肿瘤相关巨噬细胞表达精氨酸酶1,促进免疫抑制微环境形成(图1)。这种神经支配具有器官特异性,如胰腺癌中胆碱能神经通过α7烟碱型乙酰胆碱受体(α7nAChR)抑制CD8+ T细胞浸润,而前列腺癌中肾上腺素能神经则促进血管生成拟态形成。

图1. 神经系统与实体瘤之间的双向交流
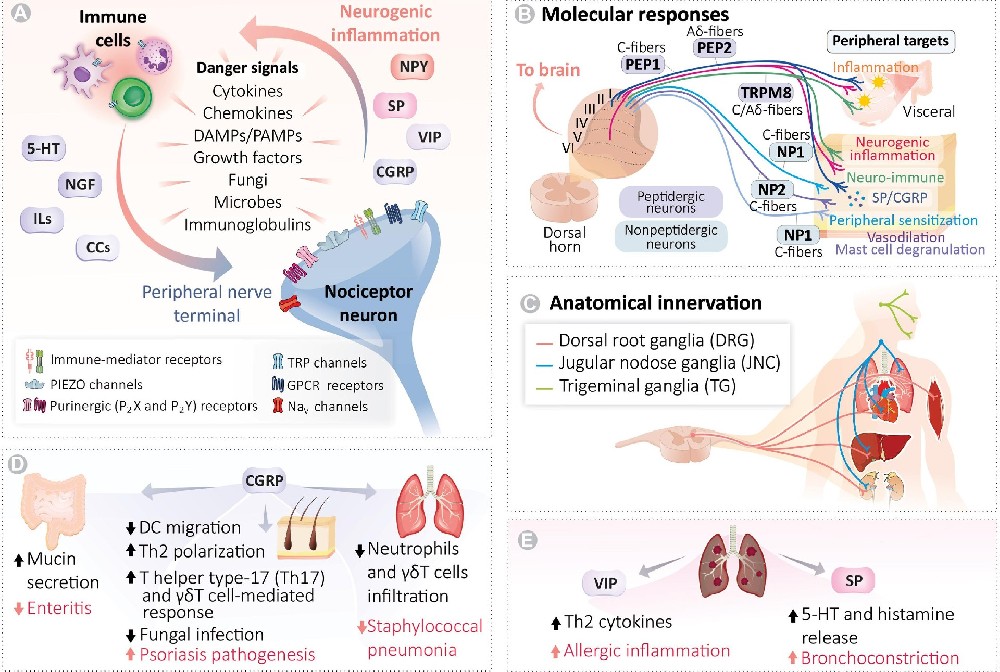
感觉神经元通过多重模式识别机制参与免疫调控。皮肤TRPV1+神经元可直接识别金黄色葡萄球菌的甲酰化肽,通过Nav1.8通道触发动作电位,诱导局部IL-17A+ γδ T细胞募集(图2)。单细胞测序发现背根神经节存在11种功能亚群,其中Tac1+亚群特异性表达TLR3/7/9和RIG-I等模式识别受体,在病毒感染时分泌CCL2/CXCL10调控DC迁移。

图2. 神经元产生的免疫介质
1.2中枢神经系统的免疫调控枢纽
前额叶皮层-下丘脑-垂体轴构成神经免疫调控核心。慢性压力通过前额叶谷氨酸能神经元过度激活,诱导小胶质细胞IL-1β分泌增加,导致海马神经发生抑制(图3)。这种调控具有双向性:乳腺癌患者外周IL-6水平升高可穿透血脑屏障,激活下丘脑室旁核CRH神经元,通过HPA轴促进糖皮质激素分泌,形成正反馈环路。
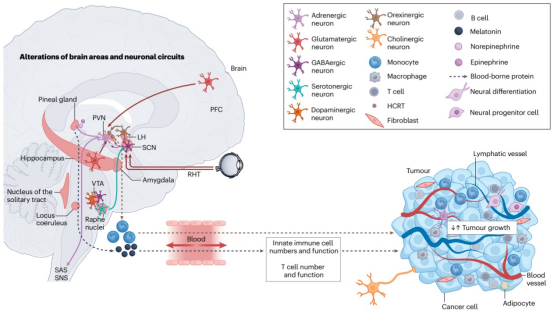
图3. 参与肿瘤发生与发展的脑区和神经环路
二、 疾病进程中的神经免疫失衡
2.1 肿瘤微环境中的神经重塑
肿瘤神经支配呈现动态演化特征。前列腺癌早期即出现NGF介导的感觉神经浸润,通过TrkA受体激活PI3K-Akt通路促进肿瘤生长。晚期肿瘤则通过GDNF招募交感神经形成自主神经网络,这种"神经新生"现象在胃癌、乳腺癌等多个瘤种中得到验证。临床病理分析显示神经浸润密度与患者5年生存率呈负相关。
神经调控疗法展现临床应用潜力。II期临床试验(NCT03838029)显示,围手术期使用普萘洛尔联合依托度酸可使胰腺癌患者循环肿瘤细胞减少,其机制与抑制神经源性IL-6/STAT3通路相关。迷走神经刺激(VNS)通过激活胆碱能抗炎通路,在卵巢癌模型中使PD-1抗体疗效提升。
2.2 神经退行性疾病中的免疫失调
阿尔茨海默病(AD)中的神经免疫对话呈现阶段特异性。早期Aβ斑块可激活小胶质细胞TREM2-DAP12信号,促进病变清除;但持续激活导致补体C1q异常沉积,引发突触修剪过度。脑脊液单细胞测序显示AD患者存在Aβ特异性CD8+ T细胞克隆扩增,这些细胞表达高水平颗粒酶B,可直接诱导神经元凋亡。
帕金森病(PD)中的免疫浸润具有区域特异性。黑质致密部存在CXCR4+ TH17细胞浸润,其分泌的IL-17A通过激活神经元NMDA受体引起钙超载(图4)。动物模型显示敲除IL-17RA可保护多巴胺能神经元,而给予IL-17中和抗体可使旋转行为改善。
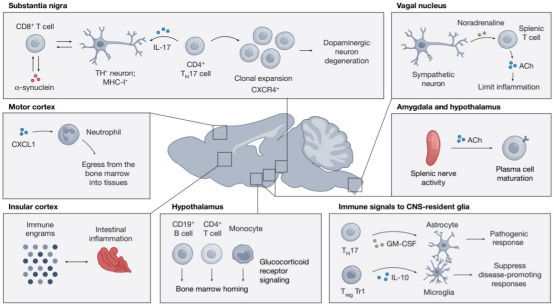
图4. 炎症与神经退行性病变中的神经免疫相互作用
2.3 过敏与自身免疫中的神经敏化
感觉神经元通过神经肽-免疫细胞轴放大过敏反应。尘螨过敏原Der p1可激活肺迷走神经末梢TRPV1通道,诱导速激肽释放,通过NK1R受体激活肥大细胞释放组胺。在特应性皮炎模型中,感觉神经元释放的VIP可促进ILC2细胞IL-5分泌,使嗜酸性粒细胞浸润增加。
神经调控自身免疫具有组织特异性。多发性硬化(MS)患者脑脊液中存在MBP特异性B细胞,这些细胞通过膜结合型BAFF促进Th17分化。而迷走神经刺激可通过激活脾脏胆碱能神经,诱导CD4+ T细胞表达α7nAChR,抑制IFN-γ产生。
三、 环境因素对神经免疫轴的调控
3.1 微生物组-肠-脑轴
肠道菌群代谢产物通过多重途径影响神经免疫。拟杆菌产生的多糖A(PSA)可激活TLR2信号,诱导肠嗜铬细胞分泌5-HT,促进Treg分化(图2)。而梭菌属产生的丁酸通过HDAC抑制调控小胶质细胞成熟,GF小鼠移植丁酸产生菌可使小胶质细胞吞噬能力提升。
3.2 环境化学物质的跨界影响
环境污染物通过表观遗传机制重塑神经免疫稳态。化学物质筛选平台发现,双酚A(BPA)可通过SigmaR1-XBP1轴激活星形胶质细胞NF-κB通路,促进IL-6分泌(图5)。斑马鱼模型显示,十亿分之一浓度的全氟化合物暴露即可改变小胶质细胞形态,使其吞噬能力下降。多环芳烃(PAHs)对DRG神经元TRPV1通道具有双向调节作用:低剂量(10nM)致敏而高剂量(1μM)脱敏,这种剂量效应为环境毒理研究提供新视角。
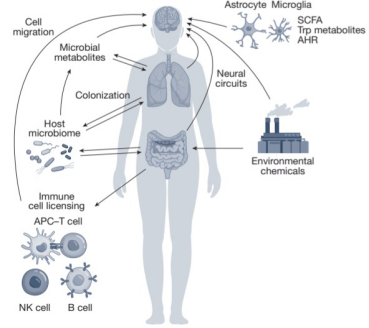
图5. 环境对神经免疫的调控
3.3 昼夜节律与睡眠调控
SCN的节律性输出精准调控免疫细胞迁移。CD11b+ Ly6C(hi)单核细胞表面CX3CR1表达呈现昼夜波动,峰值出现在活动期,这种节律受SCN调控的糖皮质激素波动驱动。临床研究显示,夜班工作者NK细胞毒性降低,疫苗接种后抗体滴度下降,提示昼夜节律紊乱损害免疫记忆形成。
睡眠质量通过脑膜淋巴系统影响神经免疫稳态。睡眠剥夺4小时即可诱导脑膜CXCL13表达升高,促进边缘区B细胞向软脑膜归巢。深度睡眠期脑脊液IL-1β清除率提高,而阻塞性睡眠呼吸暂停患者脑脊液tau蛋白水平升高与淋巴引流受损相关(图6)。
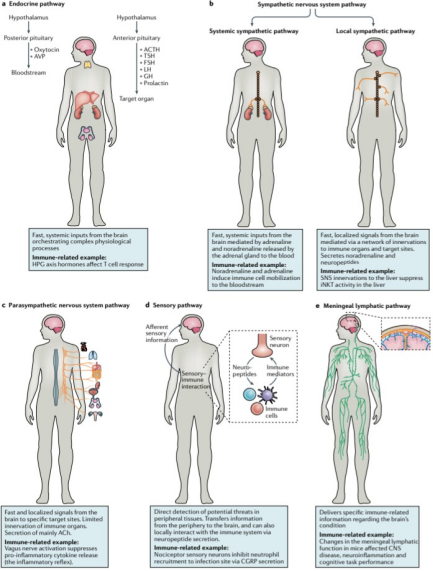
图6. 大脑调控外周免疫
四、 靶向神经免疫轴的治疗策略
4.1 神经调控技术
闭环式神经调控系统展现精准干预潜力。闭环迷走神经刺激装置可实时监测IL-6水平,当浓度超过5pg/mL时自动触发电刺激,在类风湿性关节炎模型中使关节肿胀指数降低。深部脑刺激(DBS)丘脑底核通过激活纹状体多巴胺D1受体,诱导脾脏Treg比例提升,显著改善PD运动症状。
4.2 药物重定位策略
神经精神药物在肿瘤免疫治疗中焕发新生(表1)。丙戊酸联合贝伐珠单抗治疗RAS突变结直肠癌的II期试验(NCT04310176)中,无进展生存期延长。其机制涉及HDAC抑制诱导肿瘤细胞MHC-I表达上调,并促进CD8+ T细胞浸润。三环类抗抑郁药阿米替林通过阻断胶质细胞SERT转运,使脑内5-HT水平升高,在胶质瘤模型中增强替莫唑胺疗效。
表1. 神经精神药物治疗癌症的临床试验

4.3 生物工程干预
合成生物学技术推动精准免疫调控。mRNA工程化T细胞可表达特定神经肽受体,如将VIP受体VPAC1整合至CAR-T细胞,使其对神经母细胞瘤微环境的趋化效率提升。纳米颗粒递送系统实现时空特异性调控,如负载CGRP拮抗剂的脂质体在紫外线触发下定点释放,使银屑病模型PASI评分降低。
五、 未来展望与挑战
单细胞空间组学技术正在揭开神经免疫微环境的神秘面纱。10× Visium平台绘制三叉神经节-皮肤轴突-免疫细胞相互作用图谱,发现ILC2在神经末梢300μm范围内形成"免疫突触"。器官芯片技术可模拟血脑屏障-小胶质细胞-神经元单元,"Neuro-Immune Chip"成功复现了LPS刺激下小胶质细胞IL-1β爆发式分泌及其对突触可塑性的影响。
转化医学面临三大挑战:①神经免疫交互的性别差异(雌激素通过ERα增强小胶质细胞吞噬能力);②发育时间窗特异性(围产期应激对神经免疫系统的远期影响可持续三代);③个体化治疗策略(基于HLA分型的神经肽受体多态性影响药物响应)。解决这些难题需要建立跨学科研究网络,将系统生物学与临床神经免疫学深度整合,最终实现从机制解析到精准干预的跨越。
参考文献:
1. Wheeler MA, Quintana FJ. The neuroimmune connectome in health and disease. Nature. 2025;638(8050):333-342. doi:10.1038/s41586-024-08474-x
2. Gupta S, Viotti A, Eichwald T, et al. Navigating the blurred path of mixed neuroimmune signaling. J Allergy Clin Immunol. 2024;153(4):924-938. doi:10.1016/j.jaci.2024.02.006
3. Magnon C, Hondermarck H. The neural addiction of cancer. Nat Rev Cancer. 2023;23(5):317-334. doi:10.1038/s41568-023-00556-8
4. Schiller M, Ben-Shaanan TL, Rolls A. Neuronal regulation of immunity: why, how and where?. Nat Rev Immunol. 2021;21(1):20-36. doi:10.1038/s41577-020-0387-1
 技术咨询:
技术咨询: